老年呼吸疾病住院患者嗜麦芽窄食单胞菌感染及耐药情况分析▲
杨子林 陈 键
(1 南华大学医学院,湖南省衡阳市 421000,电子邮箱:874987901@qq.com;2 湖南省人民医院暨湖南师范大学第一附属医院检验科,长沙市 410016)
老年呼吸疾病患者由于抵抗力低下以及基础疾病较重,机体防御感染的能力低下,是院内感染嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia,SMA)的易感人群[1]。SMA属于革兰阴性非发酵细菌,广泛存在于自然界和医院环境中。近年来,SMA逐渐成为医院重要的条件致病菌,呼吸疾病住院患者的SMA感染率不断增高[2]。SMA的耐药基因盒可通过整合子介导插入转座子或接合质粒,并在质粒、转座子和染色体之间移动,可导致耐药基因盒的水平增高,增加了临床治疗难度[3]。目前有关SMA的Ⅰ类整合子基因与获得性耐药的系统研究不多。本研究分析老年呼吸疾病住院患者SMA感染及耐药情况,并对SMA携带的Ⅰ类整合酶相关基因进行检测,以期为临床SMA感染的治疗提供参考。
1 资料与方法
1.1 临床资料 2013年1月至2017年12月间在湖南省人民医院住院的老年呼吸疾病患者共3 719例,其中有402例感染SMA。402例患者中,男257例,女145例,年龄65~92(68.1±8.2)岁;肺部感染患者187例,慢性阻塞性肺疾病急性加重期患者143例,支气管扩张并感染患者72例。纳入标准:经临床确诊为医院获得性肺炎(包括呼吸机相关性肺炎)、慢性阻塞性肺疾病急性发作、支气管扩张症并感染等常见呼吸系统疾病;患者白细胞计数或中性粒细胞分类增高,胸部影像学提示肺部感染;按照第4版《全国临床检验操作规程》[4]中的要求,经痰涂片、痰培养分离到SMA。所有患者均签署知情同意书,本研究通过医院伦理委员会同意。
1.2 研究方法
1.2.1 SMA药敏试验:采用长沙天地人生物科技有限公司TDR-300型微生物全自动鉴定系统,参照2017年美国临床和实验室标准化协会推荐的方法和判断标准[5],检测402株嗜麦芽窄食单胞菌对头孢他啶、替卡西林/克拉维酸、头孢哌酮/舒巴坦、米诺环素、左氧氟沙星、替加环素、复方新诺明、氯霉素的最低抑菌浓度,并判断其是否对相应药物产生耐药。
1.2.2 SMA DNA模板制备:研究对象中痰标本的采集严格按照诊断标准[6]:细菌浓度≥107 cfu/ml或连续两次细菌浓度105 cfu/ml~106 cfu/ml则视为病原菌,同时白细胞计数增高或中性粒细胞分类增高及胸部CT显示肺部感染。细菌质量控制菌株为大肠杆菌、铜绿假单胞菌,均购自原卫生部临床实验室中心(批号:ATCC25922、ATCC27853)。将待测菌在血平板上培养18~24 h后,取8个菌落置于200 μl灭菌双蒸水中研磨制成新鲜菌悬液;95℃煮沸10 min,-20℃放置5 min,13 000 r/min离心10 min,取上清液作为DNA模板提取物。
1.2.3 整合酶、耐药基因的检测:检测的整合酶、耐药基因包括Ⅰ类整合子1类整合酶(class Ⅰ integron class 1 integrase,IntⅠ1)、Ⅰ类整合子2类整合酶(class Ⅰ integron class 2 integrase,IntⅠ2)、Ⅰ类整合子3类整合酶(class Ⅰ integron class 3 integrase,Int Ⅰ 3)、消毒剂-磺胺类耐药基因1(qacEΔ1-Sul 1)、磺胺类耐药基因2(sulfonamide resistance gene 2,Sul 2)、甲氧苄啶耐药基因dfrA12。所有基因引物序列均由北京三博远志生物公司合成,见表1。PCR反应体系:上下游引物各1 μl,DNA模板2 μl,Taq DNA聚合酶0.2 μl,10×PCR缓冲液(Mg2+)2.5 μl,脱氧核糖核苷三磷酸(2.5 mmol/L)2.0 μl,双蒸水将体积补至25 μl。反应程序:95℃预变性5 min;94℃ 30 s、50℃ 40 s、72℃ 40 s,共35个循环;72℃延伸10 min。采用LifeECO基因扩增仪(杭州博日有限公司)进行扩增基因,PCR产物经2%琼脂糖凝胶电泳验证是否扩增成功。

表1 PCR扩增引物序列
1.3 统计学分析 采用SPSS 20.0软件进行统计分析。计量资料以(x±s)表示;计数资料以例数(百分比)表示,采用线性趋势检验分析不同年份间感染率和耐药率的变化趋势。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同年份老年呼吸疾病患者SMA的感染率 2013~2017年老年呼吸疾病患者SMA总感染率为10.8%(402/3 719),SMA感染率有逐年增加的趋势(P<0.05),见表2。
2.2 不同年份SMA对不同抗生素的耐药性 共检出236例SMA耐药菌株、166例SMA非耐药菌株。不同年份中,SMA对氯霉素的耐药率均最高,其次为头孢他啶和替卡西林/克拉维酸;SMA对头孢哌酮/舒巴坦、米诺环素、复方新诺明和替加环素的耐药率均低于30%。SMA对头孢他啶、替卡西林/克拉维酸、米诺环素、复方新诺明、替加环素和左氧氟沙星的耐药率均有逐年增加的趋势(均P<0.05)。见表3。
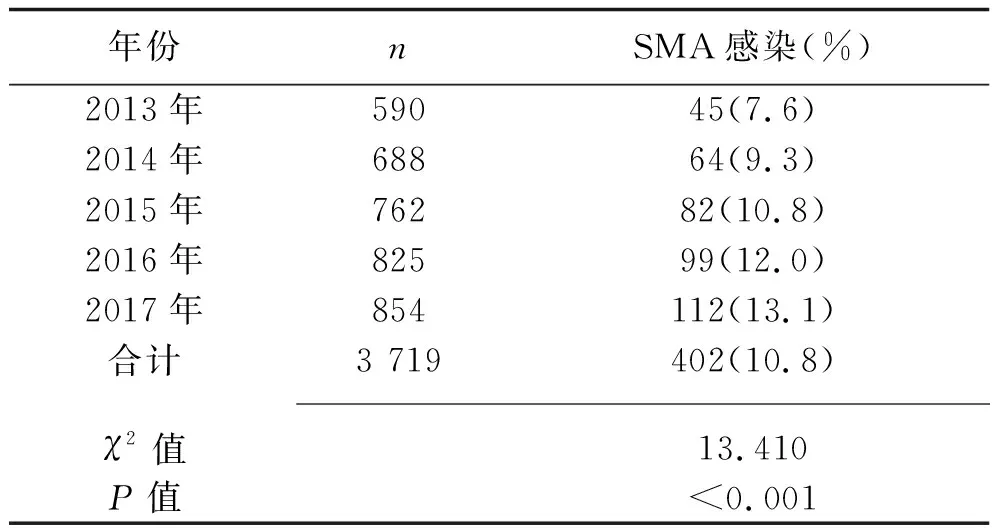
表2 2013~2017年老年呼吸疾病患者的SMA感染率[n(%)]
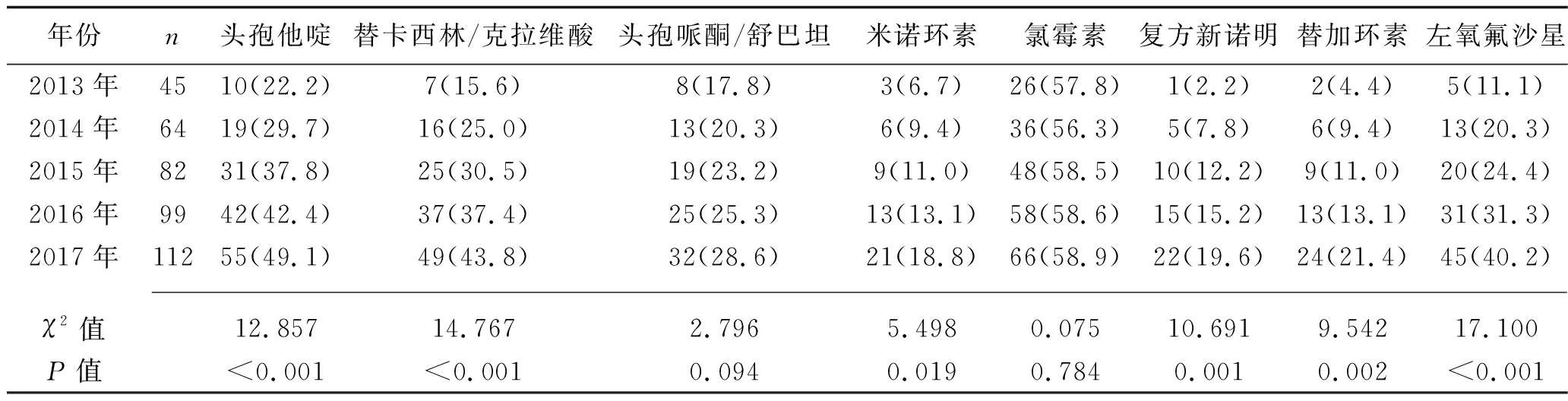
表3 2013~2017年SMA对8种抗生素的耐药情况[n(%)]
2.3 不同年份SMA耐药基因检测情况 402株SMA中,有204株Int Ⅰ 1基因阳性,阳性率为50.7%;未检出Int Ⅰ 2和Int Ⅰ 3基因阳性菌株。在236例耐药菌株中Int Ⅰ 1基因阳性率为67.4%(159/236),166例非耐药菌株中Int Ⅰ 1基因阳性率为27.1%(45/166),两者比较差异有统计学意义(χ2=63.211,P<0.001)。趋势性检验结果显示,SMA的qacEΔ1-Sul 1、IntⅠ1、dfrA12基因阳性率有逐年上升的趋势(P<0.05),见表4。在对复方新诺明耐药的53株SMA中共29株qacE△1-sul 1合并Int Ⅰ 1基因阳性,6株qacE△1-Sul 1、Sul 2、IntⅠ1基因均阳性,18株仅IntⅠ1基因阳性。
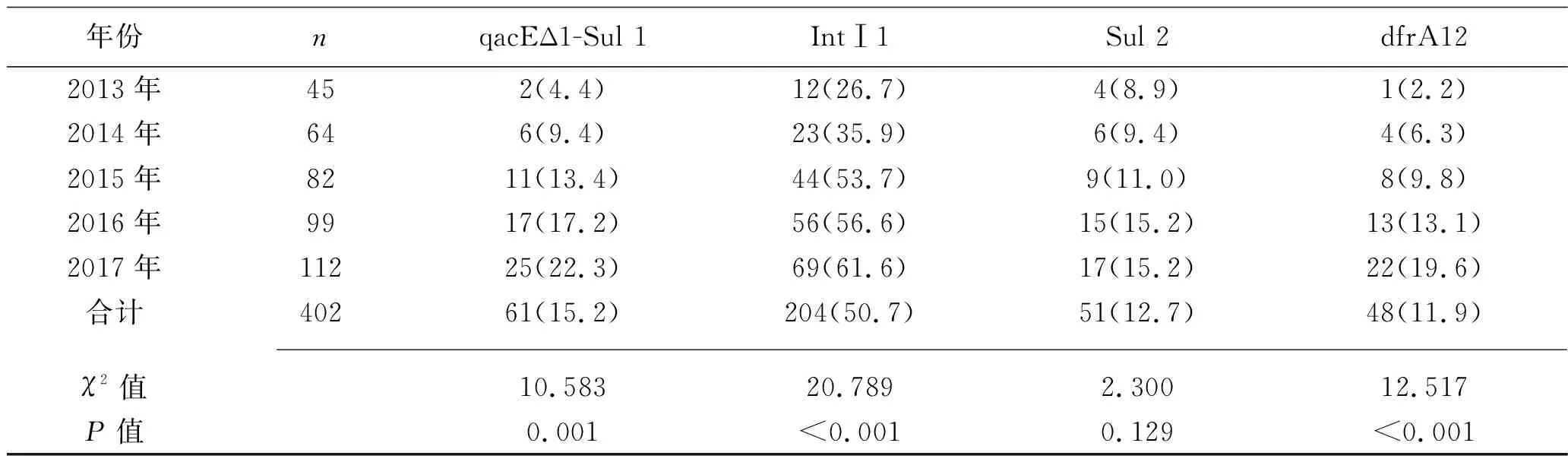
表4 2013~2017年SMA耐药基因检测结果[n(%)]
3 讨 论
根据2016年中国细菌耐药监测网的数据[7],在非发酵细菌中,SMA的分离率仅次于铜绿假单胞菌和不动杆菌。本研究结果显示,2013~2017年我院老年呼吸疾病住院患者SMA感染率为10.8%(402/3 719),高于徐鸣皋等[1]的研究结果。此外,SMA感染率呈逐年增加的趋势(P<0.05)。老年呼吸疾病住院患者各器官功能及免疫功能低下,存在呼吸功能减退或营养不良等情况,且长期住院患者需接受机械通气和深静脉置管等操作,而我院老年住院患者年龄偏大,这均导致近年间SMA感染率逐年上升。因此,在进行医院感染控制时,应将老年呼吸疾病住院患者作为SMA感染的高危人群进行监测。
2013~2017年,在我院老年呼吸疾病住院患者中检出的SMA对头孢他啶、替卡西林/克拉维酸、复方新诺明、左氧氟沙星和替加环素的耐药率呈逐年上升趋势,且对头孢他啶、头孢哌酮/舒巴坦、左氧氟沙星的耐药率高于国内相关研究的结果[8]。这可能是因为大部分老年呼吸内科患者的病程较长,且其所患疾病具有易复发的特点;另外,临床上大量的经验性用药或盲目使用抗生素,导致了SMA耐药菌株数量的增加,并造成了SMA对多种药物耐药。这种现象给临床治疗造成巨大困难,而由耐药菌引起的菌血症又是导致抗感染治疗失败及死亡的重要原因,因此,必须对抗生素的使用进行规范化管理。
SMA的耐药基因突变率高,往往导致体外药敏试验和临床治疗效果不一致,而这与其整合子系统有关[9-10]。SMAⅠ类整合子系统中的IntⅠ1、IntⅠ2和 IntⅠ3基因分别主要编码Ⅰ、Ⅱ、Ⅲ类整合酶,这些整合酶是捕获外来基因并将其转化为功能基因的功能单元。整合子可以位于转座子质粒等可移动基因原件上,并可在不同种的细菌之间进行水平转移,这导致了耐药基因盒的水平增高[11],并与耐药基因的传播密切相关。大多数Ⅰ类整合子的5′端相似,但3′端具有差异,其5′端有编码整合酶的IntⅠ基因和启动子,3′端有3个开放读码框,即季铵盐化合物及溴乙啶的耐药基因(qacEΔ1)、磺胺耐药基因(Sul)和功能不明的阅读框。本研究结果显示,402株SMA中有204株IntⅠ基因阳性菌,阳性率为50.7%,高于赵苏瑛等[12]的研究结果。趋势性检验结果显示,Int Ⅰ 1基因阳性率呈逐年上升的趋势,且236例SMA耐药菌株中Int Ⅰ 1基因阳性率高于非耐药菌株(均P<0.05)。另外本研究未发现IntⅠ2和IntⅠ3阳性菌,提示IntⅠ1基因或许是导致老年呼吸疾病住院患者感染的SMA耐药性增加的原因。本研究中,236例SMA耐药菌株中有77例的IntⅠ1为阴性,分析其原因可能是由于IntⅠ1基因发生突变,导致PCR扩增失败;也可能是IntⅠ1阴性的SMA耐药株通过非IntⅠ1基因机制引起耐药,如产生β-内酰胺酶、氨基糖苷类修饰酶、多药外排泵等。而在166例SMA非耐药菌株中,有45例IntⅠ1阳性,说明不是所有的整合子都携带耐药基。由此可见,无论在SMA耐药菌株还是在SMA非耐药菌株中,均存在药物耐药性检测结果与基因型耐药检测结果不一致的情况。因此,继续深入研究SMA中的整合子系统与耐药基因的关系具有重要意义。
复方新诺明是磺胺甲噁唑/甲氧苄啶的复合制剂,是治疗SMA感染的首选药物。本研究共发现53株SMA对复方新诺明耐药,且其耐药率呈逐年上升的趋势(P<0.05);目前认为SMA对复方新诺明的耐药机制主要与获得的二氢叶酸合成酶(编码基因sul)和Ⅰ类整合子携带的季铵盐化合物耐药基因(编码基因qac)有关[13-14]。本研究结果也显示,qacE△1-Sul 1合并IntⅠ1阳性共29株,qacE△1-Sul 1、Sul 2和IntⅠ1同时阳性6株,仅IntⅠ 1阳性有18株。另有学者指出,SMA对复方新诺明的耐药机制还与获得的二氢叶酸还原酶(编码基因dfrA)有关[15]。但本研究中,对复方新诺明耐药的SMA均未检测到dfrA12阳性菌。对复方新诺明耐药的SMA出现IntⅠ1阳性而qacE△1-Sul 1阴性以及未检测到dfrA12的原因可能是Ⅰ类整合子3′保守区域片段发生缺失、突变或者被插入序列取代,导致PCR扩增失败。
综上所述,老年呼吸疾病住院患者SMA的感染率较高,SMA对抗菌药物耐药率、整合酶基因、耐药基因检出率逐年增加。因此,临床上应采用细菌培养的方法来密切监测SMA的感染情况,重视药物敏感试验中的耐药结果,并寻找新的抗感染方法来改变细菌多重耐药和耐药基因的演变发展状况,同时应合理使用抗生素以防止耐药基因的传播。

