激酶LMTK3在前列腺癌组织中的表达及临床意义①
泮红飞 罗军敏 杨涛羽 苏 俊 张 红 龙润莹 冯继红
(遵义医学院免疫学教研室,贵州省普通高等学校特色药物肿瘤防治特色重点实验室,遵义 563000)
前列腺癌(prostate cancer,pCa)是欧美等发达国家男性中最常见的恶性肿瘤,其死亡率升至男性恶性肿瘤第二位[1,2]。虽然我国前列腺癌的发病率、死亡率均低于世界平均水平,但近年显著增长且呈年轻化趋势[3]。LMTK3是丝氨酸/苏氨酸/酪氨酸激酶家族(Serine-threonine-tyrosine kinase family)的重要成员,在乳腺癌[4]、甲状腺癌[5]、肺癌[6]、胃癌[7]、结直肠癌[8]及慢性中性粒细胞白血病(Chronic neutrophilic leukemia,CNL)[9]等多种恶性肿瘤组织中均高表达,提示LMTK3可能在多种恶性肿瘤的发生发展中起重要作用。但Sun等[10]报道LMTK3在前列腺癌组织中低表达,在体外能抑制前列腺癌细胞的恶性生物学行为,参与非ER信号途径。而近年来,雌激素对前列腺癌的作用越来越受到重视,雌激素在前列腺癌中主要通过雌激素受体(Estrogen receptor,ER)发挥作用,目前对ERα的研究较多,但对其表达部位和作用的研究尚有争议。本研究通过免疫组织化学(Immunohistochemistry,IHC)方法检测前列腺癌及前列腺增生组织中LMTK3和ERα的表达情况,分析其与临床病理资料的关系及二者表达量间的相关性,初步探究LMTK3在前列腺癌进展中的作用及临床意义。
1 材料与方法
1.1实验材料、试剂和仪器
1.1.1材料来源 收集遵义医学院附属医院2011年1月~2016年7月经手术或穿刺活检并经病理首次确诊的55例前列腺癌组织标本和25例前列腺增生(Benign prostatic hyperplasia,BPH)组织标本,术前均未行放化疗和内分泌治疗。患者年龄42~89岁,平均(71.18±8.56)岁,其中无淋巴结转移者25例,有淋巴结转移者30例;按照Gleason评分标准进行的病理分级[11]:高分化癌2例,中分化癌15例,低分化癌38例;按照Whitmore-Jewett系统进行的临床分期:1+2期25例,3+4期30例。所有标本均经10%甲醛固定,石蜡包埋后行3 μm厚连续切片,做免疫组化染色。操作步骤严格按照试剂盒说明书进行检测。
1.1.2主要试剂和仪器 LMTK3兔抗人多克隆抗体购自Lifespan公司;ERα兔抗人多克隆抗体购自 Abcam公司;PV-9000免疫组化试剂盒(HRP标记,不需稀释)、浓缩型DAB试剂和苏木素染液购自北京中杉金桥生物技术有限公司;全自动时间分辨荧光免疫分析仪(1235-auto-DELFIA)和TPSA检测试剂盒购自美国PerkinElmer公司。
1.2实验方法
1.2.1总前列腺特异性抗原(Total prostate specific antigen,TPSA)的检测方法 空腹抽血3 ml,离心,取血清于2 h内采用高灵敏度的时间分辨荧光免疫分析(TrFIA)双标法测定TPSA的含量。
1.2.2免疫组织化学染色 石蜡组织切片经脱蜡、柠檬酸盐抗原修复后,3%过氧化氢(PV-9000免疫组化试剂盒里的试剂①阻断内源性过氧化物酶,血清封闭后,分别滴加抗LMTK3的一抗(1∶100稀释)和抗ERα的一抗(1∶100稀释),4℃孵育过夜,PBS冲洗,滴加二抗(PV-9000免疫组化试剂盒里的试剂②和试剂③,室温孵育1.5 h,DAB和苏木素显色,对比染色封片。用PBS液(pH=7.2~7.4)代替一抗作阴性对照。
1.2.3免疫组织化学检测结果判定标准 胞浆着黄色或棕褐色为LMTK3蛋白染色阳性。双评半定量法进行评分:(1)染色强度分四级:不着色者为0分,浅黄色者为1分,棕黄色者为2分,棕褐色者为3分;(2)着色细胞百分比分五级:阳性细胞比例≤5%为0分,阳性细胞比例6%~25%为1分,阳性细胞比例26%~50%为2分,阳性细胞比例51%~75%为3分,阳性细胞比例76%~100%为4分。两种评分相加为最终得分,总分在0~1分表示阴性,2~3分表示弱阳性,4~5分表示阳性,6~7分表示强阳性、阴性和弱阳性代表LMTK3低表达,阳性和强阳性代表LMTK3高表达。
1.3统计学处理 免疫组织化学结果采用χ2检验、Fisher确切概率法、Pearson和Spearman相关检验分析数据,采用SPSS18.0软件进行数据处理。P<0.05代表有统计学意义。
2 结果
2.1免疫组织化学方法测前列腺癌和前列腺增生组织中相关蛋白的表达情况
2.1.1免疫组织化学方法测前列腺癌和前列腺增生组织中LMTK3蛋白的表达 LMTK3在前列腺上皮细胞和间质细胞中均有表达,且以在上皮细胞的表达为主。55例前列腺癌中LMTK3强阳性9例,阳性11例,弱阳性3例,阴性32例;LMTK3阳性病例占36.36%。而在25例良性前列腺增生组织中LMTK3强阳性6例,阳性10例,弱阳性1例,阴性8例;LMTK3阳性病例占64.00%,两组比较差异具有统计学意义(χ2=5.304,P<0.05)(图1、表1)。
2.1.2免疫组织化学方法检测前列腺癌和前列腺增生组织ERα蛋白表达 ERα蛋白在前列腺上皮细胞和间质细胞中均有表达,且以在间质细胞的表达为主。55例前列腺癌中ERα强阳性5例,阳性13例,弱阳性2例,阴性35例;阳性病例占32.73%。而在25例良性前列腺增生组织中ERα强阳性7例,阳性7例,弱阳性1例,阴性10例;阳性病例占56.00%,两组比较差异有统计学意义(χ2=3.879,P<0.05)(图2、表2)。
2.2LMTK3、ERα在前列腺癌和前列腺增生组织中的表达与前列腺癌患者临床病理资料关系 LMTK3蛋白在前列腺癌和前列腺增生组织中的表达水平与Gleason分级负相关(P<0.05),随着年龄和TPSA含量的升高而降低,与临床分期和淋巴结转移相关性不强,差异均无统计学意义(P>0.05,表3);ERα蛋白在前列腺癌和前列腺增生组织中的表达水平与TPSA含量和Gleason分级负相关(P<0.05),与患者年龄、临床分期和有无淋巴结转移等参数相关性不强(P>0.05,表4)。
2.3LMTK3、ERα在前列腺癌和前列腺增生组织中表达的相关性分析 采用Pearson和Spearman分析LMTK3与ERα蛋白在前列腺癌和前列腺增生组织中表达的相关性,分析结果如表5所示,二者呈正相关(r=0.296,P=0.024)。
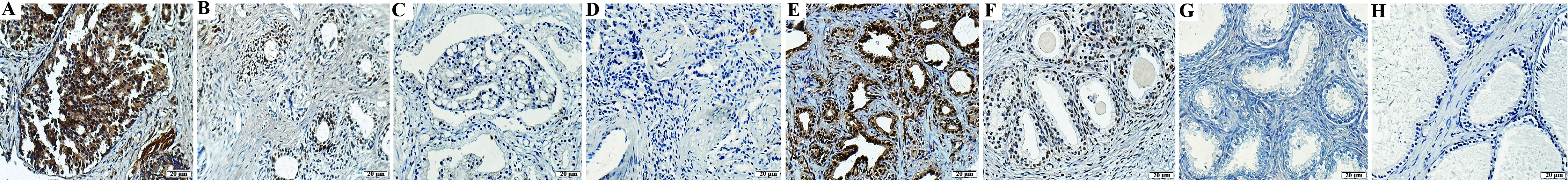
图1 LMTK3在前列腺癌和前列腺增生组织中的免疫组化(SP,×40)Fig.1 Immunohistochemical staining of LMTK3 in prostate cancer and benign prostatic hyperplasia tissues(SP,× 40)Note: A.Strong positive;B.Positive;C.Negative;D.Control;E.Strong positive;F.Positive;G.Negative;H.Control.

图2 ERα在前列腺癌组织和前列腺增生组织中的免疫组化染色结果(SP,× 40)Fig.2 Immunohistochemical staining of LMTK3 in prostate cancer and benign prostatic hyperplasia tissues(SP,× 40)Note: A.Strong positive;B.Positive;C.Weak positive;D.Negative;E.Strong positive;F.Positive;G.Negative;H.Control

表1 LMTK3蛋白在前列腺癌及前列腺增生组织中的表达情况
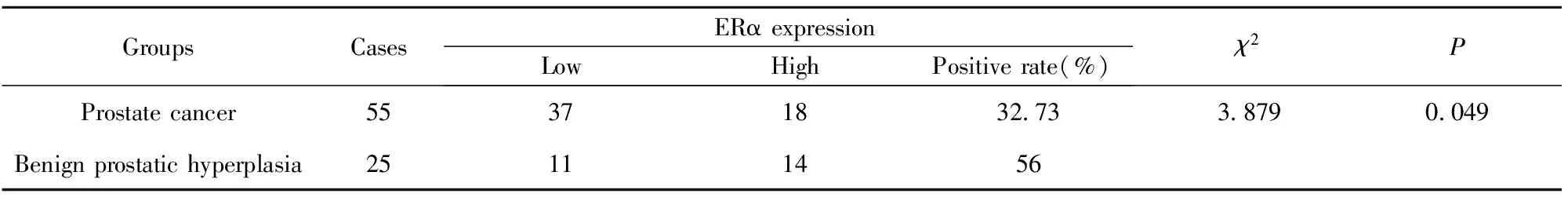
表2 ERα蛋白在前列腺癌及前列腺增生组织中的表达情况

表3 LMTK3蛋白在前列腺癌和前列腺增生组织中的表达及其与临床资料相关性

表4 ERα蛋白在前列腺癌和前列腺增生组织中的表达及其与临床资料相关性

表5 LMTK3与ERα在前列腺癌与前列腺增生组织中表达的相关性分析
3 讨论
目前,有关前列腺癌的研究还不足以充分阐明其发病机制。因此,从分子水平深入探究其癌变机制,寻找新型可靠的预防、诊断或治疗前列腺癌的靶基因及其相关调控基因具有重要意义。由于前列腺癌并不发生于雄激素水平较高的青年,而发生于雄激素水平已经下降的老年,提示雄激素不是导致前列腺疾病的唯一因素,而雌激素及其受体受到越来越多的关注[12]。
目前对于ERα在前列腺组织中的表达部位及其功能的研究尚存在争议。Leav等[13]认为ERα主要位于前列腺组织中的基底上皮细胞和间质细胞;宋益挺等[14]发现ER在BPH组织中高表达,推测其可能促进BPH的发生;先前研究证明ERα在正常前列腺组织中呈低表达,在BPH中高表达,而在pCa中表达下降(P<0.01),在前列腺癌淋巴结转移及骨转移区域无表达。与上述研究不同,以下研究却得出不同的结论:覃展偶等[15]发现ERα主要在前列腺组织的间质细胞中表达,上皮细胞中无表达;检测健康人群和BPH患者前列腺组织中ERα的表达,结果提示人BPH组织中ERα的表达显著降低;现有研究报道报道在前列腺癌发展过程中,ERα的表达从基底细胞扩展到腔细胞并且表达水平增加,ERα在低分化与转移性前列腺癌中均高表达,认为ERα可能参与了前列腺组织的癌变进程[17-19]。
狐猴酪氨酸激酶家族的成员包括LMTK1、LMTK2和LMTK3,编码人类LMTK3的基因定位在19q13.33,是单次跨膜蛋白。LMTK3可通过催化ERα磷酸化参与多条细胞信号通路的转导,在细胞的增殖、转移、侵袭、分化、成瘤、耐药和凋亡等病理生理过程中扮演重要角色。Stebbing等[4]认为激酶与ERα之间的相互作用是人类乳腺癌的关键信号通路。Mackiewicz等[20]研究发现,miR-34a可通过调节ER的活性抑制乳腺癌细胞的增殖和细胞周期进程,并抑制裸鼠种植瘤的生长,而Zhao等[21]发现LMTK3是miR-34a的靶点。Giamas等[22]认为在乳腺癌中LMTK3是调控ERα最有效的因子。沉默LMTK3能激活PKC从而导致Akt的磷酸化、FOXO3的降解,进而降低ERα的转录活性和蛋白表达量。此外,LMTK3还能直接磷酸化ERα,在蛋白水平上保护它免受蛋白酶体的降解,且沉默LMTK3基因可抑制ERα阳性乳腺癌细胞的增殖和裸鼠种植瘤的生长。Stebbing等[23]证明LMTK3能够在转录和翻译两个层面促进他莫昔芬耐药基因的表达,导致对他莫昔芬的耐药。综上所述,LMTK3通过调节ERα的活性影响乳腺癌细胞的增殖能力和成瘤性,参与乳腺癌内分泌治疗的耐药过程。
Sun等[10]证明LMTK3在前列腺上皮细胞中表达,与正常组织相比,LMTK3在前列腺癌中的表达水平明显下降。LMTK3在体外能抑制PC3和LNCaP细胞的生长、迁移和侵袭,并诱导细胞凋亡,在体内能诱导PC3细胞凋亡。且LMTK3能够抑制AKT和ERK磷酸化,进而促进p38激酶和JNK激酶的磷酸化和激活。由于目前尚无LMTK3在pCa患者中的表达与临床病理参数和ER间的相关性报道,因此,本研究以BPH作为对照,采用免疫组织化学方法检测LMTK3、ERα在前列腺癌组织中的表达及其与临床病理参数和ER间的相关性。结果显示LMTK3、ERα在前列腺癌组织中的表达明显低于其在前列腺增生组织中的表达,二者的阳性率随着肿瘤Gleason分级的增高而明显下调,且ERα与TPSA含量亦呈负相关性。另外,通过相关性分析,我们发现LMTK3的表达量和ERα的表达量间存在正相关关系,提示LMTK3可能通过ERα参与前列腺癌的进展。由此可见,LMTK3可能在前列腺癌的发生发展过程中扮演重要角色,并可能通过ERα参与前列腺癌的进程,而LMTK3的低表达机制及参与前列腺癌进程的机制还有待做进一步的深入探索。
综上所述,LMTK3在前列腺癌组织中的表达明显低于其在前列腺增生组织中的表达,且在前列腺组织中LMTK3与ERα的表达量存在正相关关系。通过对前列腺癌组织中LMTK3表达水平的研究,有助于了解LMTK3的低表达机制及与前列腺癌进程的关系,LMTK3也有望成为有潜在价值的前列腺癌干预靶点。

