利用MTT建立一种快速检测青枯菌活菌的方法
周大祥,熊 书,谢桂香
(1.重庆三峡学院 生命科学与工程学院,万州 404120;2.重庆三峡医药高等专科学校 基础医学部,万州 404120)
建立一种快速检测细菌活菌的方法具有一定的应用价值。MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]是一种最简单的方法,MTT作为一种水溶性的黄色染料,被活菌的脱氢酶系还原生成不溶于水的蓝紫色甲臜晶体,而死菌不能将MTT还原成甲臜[1]。当有机溶剂溶解生成的甲臜晶体后,能够被分光光度计定量测定,其浓度与活菌数量成正比[2-3]。MTT法最初用于培养贴壁动物细胞的生物学及生物医学研究[4-6]。相比传统的方法,MTT法具有得天独厚的优势,因为利用96孔板可以进行大量测定,而不用花费大量时间进行菌落计数或者同位素测定[7]。但是常规的MTT法使用96孔板时,吸光度读数不稳定。在测定大肠杆菌时,甲臜晶体聚集和沉淀在细胞底部,而且用DMSO溶解时,不能完全去除培养基,这样会不断地增加背景吸收(10~60 min内),因而不能准确地获得吸光度值[8]。
青枯菌(Ralstoniasolanacearum)是全球范围内造成严重危害的重要植物病原细菌,可侵染50多个科的数百种植物,是世界上分布最广、危害最重且最难防治的重大细菌性病害。本研究的目的是对MTT法检测青枯菌活菌进行优化,建立一种有效快速检测青枯菌活菌的方法。通过研究MTT用量、反应时间、最佳检测波长和甲臜晶体溶解等过程,得到更准确、稳定的吸光度值。本研究建立了一种快速检测细菌活菌的方法,具有一定的应用价值。
1 材料与方法
1.1 材料
菌株:青枯菌从烟草植株上分离,由西南大学植物保护学院馈赠。NA培养基培养,菌株在常温下保存于灭菌蒸馏水中。
试剂:MTT(四甲基偶氮唑盐,Amresco公司),临用前用无菌蒸馏水溶解,浓度为5 mg/mL,60℃水助溶,4℃避光保存。三联液(SDS 10 g,异丙醇5 mL,10 mol/L HCl 0.1 mL),用蒸馏水溶解配成100 mL溶液,4℃保存。
仪器:岛津紫外可见扫描分光光度仪、Bio-Rad680酶标仪
1.2 方法
1.2.1 青枯菌死活菌悬液的制备
青枯菌接种于20 mL NA液体培养基中,摇床培养(28℃,250 r/min)至A600约为3.0(以NA培养基为对照),得到活菌悬液(细菌密度约为2.0×109CFU/mL)。
1.2.2 最大吸收波长的确定
取摇床培养的青枯菌悬液1 mL,10 000 r/min离心30 s,弃上清,再用1 mL NA液体培养基重悬。NA液体培养基稀释菌液A600为0.3,37℃预热,同时预热MTT溶液和1.5 mL无菌离心管。取30 μL MTT溶液加入300 μL稀释的菌液中,37℃孵育20 min。再加入3 mL 三联液室温放置过夜以溶解甲臜,4000 r/min离心5 min,小心取上清液扫描分光光度仪测定500~600 nm的吸光度值。
1.2.3 最佳菌浓度和MTT用量的确定
取A600为0.1、0.2和0.3的稀释菌液各300 μL,分别加入5、10、20、30、40、50 μL的MTT,37℃孵育20 min,其它步骤同1.2.2,取100 μL上清液加入96孔板中,每组设5个复孔,下同,测定512 nm的吸光度值。
1.2.4 最佳MTT反应时间的确定
取A600为0.1、0.2和0.3的稀释菌液各300 μL,加入30 μL MTT后,37℃分别孵育5、10、20、30、40和50 min,其它步骤同1.2.2,取100 μL上清液加入96孔板中,测定512 nm的吸光度值。
1.2.5 最佳三联液用量的确定
取A600为0.3的稀释菌液300 μL,加入30 μL MTT后,37℃孵育20 min,生成的甲臜再分别用1、2、3、4和5 mL三联液溶解,其它步骤同1.2.2,取100 μL上清液加入96孔板中,测定512 nm的吸光度值。
1.2.6 三联液溶解甲臜晶体时间的确定
取A600为0.3的稀释菌液300 μL,加入30 μL MTT后,37℃孵育20 min,生成的甲臜再用3 mL三联液分别溶解1、2、4、8和12 h,其它步骤同1.2.2,取100 μL上清液加入96孔板中,测定512 nm的吸光度值。
1.2.7 甲臜晶体在三联液中的溶解性
取A600为0.3的稀释菌液300 μL,取30 μL MTT溶液加入300 μL稀释的菌液中,37℃孵育20 min,生成甲臜晶体10 000 r/min离心30 s,小心弃上清,使剩余液体不超过20 μL。生成的甲臜溶液分别取10、20、30、60、90和120 μL,各加入3 mL 三联液室温放置过夜以溶解甲臜,4000 r/min离心5 min,取100 μL上清液加入96孔板中,测定512 nm的吸光度值。
1.2.8 平板计数法验证MTT法检测结果
取A600为0.3的稀释菌液(经平板计数细菌密度为2.0×108CFU/mL)于沸水煮5 min,得到青枯菌死菌悬液。将死菌在NA平板上划线,28℃培养24~72 h,验证其致死效果。
分别取A600为0.3的稀释活菌液300、250、200、150、100、50和0 μL于1.5 mL无菌离心管中,对应加入0、50、100、150、200、250和300μL的上述死菌悬液,混匀后,各加入30μL MTT,37℃孵育20 min,再加入3 mL三联液室温放置过夜以溶解甲臜,4000 r/min离心5 min,取100 μL上清液加入96孔板中,测定512 nm的吸光度值。同时,各混匀的菌悬液分别进行平板计数验证。
1.2.9 数据分析
SPSS 19.0对试验数据进行t检验,P<0.05表示具有显著性差异。
2 结果与分析
2.1 最大吸收波长
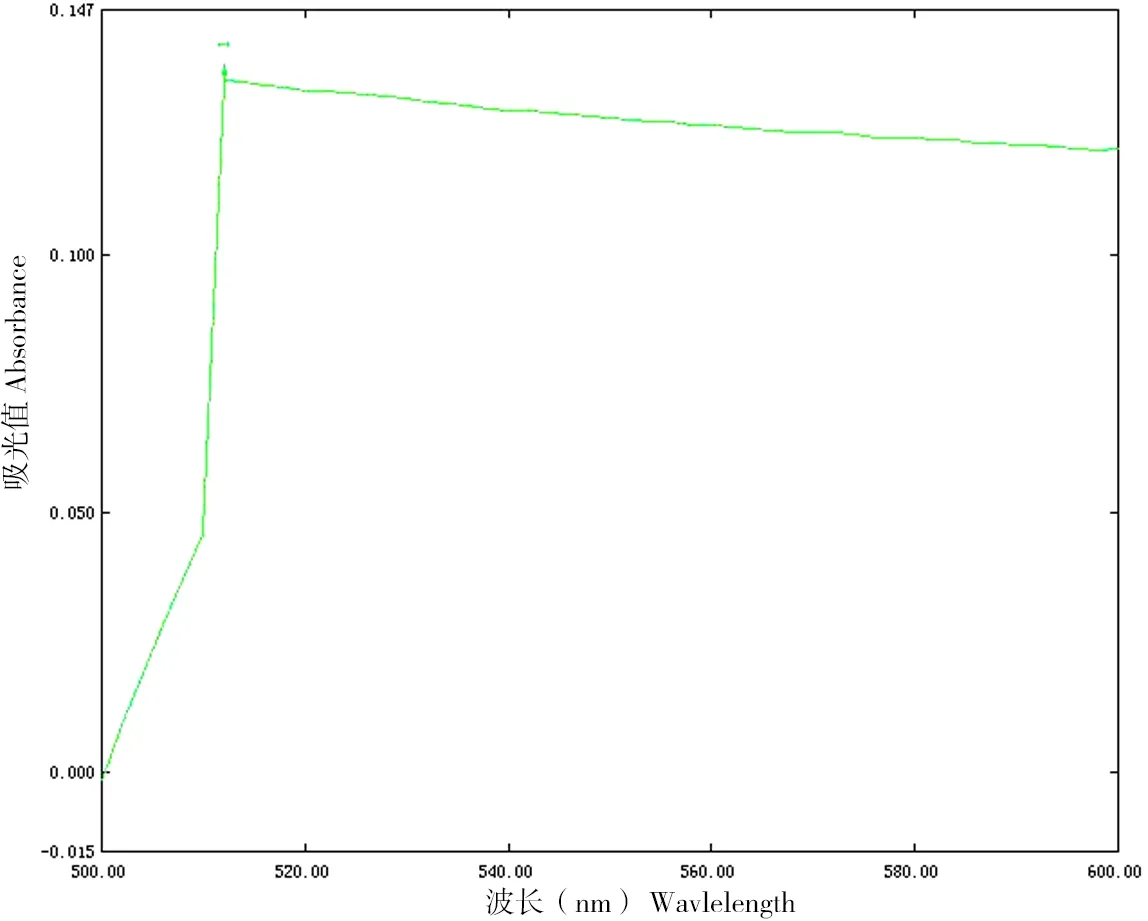
图1 MTT法测定青枯菌活性的扫描波长Figure 1 Scanning wavelength of Ralstonia solanacearum measured by MTT
图1显示,青枯菌与MTT反应生成的甲臜晶体经三联液溶解后,在500~600 nm范围内最大吸收波长为512 nm。因此,后续实验选择512 nm作为检测生成甲臜的波长。
2.2 最佳菌浓度和MTT用量
当菌浓度和MTT用量增加,生成的甲臜逐渐增多。当A600为0.3的稀释菌液加入的MTT超过30 μL时,甲臜的生成率突然降低(图2)。原因在于MTT反应期间,不溶于水的甲臜晶体沉积在菌体表面。因此,随着反应进行,在脱氢酶系周围,反应空间更小,导致甲臜的生成率突然降低。所以本实验最佳MTT用量为30μL,菌液浓度A600为0.3。
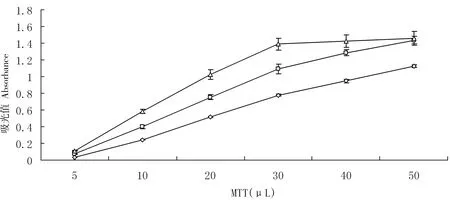
青枯菌用新鲜的NA液体培养基稀释到A600为0.3(△)、0.2(□)和0.1(◇)
图2 MTT用量与吸光度值的关系
Figure 2 Relationship between MTT dosage and absorbance
2.3 最佳MTT反应时间
图3-A显示,不同数量的青枯菌还原MTT,甲臜晶体在前20 min迅速生成,随后生成缓慢。本研究的青枯菌被大致认为是一个脱氢酶体系,在MTT还原反应期间,不溶于水的甲臜晶体沉积在菌体表面。因此,随着反应进行,在脱氢酶系周围,反应空间更小,MTT反应时间超过20 min导致甲臜的生成率突然降低。图3-B显示A512的数值(在0.001~1.391)与菌体数量(A600在0.01~0.3)线性关系良好。因此,我们建议青枯菌应被NA培养基稀释到A600为0.01~0.3之间,MTT还原反应控制在20 min以内。
2.4 最佳三联液用量
表1显示,当三联液用量为3 mL,溶解的甲臜晶体最多,超过3 mL,甲臜晶体的溶解不再显著增加,所以三联液溶解甲臜晶体的最佳用量为3 mL。
2.5 最佳三联液溶解甲臜晶体时间
由表2可以看出,当三联液处理8 h以内,溶解时间越长,溶解的甲臜晶体越多,超过8 h,甲臜晶体的溶解不再显著增加,所以三联液溶解甲臜晶体的最佳时间为8 h,放置过夜即可。
2.6 甲臜在三联液中的溶解性
图4显示A512的数值与甲臜溶液(10~120 μL)线性关系良好。因此,我们建议生成的甲臜溶液取10~120 μL之间为好。

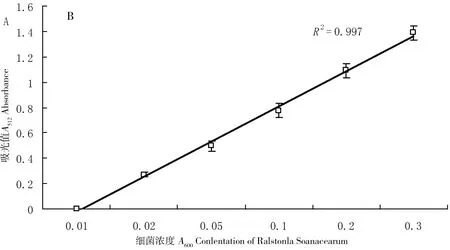
A:MTT还原时间;B:MTT还原法的线性关系;青枯菌用新鲜的NA液体培养基稀释到A600为0.3(△)、0.2(□)和0.1(◇)
图3 MTT被青枯菌还原
Figure 3 MTT was reduced byRalstoniasolanacearum

图4 甲臜的溶解效率Figure 4 The dissolution efficiency of formazan

表1三联液用量Table 1 Dosage of triple solution

表2 三联液溶解甲臜晶体的时间Table 2 Dissolving formazan time of triple solution
注:不同小写字母表示不同时间处理之间差异显著(P<0.05)
2.7 平板计数法验证MTT法检测结果
MTT法检测活菌时,活菌浓度与吸光度值成正比。表3显示,体积相同(300 μL)时MTT法测定的青枯菌活菌数与吸光度值(A)成正比,线性关系良好(R2=0.9893),平板计数法印证了这一结果。结果表明MTT法可以用于青枯菌的活菌检测。

表3 平板计数法与MTT法检测结果比较Table 3 Comparison of the method of plate counting and MTT method
3 讨论
本研究是一种快速测定细菌MTT还原活性的改进方法,MTT被几种细胞脱氢酶催化成甲臜晶体,多数脱氢酶位于呼吸链[9-11]。因此,细菌的MTT还原反应不仅与细菌生长期有关,还与溶氧水平或培养基组成有关[12]。换句话说,细菌MTT还原反应通常被认为是一种综合的细胞电子传递效率指标。我们的结果说明MTT在20 min内被NA液体培养基里面的青枯菌反应,形成不溶于水的甲臜晶体沉淀在菌体内,MTT实验控制在30 min内完成,结果更可靠。
通常,MTT测定细菌活力实验可以分成2个阶段,即MTT还原反应阶段和甲臜晶体在有机溶剂中的溶解阶段。许多对MTT实验的干扰研究集中在还原反应阶段,极少关注溶解阶段[13-14]。有研究报道,细菌的液体培养基对MTT还原反应的干扰非常有限[8],本研究还发现生成甲臜晶体后离心与否不影响实验结果,故本实验在MTT反应生成甲臜后不需要离心,直接加入三联液溶解甲臜即可。为了去除菌体本身的干扰,本实验用酶标仪测定吸光度值之前需进行离心去除菌体。用MTT代替WST-5、WST-8和XTT更好,因为后者导致更高的背景吸收[15]。
本实验以溶解性较强的三联液取代传统的DMSO(二甲基亚砜,有皮肤毒性)溶解甲臜,可以不必在生成甲臜后离心去除培养液,还可以去除其中的细菌蛋白等成分以避免沉淀造成干扰。同时在生成甲臜后,不需要剧烈震荡以助溶(DMSO溶解甲臜需要剧烈震荡)。该方法既简化了操作,又提高了可靠性。

