TLR4、MyD88和NF-κB在大肠癌中的表达及意义
孙振玉 陈学军
(锦州医科大学病理教研室,辽宁 锦州 121000)
大肠癌是全世界最常见的恶性肿瘤之一,其发病率居全球第三位,每年有超过一亿人被诊断为结直肠癌,有超过600 000例患者死于该病〔1〕。在我国居恶性肿瘤死因的第五位。最近研究发现致炎因子Toll样受体(TLR)4和其介导的髓样合化因子(MyD)88依赖性通路及其下游的一重要因子核因子(NF)-κB,在大肠癌的发生发展中起重要作用。激活TLR4-MyD88-NF-κB信号通路可启动固有性免疫和获得性免疫反应,并在肿瘤的形成过程中扮演重要角色。TLR4、MyD88、NF-κB与肺癌、肝癌、卵巢癌等的发病关系密切〔2,3〕,但是三者同时在大肠癌中的检测却鲜有报道。本文作者通过检测TLR4、MyD88、NF-κB在大肠癌组织、腺瘤组织和相应癌旁正常组织中的表达情况,进一步探讨其临床意义。
1 资料与方法
1.1一般资料 随机选取2015年3月至2016年9月锦州医科大学附属第一医院病例完整的70例大肠癌手术存档蜡块,所有患者经术后病理学确诊为大肠癌,术前均未接受化疗和放疗。其中男38例,女32例;年龄41~88(平均63.5)岁;其中高、中分化49例,低分化及未分化21例;70例病例中有28例发生淋巴结转移;根据TNM分期,Ⅰ、Ⅱ期42例,Ⅲ、Ⅳ期28例。同时选取经病理学证实的36例大肠腺瘤和癌远端5 cm正常组织20例。
1.2方法 采用免疫组化PV-6000法,切片经脱蜡水化后,微波炉抗原修复15 min,磷酸盐缓冲液(PBS)洗3遍,过氧化氢(H2O2)室温封闭15 min,PBS洗3遍,滴加稀释的一抗:TLR4 1∶100,MyD88 1∶150,NF-κB 1∶300,4℃过夜。取出PBS洗3遍,滴加二抗,37℃孵育35 min,PBS洗3遍,二氨基甲联苯胺(DAB)显色2~5 min。苏木素染色、脱水、透明、封片。用已知的阳性切片作阳性对照,以PBS代替一抗作阴性对照。
1.3统计学方法 采用SPSS17.0软件进行χ2检验。
2 结 果
2.1TLR4、MyD88和NF-κB在大肠癌组织、腺瘤、癌旁正常组织中的表达 在70例大肠癌组织中,TLR4、MyD88、NF-κB的表达阳性率均显著高于腺瘤组织、正常黏膜组织(χ2=34.503,60.457,60.457,均P<0.001)。见表1。TLR4阳性表达于细胞膜和(或)细胞质中,在癌旁组织和腺瘤中表达较少或不表达;MyD88免疫定位于细胞质中,在癌旁组织和腺瘤中表达较少或不表达;NF-κB表达于细胞质和(或)细胞核中,在癌旁正常大肠黏膜组织和腺瘤中表达较少或不表达。见图1。
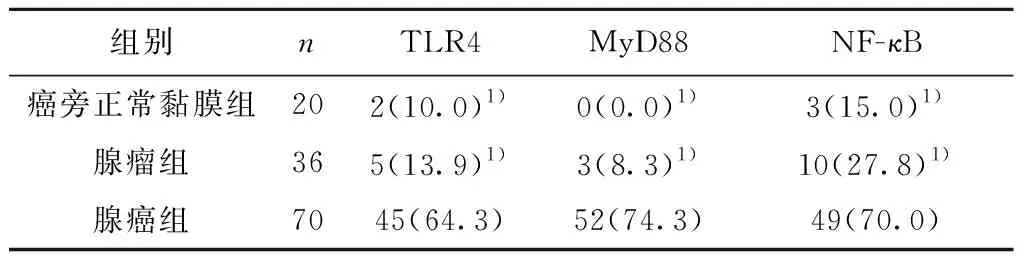
表1 TLR4、MyD88、NF-κB在大肠癌旁正常黏膜、腺瘤、腺癌中的表达阳性率比较〔n(%)〕
与腺癌组比较:1)P<0.001
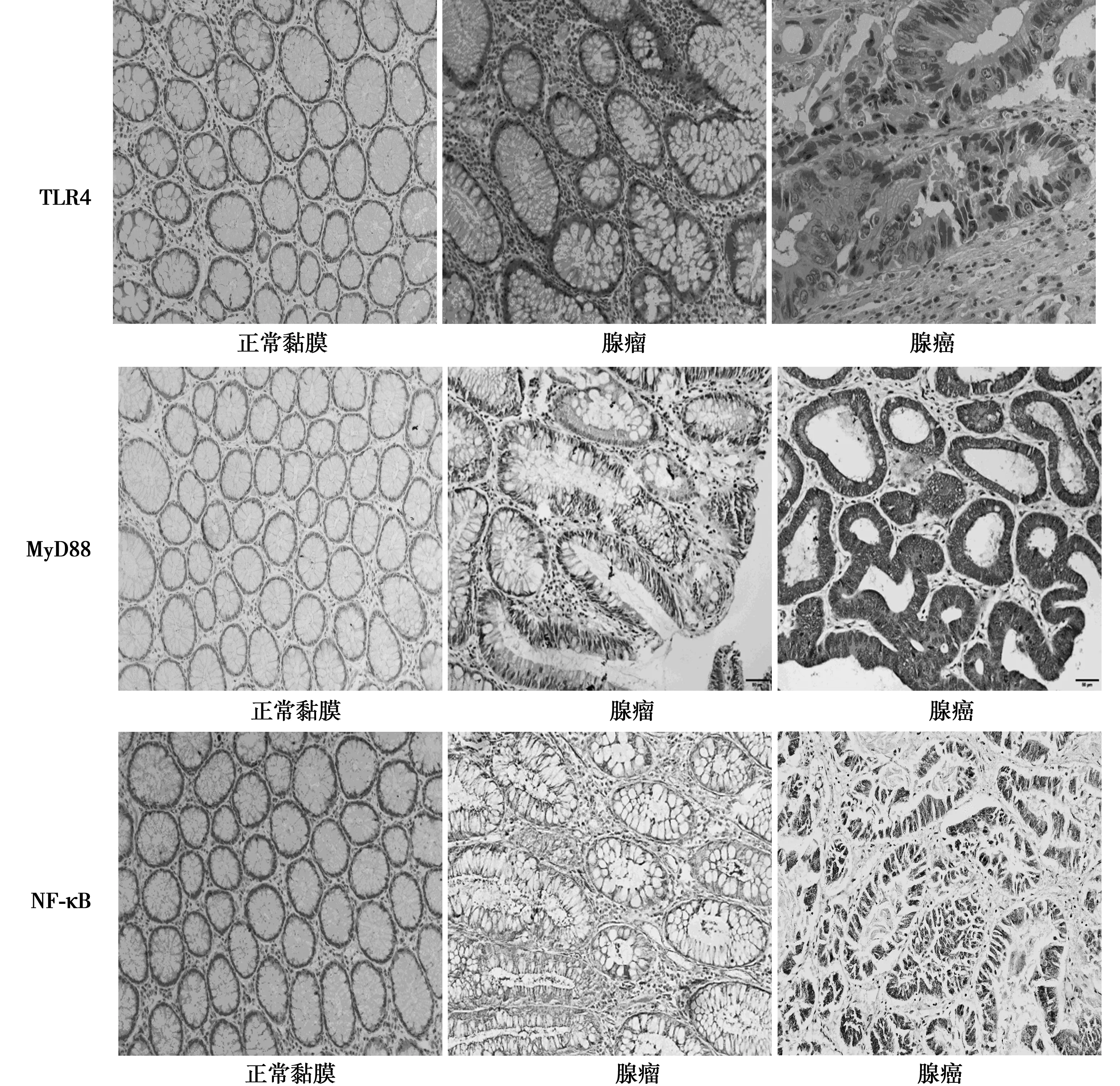
图1 TLR4、MyD88和NF-κB在不同大肠黏膜组织中的阳性表达(DAB,×200)
2.2TLR4、MyD88和NF-κB在不同临床特征大肠癌组织的阳性表达 TLR4、MyD88和NF-κB的阳性表达与大肠癌患者的性别、年龄、肿瘤部位无关(P>0.05);与肿瘤细胞的分化程度、淋巴结转移及TNM分期有关(P<0.05)。见表2。

表2 TLR4、MyD88和NF-κB在不同临床特征大肠癌组织中的阳性表达(n)
2.3大肠癌中TLR4及MyD88、 NF-κB蛋白阳性表达的相关性 TLR4与 MyD88在大肠癌组织中的阳性表达呈正相关(r=0.474,P<0.05),TLR4与NF-κB在大肠癌组织中的阳性表达呈正相关(r=0.435,P<0.05)。
3 讨 论
近年来,TLR4、MyD88及NF-κB在大肠癌中的作用备受关注,成为研究的热点。TLR4是第一个被发现的人类Toll样受体,是Toll样受体家族的成员之一。1997年Medzhitov等〔4〕首次在人身上发现与果蝇同源的Toll样蛋白及其受体,命名为TLR,现称为TLR4。人类TLR4是Ⅰ型跨膜蛋白识别受体,可分为胞膜外区,胞质区和跨膜区三部分。TLR4在组织中分布比较广泛,可见于淋巴细胞、单核细胞、中性粒细胞、脾细胞、树突状细胞、小肠上皮细胞、人子宫平滑肌细胞、呼吸上皮细胞〔5〕。TLR4在被活化后,可激活两条信号通路:MyD88依赖性途径和MyD88非依赖性途径。其中MyD88依赖性途径又经一系列活化,最终激活MAPKs家族(Jun信号通路及p38信号通路)和NF-κB信号通路,其中NF-κB信号通路,细胞静息状态下在胞质中与抑制蛋白IκB以无活性三聚体形式存在,当细胞受到外界刺激后IκB发生磷酸化并降解,NF-κB被释放进入细胞核启动相关基因的转录,并刺激炎症因子如白细胞介素(IL)-1、IL-6、IL-8、肿瘤坏死因子(TNF)-α的释放,引发炎症反应刺激免疫应答,同时释放的炎症因子如IL-1、TNF-α等又可以作为激活物激活NF-κB,由此形成反馈机制周而复始〔6〕。研究显示脂多糖(LPS)与TLR4结合可以使缺氧诱导因子(HIF)-1α和血管内皮生长因子(VEGF)的表达上调,继而促进肿瘤的生长、侵袭和转移〔7〕。TLR4的激活可以增加前列腺素E2、环氧化物酶(COX)-2的表达,增强表皮生长因子受体(EGFR)信号,促进炎症相关性癌的发生发展〔8〕。在APCMin/+的自发性肠癌的鼠模型提示〔9〕,MyD88信号通路可促进肿瘤的生长及进展,对鼠进行皮下肿瘤注射沉默肿瘤细胞中的TLR4/ MyD88信号,不仅可以减少肿瘤生成而且可以延长其生存期。研究显示在大肠癌中持久性表达的TLR4可以特异性地激活NF-κB,尤其是在肿瘤起源细胞,NF-κB通过炎症和组织修复机制延续信号,来维持肿瘤的生长及进展〔10〕。
本研究结果显示TLR4、MyD88及NF-κB在大肠癌中的阳性表达率均比正常组织及腺瘤组织高;且三者之间关系密切,进一步表明其在大肠癌中的相互促进作用。Wang等〔11〕检测发现TLR4、MyD88在大肠癌(CRC)的表达高于正常黏膜和癌旁组织,高表达的TLR4、MyD88有利于肿瘤细胞的免疫逃逸,促进肿瘤细胞增殖、浸润转移,与肿瘤生长、侵袭及肝转移有密切关系。高表达的TLR4、MyD88及TLR4/MyD88提示患者5年无病生存期(DFS)和总生存期(OS)均低,提示患者生存期短且预后不良。还发现TLR4/MyD88在肝转移的大肠癌患者中高表达。TLR4、MyD88的高表达促进肿瘤的生长、增殖,其致癌作用不仅体现在炎症相关性大肠癌,在散发性大肠癌中也扮演重要角色。NF-κB的激活与大肠癌发生转移扩散相关。Huang等〔12〕通过组织取样、大肠癌SW260细胞系及裸鼠异种移植模型来检测TLR4/NF-κB的表达,研究发现上调NF-κB p65的表达,在SW260细胞系中发现增加了炎性因子IL-6、IL-8的分泌,血清中IL-6、IL-8的水平增高与大肠癌的进展关系密切。本研究结果与先前的研究结果基本一致。在本研究中TLR4、MyD88和NF-κB在大肠癌中的表达均与性别、年龄、肿瘤部位无关,而与大肠癌的分化程度、TNM分期、淋巴结转移密切相关,提示三者在大肠癌的生长发展、侵袭浸润中发挥重要作用。TLR4、MyD88和NF-κB是肿瘤的早期事件,慢性感染与炎症是肿瘤形成的重要因素,研究表明大约有15%的大肠患者是由炎性肠病进展而来的,而三者通过参与免疫反应而加强并扩大了炎症效应,使其在向肿瘤发展方向更加推进一步〔13〕。但由于TLR4-MyD88-NF-κB在组织中表达广泛,涉及信号通路繁多复杂,作用正反同存,其具体在组织中与其他因子的协同作用仍需进一步探究,三者在肿瘤标志物方面的潜力需进一步证实,相关抑制剂、治疗药物仍需进一步试验。

