miR-27a-3p通过Wnt3a/β-catenin信号通路抑制肺成纤维细胞I、III型胶原合成
刘理静,钱 红,胡 柯,张自珍,贺兼斌
(1. 湖南医药学院医学院,湖南 怀化 418000;2. 湖南环境生物职业技术学院医学院,湖南 衡阳 421001;3. 怀化市第一人民医院呼吸内科,湖南 怀化 418000)
肺纤维化是一种慢性、进行性、致死性的肺间质疾病,目前尚缺乏特效治疗方法。I型胶原(collagen type Ⅰ,Col Ⅰ)和Ⅲ型胶原(collagen type Ⅲ,Col Ⅲ)是细胞外基质的主要成分,在肺组织中由肺成纤维细胞合成与分泌,受到JAK/STAT3、TGF-β1/ADAMTS-1、PI3K/Akt等信号通路的调控,其过度蓄积是肺纤维化的特征性病理改变[1-2]。Wnt3a/β-catenin信号通路是一条经典的致纤维化途径,激活后可促进细胞外基质合成[3-4]。microRNAs(miRNAs)是一类长度为19~25个核苷酸的内源性非编码RNA,通过与靶mRNA的3′-非翻译区(3′-untranslated region, 3′-UTR)结合,导致其翻译过程受到抑制或引起mRNA的降解,在转录后水平负性调控基因表达。大量研究表明,miRNAs 失调与肺纤维化的发生、发展密切相关[5-6]。miR-27a-3p是miR-27家族的一个重要成员,属于基因间miRNA。Cui等[7]报道,miR-27a-3p通过抑制肺成纤维细胞向肌成纤维细胞分化,减轻小鼠肺纤维化,表明 miR-27a-3p是一种抗肺纤维化因子。然而,miR-27a-3p是否通过Wnt3a/β-catenin途径调控细胞外基质代谢,尚不清楚。为此,本研究以人胚肺成纤维细胞MRC-5为研究对象,观察miR-27a-3p模拟物/抑制物转染对Col I、Col III、Wnt3a、β-catenin表达的影响,从新的角度阐明miR-27a-3p抗肺纤维化作用。
1 材料与方法
1.1试剂miR-27a-3p模拟物/抑制物及相应的阴性对照物,由广州锐博公司合成;新生胎牛血清和RPMI 1640培养基,购于Gibco公司;LipofectamineTM2000转染试剂、TRIzol试剂,美国Invitrogen公司;Dickkopf相关蛋白1(Dickkopf-related protein 1, Dkk1),购自美国Sigma公司;SYBR Green Real Time PCR Master Mix,日本 Toyobo公司;逆转录试剂盒、pGL3载体,美国Promega公司产品;双荧光素酶报告基因检测试剂盒、RIPA细胞裂解液、细胞质/核蛋白提取试剂盒,上海碧云天生物技术有限公司;兔抗人Col Ⅰ、Col Ⅲ、Wnt3a、β-catenin、β-actin单克隆抗体,购自美国Santa Cruz公司。
1.2细胞培养MRC-5细胞和HEK293T细胞,购于中国科学院上海细胞库。MRC-5细胞复苏后,接种于含10%新生胎牛血清的RPMI 1640培养基中,并置入37 ℃、5% CO2培养箱培养,待细胞生长至融合状态后,以0.25%的胰蛋白酶消化,并进行传代培养。当培养细胞达到一定数量,且呈现对数生长时用于相关实验。
1.3细胞转染与处理取上述MRC-5细胞接种于24孔板中,每孔细胞数约为1×106,加入0.18 mL RPMI 1640培养液,并继续孵育24 h,当细胞融合度达到85%时进行转染实验,分为对照组、模拟物对照组、miR-27a-3p模拟物组、抑制物对照组和miR-27a-3p抑制物组。按照LipofectamineTM2000的操作说明,分别给予培养液或者40 nmol·L-1的模拟物阴性对照物、miR-27a-3p模拟物、抑制物阴性对照物、miR-27a-3p抑制物转染细胞48 h。为了探讨Wnt3a/β-catenin信号通路在miR-27a-3p调控Col Ⅰ和Col Ⅲ表达中的作用,先以10 μmol·L-1Dkk1处理MRC-5细胞6 h,再用40 nmol·L-1的miR-27a-3p抑制物转染48 h。待处理完毕后,检测相关指标。
1.4生物信息学预测和双荧光素酶报告基因分析利用Targetscan(http://www.targetscan.org/)和miRDB(http://mirdb.org/miRDB/),预测miR-27a-3p与Wnt3a 3′-UTR的靶向结合情况。在此基础上,利用PCR从MRC-5细胞基因组DNA中扩增Wnt3a的3′-UTR序列,插入荧光素酶报告载体pGL3,同时构建其突变载体,使用LipofectamineTM2000将上述质粒(1 μg)与40 nmol·L-1的miR-27a-3p模拟物或模拟物阴性对照物共转染HEK293T细胞48 h,双荧光素酶报告基因检测试剂盒测定各组细胞荧光素酶活性。
1.5实时荧光定量PCR(quantitativereal-timePCR,qPCR) 采用TRIzol试剂提取MRC-5细胞中的总RNA,并逆转录成cDNA。qPCR所使用的引物由上海生工生物工程公司合成,其中miR-27a-3p引物序列:上游5′-TGCGGTTCACAGTGGCTAAG-3′,下游5′-CTCAACTGGTGTCGTGGA-3′;U6引物序列:上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′;Col I引物序列:上游5′-CTCTTGCTGCTGCTCCCTAC-3′,下游5′-CCACCCCAGGGATAAAAACTGC-3′;Col Ⅲ引物序列:上游5′-GAATGGTGGCTTTCAGTTCAGC-3′,下游5′-GCTGTTTTTGCAGTGGTATGTAATG-3′;Wnt3a引物序列:上游5′-CAGTGCCTCGGAGATGGTG-3′,下游5′-GGTTAGGTTCGCAGAAGTTGG-3′;GAPDH引物序列:上游5′-TGGGTGTGACCATGAGAAGT-3′,下游5′-TGAGTCCTTCCACGATACCAA-3′。在Roche480荧光实时定量PCR仪上进行PCR反应,反应条件:95 ℃预变性10 min,95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸2 min,总共35个循环。用ΔΔCt值法定量目的基因miR-27a-3p、Col Ⅰ、Col Ⅲ和Wnt3a表达水平。
1.6Westernblot细胞处理完毕后,RIPA细胞裂解液处理MRC-5细胞,并用细胞质/核蛋白提取试剂盒提取蛋白,BCA法定量,然后上样、电泳,转至PVDF膜,分别加入兔抗人Col Ⅰ(1 ∶500)、Col Ⅲ(1 ∶500)、Wnt3a(1 ∶500)、β-catenin(1 ∶500)、β-actin(1 ∶2 500)一抗,4 ℃孵育过夜,TBS洗涤后,加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶2 500)二抗,37 ℃孵育1 h,化学发光法显色,暗室曝光。通过Labwork凝胶图像分析系统扫描所有胶片,计算目的蛋白相对表达量。

2 结果
2.1miR-27a-3p转染效率检测为了鉴定miR-27a-3p模拟物/抑制物的转染效率,分别以40 nmol·L-1miR-27a-3p模拟物/抑制物及其阴性对照物转染MRC-5细胞48 h,qPCR检测miR-27a-3p表达。如Fig 1所示,miR-27a-3p过表达明显增加miR-27a-3p水平(P<0.01),miR-27a-3p抑制则明显降低miR-27a-3p水平(P<0.01),而阴性对照物对其表达无影响(P>0.05),提示miR-27a-3p模拟物/抑制物转染MRC-5细胞具有较高的效率。
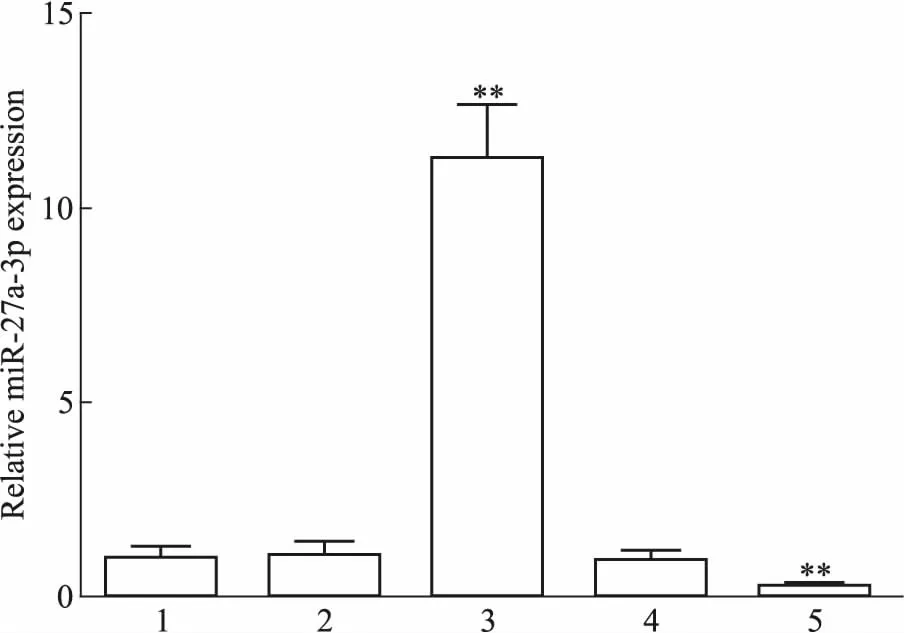
Fig 1 Expression of miR-27a-3p in
1: Control group; 2: Mimic control group; 3: miR-27a-3p mimic group; 4: Inhibitor control group; 5: miR-27a-3p inhibitor group.**P<0.01vscontrol group.
2.2miR-27a-3p抑制MRC-5细胞ColⅠ、ColⅢ表达给予miR-27a-3p模拟物/抑制物转染MRC-5细胞48 h,qPCR、Western blot检测Col Ⅰ、Col Ⅲ mRNA与蛋白表达。相对于对照组,miR-27a-3p模拟物明显减少Col Ⅰ、Col Ⅲ mRNA与蛋白表达(P<0.01),而其抑制物则增加Col Ⅰ、Col Ⅲ mRNA与蛋白表达(P<0.01),见Fig 2。
1:Control group;2:Mimic control group; 3: miR-27a-3p mimic group; 4: Inhibitor control group; 5: miR-27a-3p inhibitor group.**P<0.01vscontrol group.
2.3鉴定Wnt3a为miR-27a-3p的靶基因生物信息学预测发现,Wnt3a 3′-UTR存在1个miR-27a-3p的结合位点(Fig 3)。Fig 4的荧光素酶报告基因显示,miR-27a-3p模拟物减少野生型Wnt3a 3′-UTR荧光素酶活性(P<0.01),但不影响突变型荧光素酶活性(P>0.05)。这些结果表明,Wnt3a为miR-27a-3p的靶基因。
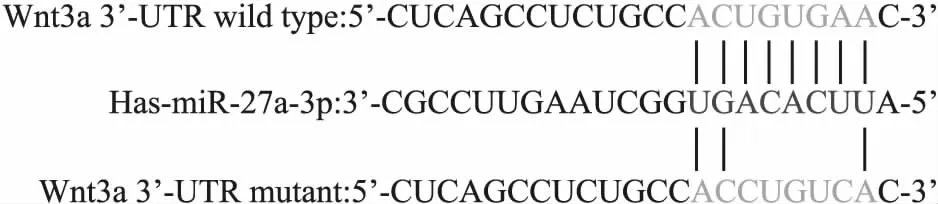
Fig 3 Binding site for miR-27a-3p in Wnt3a 3′-UTR and its mutant

Fig 4 Comparison of luciferase activity among
1:Control group;2:Wnt3a 3′-UTR wild type group;3:Wnt3a 3′-UTR mutant group.**P<0.01vsmimic control.
2.4miR-27a-3p下调MRC-5细胞Wnt3a表达以miR-27a-3p模拟物/抑制物转染MRC-5细胞,处理48 h后,用qPCR和Western blot检测Wnt3a表达。如Fig 5所示,miR-27a-3p过表达明显降低Wnt3a蛋白水平(P<0.01),miR-27a-3p抑制则增加Wnt3a蛋白水平(P<0.01),但对其mRNA表达无影响(P>0.05)。提示miR-27a-3p在翻译水平抑制Wnt3a表达。
2.5miR-27a-3p降低MRC-5细胞核内β-catenin表达β-catenin是Wnt3a的关键下游分子,在激活状态下,β-catenin在细胞质内大量聚集,并进入细胞核,从而促进靶基因转录。接下来,检测miR-27a-3p对胞核β-catenin表达的影响。Fig 6的Western blot结果显示,miR-27a-3p模拟物转染MRC-5细胞48 h明显下调β-catenin表达,其抑制物表现出相反的作用,与对照组比较,差异均有显著性(P<0.01)。提示miR-27a-3p阻滞β-catenin激活。

Fig 5 Effects of miR-27a-3p on Wnt3a mRNA(A) and protein(B) expression in MRC-5
1:Control group; 2: Mimic control group; 3: miR-27a-3p mimic group; 4: Inhibitor control group; 5: miR-27a-3p inhibitor group.**P<0.01vscontrol group.
2.6miR-27a-3p通过拮抗Wnt3a/β-catenin信号通路减少ColⅠ、ColⅢ生物合成为了阐明miR-27a-3p降低Col I、Col III产生的分子机制,以Wnt3a/β-catenin信号通路抑制剂Dkk1预处理MRC-5细胞6 h,再用miR-27a-3p抑制物转染细胞48 h。如Fig 7所示,相对于对照组,miR-27a-3p抑制物组Col Ⅰ、Col Ⅲ表达水平明显增加(P<0.01),Dkk1预处理后,加入miR-27a-3p抑制物,Col Ⅰ、Col Ⅲ表达水平较miR-27a-3p 抑制物组降低(P<0.05),表明miR-27a-3p对Col Ⅰ、Col Ⅲ合成的抑制作用通过Wnt3a/β-catenin途径介导。
3 讨论
在正常的肺组织中,细胞外基质的合成代谢与分解代谢处于动态平衡之中,从而维持肺组织的正常结构与呼吸功能。在致纤维化因素的作用下,肺成纤维细胞大量生成细胞外基质,特别是Col Ⅰ和Col Ⅲ,使其合成代谢超过分解代谢,并在肺组织中不断沉积,这是肺纤维化形成过程中最重要的病理改变。miR-27a-3p是一种多效性的miRNA,调控血管生成、能量代谢及细胞增殖、迁移、分化等生物学过程,与肿瘤的发生、发展密切相关[8-9]。近年研究发现,miR-27a-3p也能抑制肺纤维化进展[7],但机制未明。本研究中,miR-27a-3p过表达明显降低MRC-5细胞Col Ⅰ和Col Ⅲ水平,其抑制则上调Col Ⅰ和Col Ⅲ表达,表明miR-27a-3p负性调控细胞外基质合成,这揭示了一个新的miR-27a-3p抗肺纤维化机制。
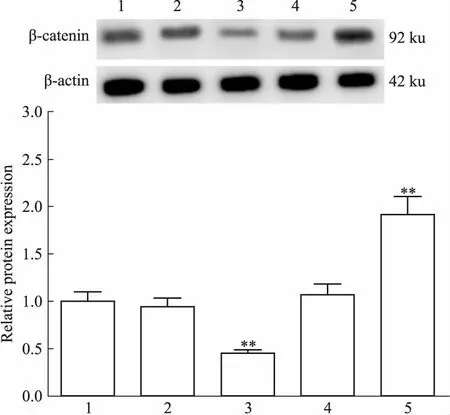
Fig 6 Effects of miR-27a-3p on nuclear β-catenin expression in MRC-5
1:Control group; 2: Mimic control group; 3: miR-27a-3p mimic group; 4: Inhibitor control group; 5: miR-27a-3p inhibitor group.**P<0.01vscontrol group.
Wnt信号通路包括3条,其中Wnt3a/β-catenin途径主要调控基因转录。在激活状态下,Wnt3a抑制β-catenin的泛素化降解,使细胞质中β-catenin含量增加,并移位至细胞核,与转录因子T细胞因子/淋巴增强因子结合,进而诱导Col Ⅰ、Col Ⅲ等靶基因表达[10-11]。在特发性肺纤维化患者的肺泡上皮中,Wnt3a、β-catenin表达明显增加[12-13]。转化生长因子β1通过抑制miR-29表达,激活Wnt3a/β-catenin信号通路,促进肺成纤维细胞合成Col Ⅰ[3]。另一方面,使用Wnt3a/β-catenin信号通路的抑制剂Dkk1能明显改善小鼠肺纤维化程度[14]。因此,Wnt3a/β-catenin 信号通路在肺纤维化发生、发展中起着重要作用,寻找调控这条途径的潜在机制对于肺纤维化的防治具有重要价值。

Fig 7 Effects of Dkk1 combined with miR-27a-3p inhibitor on Col Ⅰ and Col Ⅲ mRNA(A) and protein(B) expression in MRC-5
1:Control group; 2: miR-27a-3p inhibitor group; 3: Dkk1 group; 4: Dkk1+miR-27a-3p inhibitor group.**P<0.01vscontrol group;#P<0.05vsmiR-27a-3p inhibitor group.
miRNAs必须与其靶mRNA 3′-UTR结合才能发挥生物学功能。已有研究表明,miR-27a-3p通过靶向沉默Wnt3a,抑制β-catenin核转位,从而减少小鼠皮肤黑色素生成[15]。与此相似,本研究通过生物信息学在线网站,发现Wnt3a 3′-UTR存在miR-27a-3p的结合位点,而且miR-27a-3p模拟物减少野生型Wnt3a 3′-UTR荧光素酶活性,但对其突变型无影响,进一步证实Wnt3a为miR-27a-3p的靶基因。同时,miR-27a-3p模拟物转染MRC-5细胞后,Wnt3a、β-catenin表达水平明显降低,其抑制物的作用则相反,表明miR-27a-3p为Wnt3a/β-catenin信号通路的负性调控子。Kim等[16]用siRNA干扰β-catenin表达,发现Wnt3a/β-catenin信号通路失活,抑制细胞外基质合成,进而缓解博莱霉素诱导的小鼠肺纤维化。为了揭示miR-27a-3p调控MRC-5细胞Col Ⅰ、Col Ⅲ表达的分子机制,以Dkk1和/或miR-27a-3p抑制物处理MRC-5细胞,Dkk1预处理废除miR-27a-3p抑制物对Col Ⅰ、Col Ⅲ表达的影响,提示Wnt3a/β-catenin信号通路介导miR-27a-3p对MRC-5细胞Col Ⅰ、Col Ⅲ合成的抑制作用。
综上所述,miR-27a-3p通过靶向沉默Wnt3a,抑制β-catenin核转位,从而下调肺成纤维细胞Col Ⅰ、Col Ⅲ表达,这从细胞外基质代谢角度揭示了新的miR-27a-3p抗肺纤维化机制。外源性给予miR-27a-3p模拟物或刺激其内源性生成可能成为肺纤维化防治的新策略。
(致谢:本实验在侗医药研究湖南省重点实验室和湖南环境生物职业技术学院医学院实验中心完成,感谢各位老师的指导和帮助。)

