颅内血管周细胞瘤与脑膜瘤的MRI表现及鉴别分析
李成博 王 春 范国光
颅内血管周细胞瘤 (hemanyiopericytoma,HPC)也称血管外皮细胞瘤,是一种较罕见的颅内血管源性恶性肿瘤,该病影像表现复杂且缺乏特异性,极易与颅内脑膜瘤相混淆,两者鉴别主要依靠术中及术后的病理检测,但是HPC内部血供丰富,术中易出血且具有一定侵袭性,因此在早期对HPC与脑膜瘤等其他肿瘤进行鉴别具有重要意义。本文对HPC和脑膜瘤病人的影像资料进行回顾并对照分析,以期探寻和评估2组间的影像表现差异,为HPC的诊断提供帮助。
1 资料与方法
1.1 一般资料 收集2015年—2017年在中国医科大学附属第一医院行术前MRI平扫及增强扫描检查并经术后病理确诊的46例病人影像资料,其中HPC病人6例(男4例,女2例),术前均被误诊为脑膜瘤。 病人年龄 26~75 岁,平均(46.33±16.88)岁;临床表现头痛3例,肢体麻木1例,间断性鼻出血1例,突发抽搐1例。另外40例为脑膜瘤病人,其中1例病人术前诊为“颅内恶性肿瘤可能性大”。病人年龄 27~78 岁,平均(56.12±12.19)岁,其中男 4例,女36例;临床表现持续性头痛头晕18例,肢体麻木6例,2人无症状偶然发现,突发抽搐5例。
1.2 检查方法 采用GESigna HDxt 3.0 TMR扫描设备,8通道头部线圈,扫描范围自颅顶至颅底枕骨大 孔 下 。 扫 描 参 数 :T1WI:TR 1 900 ms,TE 9 ms;T2WI:TR 5 000 ms,TE 96 ms。FOV 220 mm×220 mm,矩阵256×256,层厚6 mm,层间距1.5 mm。经肘静脉团注对比剂Gd-DTPA,用量0.1 mmol/kg体质量。
1.3 影像分析 首先由2位影像医师(至少2年诊断经验)对肿瘤大小、形态,瘤体内部血管流空信号、出血、囊变及坏死情况,T1WI及T2WI上的信号强度,增强扫描的强化程度,脑膜尾征,肿瘤附着硬脑膜状态等进行评判,再由1位高级职称的影像医师进行审核。
1.4 统计学分析 采用SPSS22.0软件进行统计学分析。计数资料以例(%)表示,2组资料间比较采用非参数检验的四格表χ2检验,以P<0.05为差异有统计学意义。
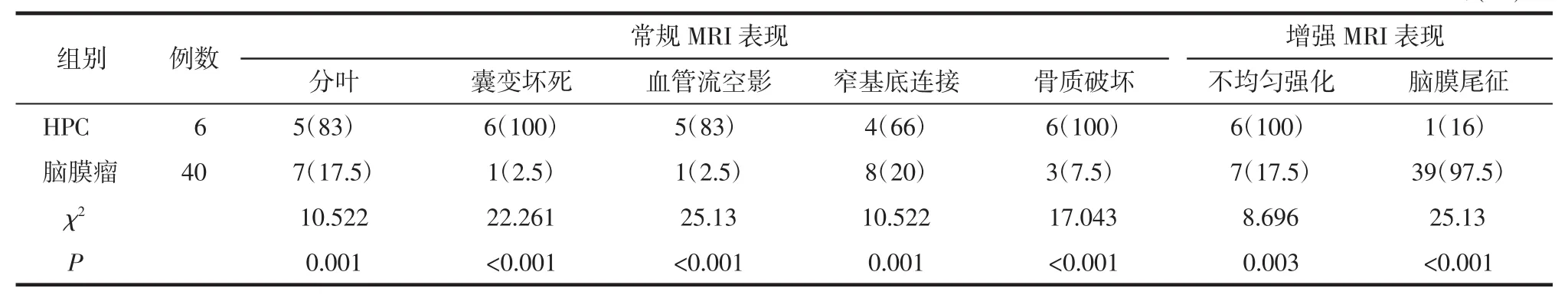
表1 HPC与脑膜瘤MRI表现分析 例(%)
2 结果
HPC与脑膜瘤病人MRI表现相似,均可见肿瘤呈不规则或分叶状,瘤体以窄基底附着于硬脑膜;瘤体内部可见血管流空影,且有不同程度囊变及坏死;肿瘤周围骨质均出现不同程度骨质破坏;增强MRI上肿瘤均可呈明显不均匀强化(图1-4)。HPC组上述影像表现的发生率高于脑膜瘤组,差异均有统计学意义(P<0.05),详见表1。 另外,2组在增强MRI上均可见脑膜尾征,但脑膜瘤上的出现率高于HPC,差异有统计学意义(P<0.05)。
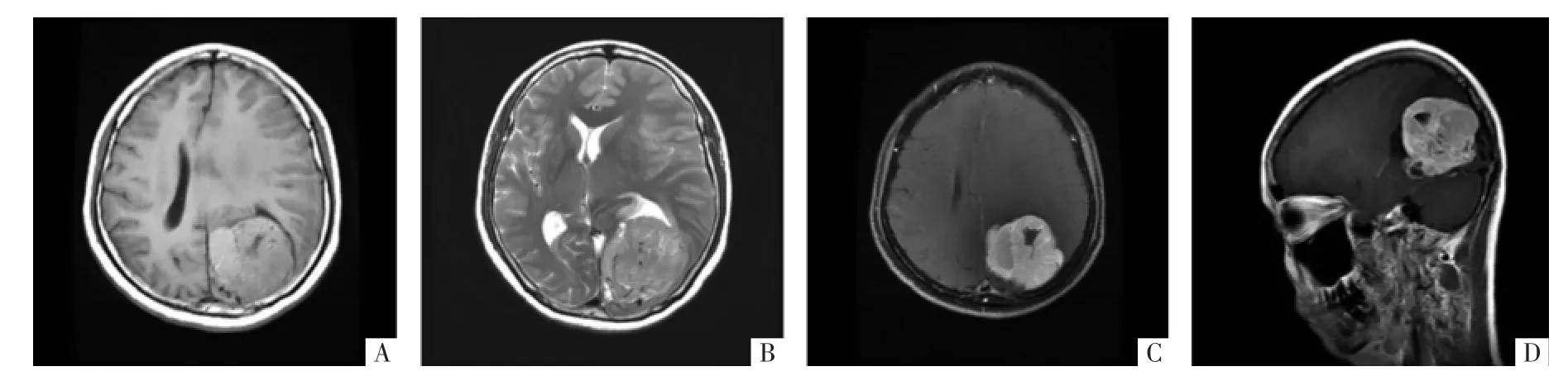
图1 HPC病人MRI影像。A图为T1WI,瘤体呈浅分叶状,内可见坏死。B图为T2WI,瘤体内见血管流空影。C图为增强MRI横断面影像,可见瘤体内囊变,呈明显不均匀强化,未见脑膜尾征。D图为增强MRI矢状面影像,可见瘤体内囊变,与硬脑膜窄基底相连。
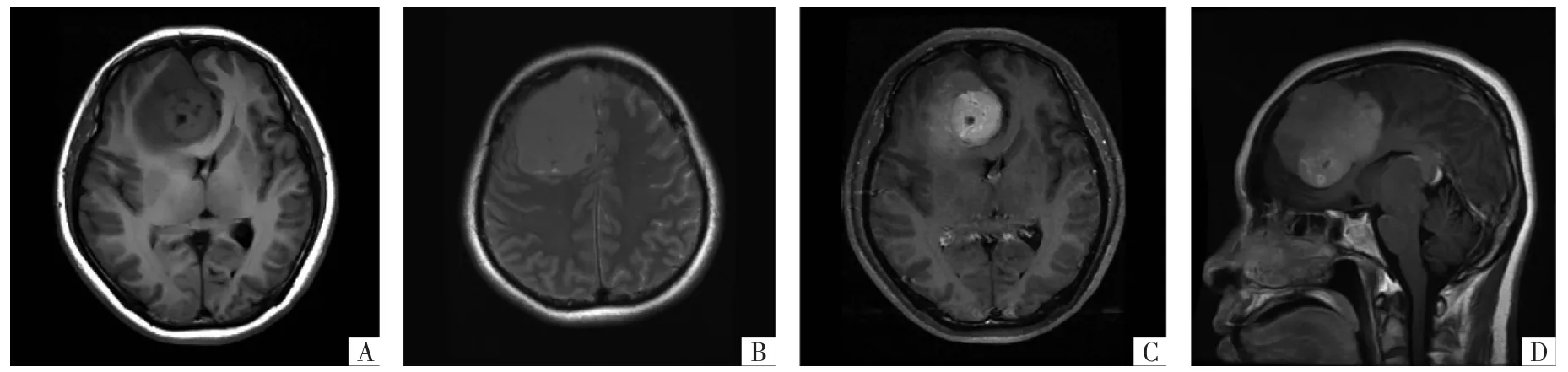
图2 HPC病人MRI影像。A图为T1WI,瘤体位于上矢状窦旁,呈分叶状,有囊变,信号不均匀。B图为T2WI,瘤体内可见血管流空影。C图为增强扫描,可见瘤体明显不均匀强化,未见脑膜尾征。D图为矢状面增强MRI,可见瘤体与硬脑膜窄基底相连。
3 讨论
血管周细胞瘤又称血管外皮细胞瘤,起源于毛细血管外壁Zimmerman细胞,好发年龄38~45岁[1],属颅内较罕见肿瘤,矢状窦、窦汇、大脑镰旁相对多见,具有一定侵袭性[2]。由于其好发部位、影像表现、病理检测及临床症状与脑膜瘤具有很高的相似性,因此曾一度将HPC划为脑膜瘤的一种亚型,直至2007年才将HPC从脑膜瘤中分出而重新归类为其他脑膜相关性肿瘤项目内。2016年,WHO再度对HPC进行划分,由于孤立性纤维性肿瘤和HPC都具有诸多基因方面的相似性,因此调整孤立性纤维性肿瘤和血管外皮细胞瘤为一类,采用新的分级体系,并创建一个全新的联合诊断术语,即孤立性纤维肿瘤/血管外皮瘤,但该术语较冗长,WHO可能会在下一版分类中对此进行简化[3-4]。HPC影像诊断缺乏特异性,在日常影像工作中极易与脑膜瘤相混淆,本研究中的6例HPC病人均误诊为脑膜瘤,但由于HPC瘤易发生远处转移且预后差、血运丰富、侵袭性强、难以全切,所以术前准备如不充分则易导致术中出血,甚至危及病人生命。另外,考虑到HPC具有很高的复发率,有超过60%的病人在肿瘤切除15年内再次复发[5],因此及早对HPC与其他肿瘤进行鉴别具有重要意义。
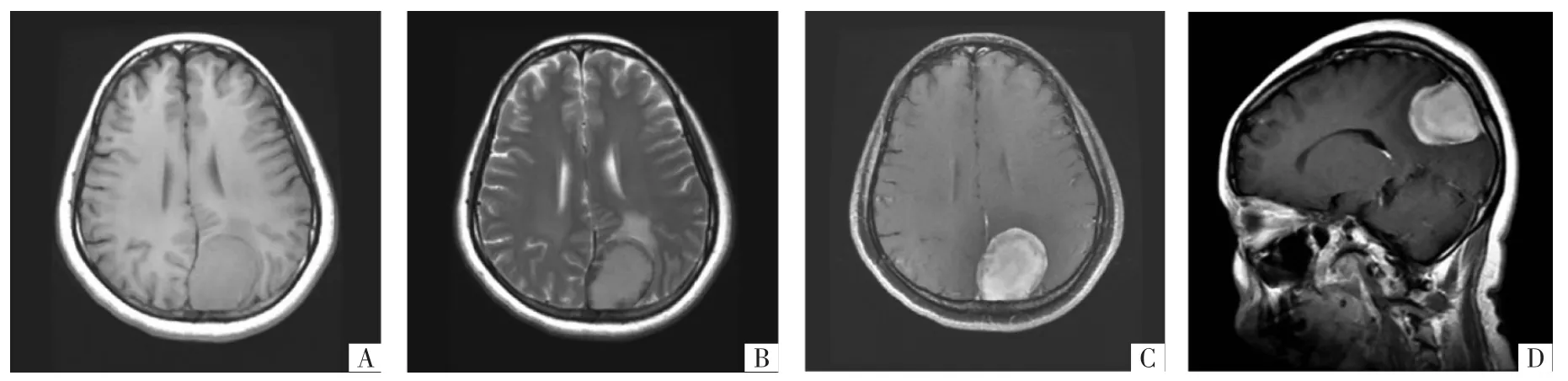
图3 脑膜瘤病人MRI影像。A图为T1WI,瘤体呈等信号,形态规则,未见囊变坏死。B图为T2WI,瘤体周围可见水肿带,瘤体内信号均匀,无血管流空影。C图为横断面增强MRI,瘤体明显均匀强化,无囊变坏死等。D图为矢状面增强MRI,瘤体与硬脑膜宽基底相连,可见脑膜尾征。

图4 脑膜瘤病人MRI影像。A图为T1WI,瘤体位于侧脑室三角区内,呈略低信号。B图为T2WI,瘤体呈等信号改变,瘤体周围无水肿带,瘤体内无血管流空影、囊变及坏死。C、D图为增强MRI,瘤体呈中度均匀强化,信号较均匀。
3.1 肿瘤形态 HPC由于生长速度快,侵袭性高,因此瘤体形态多不规则或呈深分叶状(图1);而脑膜瘤病人瘤体生长较缓慢,瘤体形态因此多呈圆形或椭圆形[6](图4)。本研究中HPC组瘤体呈分叶状较脑膜瘤组的更多见(83%∶17.5%,P<0.05)。
3.2 增强扫描及脑膜尾征 HPC由于生长速度快,因此瘤体内常因血供减少而出现囊变及坏死,增强扫描呈明显不均匀强化,并且缺血坏死也会导致瘤体周围出现明显水肿带,而脑膜瘤内囊变坏死则较少见。脑膜尾征是由于脑膜受肿瘤细胞浸润,MRI增强扫描时呈显著强化。脑膜瘤是起源于脑膜及脑膜间隙的衍生物且病程较长,硬脑膜长期受侵,因此更易出现脑膜尾征(图3)。本研究中脑膜瘤组出现脑膜尾征的概率远高于HPC组也证明了该观点(97.5%∶16%,P<0.05)。
3.3 血管流空影 本研究中HPC组血管流空影较脑膜瘤组更常见(83%∶2.5%,P<0.05),与陈等[7]的研究结果一致。HPC与脑膜瘤均为富血供肿瘤,但HPC内部血管更丰富或者血管管径更粗,血流阻力更小,可能是HPC瘤体内血管流空影(图2)更常见的主要原因。
3.4 与硬脑膜附着形态 本研究中HPC组瘤体多以窄基底附着 (66%),而脑膜瘤组以宽基底附着(80%),该表现可能与两者起源不同有关。脑膜瘤起源于脑膜及脑膜间隙,与硬脑膜连接紧密;而HPC起源于血管周细胞,相对较少累及硬脑膜,故常以窄基底连接于硬脑膜上。上述表现可作为HPC与脑膜瘤重要鉴别点。
3.5 瘤周骨质破坏 本研究中HPC组的全部病人均出现不同程度骨质破坏(6/6,100%),而脑膜瘤组仅3例有轻度骨质破坏(3/40,7.5%)。HPC因具有一定侵袭性,因此容易发生骨质破坏;而脑膜瘤中少见骨质破坏,可能与其生长速度缓慢有关。
综上所述,HPC与脑膜瘤的影像表现虽然具有很高的相似性,极易在影像诊断过程中出现误诊,但其差异性也是显著的,如HPC瘤体内囊变坏死及血管流空影更常见,且增强扫描呈不均匀强化,常与硬脑膜呈窄基底连接,瘤周骨质破坏也更常见[8]。本研究结果与余等[9]的研究结果高度一致。因此,当影像诊断过程中发现类似脑膜瘤表现的肿瘤,同时具有以上一点或几点影像特征时,应考虑HPC的可能。以上影像学差异有助于HPC与脑膜瘤的鉴别诊断,希望能为临床手术方案的制定及评估病人预后提供帮助。另外,多种MRI序列的应用也为HPC与脑膜瘤的鉴别诊断提供了新的可能性,例如有研究[10-12]表明,HPC在DWI上的ADC值明显高于脑膜瘤的ADC值。相比于脑膜瘤病人,HPC病人MRS上也显示肌醇与谷胱甘肽具有更高的峰值[5],但不同研究的结果并不一致,因此需要进行进一步实验证明。
专家点评(范国光):颅内血管周细胞瘤与脑膜瘤具有极相似的影像表现,在日常诊断工作中通常难以进行精准鉴别,并且血管周细胞瘤属颅内罕见肿瘤,发病率低,因此即使在日常影像诊断工作中遇到影像表现与血管周细胞瘤相似的病例,也会因为首先考虑发病率等原因而倾向做出非典型脑膜瘤的判断。只有当医师具有较开阔的诊断思路才会想到血管周细胞瘤的可能性。本研究结果显示血管周细胞瘤与脑膜瘤在肿瘤形态、血管流空影等诸多方面均有明显差异,这为两者的鉴别诊断提供了一定的诊断思路,即当今后遇到类似脑膜瘤但出现以上多种影像表现时应当警觉是否有血管周细胞瘤的可能性。该研究有助于更多医师对颅内血管周细胞瘤的认识,在日后的工作中减少漏、误诊的出现。而关于两者明确、有效的鉴别诊断标准依然需要进一步探寻和研究。

