电子束辐照对李斯特菌生理特性的影响
石菲菲,王 丽,史依沫,3,张卫东,崔晓瑞,刘小飞,潘 妍,宋洪波,李淑荣,*
(1.福建农林大学 食品科学学院,福建 福州 350002;2.北京农业职业学院,北京 102442;3.沈阳农业大学 食品学院,辽宁 沈阳 110866;4.中国原子能科学研究院,北京 102413)
食品在加工和贮藏过程中易被致病菌污染,由食源性致病菌引起的食品安全事件在世界范围内频繁发生,成为近年来全球关注的热点问题[1]。李斯特菌作为一种常见且致病性较强的食源性致病菌受到了越来越多的关注[2]。目前国际上公认的李斯特菌属共有7个菌种,其中单核细胞增生性李斯特菌、绵羊李斯特菌和英诺克李斯特菌对人类有一定的致病性[3]。李斯特菌生存环境可塑性大,可在2~42 ℃下生存,并可在酸性或碱性条件下存活并生长繁殖。该菌在环境中无处不在,如土壤、污水、饲料、动物、人体及各种生食和即食食品中,包括生肉及熟肉制品、速冻米面食品、奶酪、蔬菜、沙拉和海产品等[4-5]。近年来,由李斯特菌引起的食品安全事件频繁发生,因此,如何快速有效地控制食品中李斯特菌的污染,防止其危害人体健康成为当前亟待解决的问题。
食品工业中,传统的杀菌方式是加热处理,它具有杀菌谱广、杀菌作用快等优点,但对于热敏性食品,可引起感官品质下降,以及营养和风味成分损失[6-7]。随着生活水平的提高,人们对食品的感官品质、营养品质、新鲜程度有更高的要求,热处理技术无法满足这样的要求,所以非热杀菌技术逐渐受到人们的重视。辐照杀菌是近年来发展起来的一项新型食品非热杀菌技术,因其能耗低、无污染、灭菌彻底、对营养成分影响小、能有效控制食源性疾病等优点得到了各国学者的关注[8-10],并在食品安全领域得到了很好的应用[11-12],是目前商业化最好的非热加工技术。关于辐照杀菌的研究目前为止主要集中在辐照工艺方面,有关辐照杀菌机制的研究却鲜有报道。
本文以英诺克李斯特菌1.2990为研究对象,以电子束为辐照源,研究不同辐照剂量对英诺克李斯特菌生理特性的影响,对细胞膜通透性、胞内离子泄漏量、Na+K+-ATP酶和Ca2+Mg2+-ATP酶活性、膜电位以及菌悬液pH值的变化进行研究,以揭示电子束辐照导致细菌死亡的原因,旨为电子束辐照在食品杀菌中的应用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
英诺克李斯特菌(Listeriainnocua1.2990),中国微生物菌种保藏管理委员会普通微生物中心(CGMCC);含0.6%酵母浸膏的胰酪胨大豆肉汤培养基(TSBYE)、含0.6%酵母浸膏的胰酪胨大豆琼脂培养基(TSAYE),北京陆桥技术有限责任公司;氯化钠(分析纯)、考马斯亮蓝G250、罗丹明123,北京索莱宝科技有限公司;超微量Na+K+-ATP酶测定试剂盒、超微量Ca2+Mg2+-ATP酶测定试剂盒、钠离子测定试剂盒、钾离子测定试剂盒、镁离子测定试剂盒、钙离子测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
F-380荧光分光光度计,天津市福元铭仪器有限公司;UV-2600紫外可见分光光度计,岛津仪器有限公司;YXQ-LS-50SII立式压力灭菌器,上海博讯实业有限公司医疗设备厂;SW-CJ-2F洁净工作台,苏净集团苏州安泰空气技术有限公司;LRH-150生化培养箱,上海一恒科技有限公司;THZ-C恒温振荡器,太仓市实验设备厂;DK-S28电热恒温水浴锅,上海精宏实验设备有限公司;FA2204B电子天平,上海舜宇恒平科学仪器有限公司;SCIENTZ-Ⅱ D超声波细胞粉碎机,宁波新芝生物科技股份有限公司;PHS-3C型pH计,上海精密科学仪器有限公司;R134A型高速冷冻离心机,德国Eppendorf公司。
1.3 方法
1) 菌悬液制备
对真空冷冻干燥的英诺克李斯特菌种进行复苏与活化,平板划线培养1 d后获得单菌落,挑取1个单菌落于10 mL TSBYE中,摇床培养24 h((36±1) ℃、200 r/min),以3%接种量接入100 mL的TSBYE液体培养基中,摇床培养12 h((36±1) ℃、200 r/min),再以3%接种量接入1 000 mL的TSBYE液体培养基中,摇床培养9 h((36±1) ℃、200 r/min),4 ℃下以8 000 r/min离心10 min,弃上清液,用0.85%无菌生理盐水重复离心洗涤菌体沉淀3次,调整菌悬液浓度至108~109CFU/mL,用10 mL离心管分装。4 ℃冰箱中保存备用。
2) 电子束辐照处理
电子束辐照在中国原子能科学研究院的电子加速器上进行。参数为:功率4 kW、能量10 MeV、扫描宽度50 cm、扫描速度1.5 m/min。设定剂量为0.00、0.75、1.50、2.25、3.00、3.75、5.00 kGy。辐照过程中用经中国计量科学研究院标定的重铬酸钾银剂量计进行剂量跟踪,实测剂量为0.00、0.81、1.62、2.23、3.12、3.88、5.14 kGy。
3) 活菌计数
各组菌悬液样品选择合适的稀释度用TSAYE采用稀释平板法,(36±1) ℃下培养48 h后计数。平板计数操作按照《食品微生物学检验 菌落总数测定》(GB 4789.2—2016)进行。
4) 细胞膜通透性测定
沸水浴(100 ℃下杀菌15 min)菌悬液作为阳性对照,将对照组、辐照组、阳性对照组的菌悬液在10 000 r/min、4 ℃条件下离心10 min,取上清液,用石英比色皿测定260 mm和280 nm处的吸光度。将阳性对照组的吸光度设置为100%,其他组的吸光度按比例进行换算。
5) 离子泄漏量测定
将对照组、辐照组的菌悬液在10 000 r/min、4 ℃条件下离心10 min,取上清液根据相关试剂盒说明书测定上清液中Na+、K+、Ca2+、Mg2+的浓度。
6) Na+K+-ATP酶和Ca2+Mg2+-ATP酶活性测定
将对照组、辐照组的菌悬液样品在8 000 r/min、4 ℃条件下离心10 min,弃上清液,沉淀用生理盐水重悬稀释为106~107CFU/mL,再对其进行超声破碎(条件为:工作5 s、间歇15 s、共进行10 min、功率400 W)。破碎后的样品参照相关试剂盒说明书测定酶活性,并采用考马斯亮蓝法测定蛋白质含量。酶活力单位定义为单位时间(h)单位质量(mg)组织蛋白中ATP酶分解ATP产生1 μmol无机磷的量。
7) 膜电位测定
将对照组、辐照组的菌悬液加入2 mL终浓度为10 μg/mL的罗丹明123中,37 ℃下避光孵育30 min,用磷酸盐缓冲液充分洗净重悬,用荧光分光光度计测定菌悬液的平均荧光强度,工作条件为:激发波长480 nm、发射波长530 nm、狭缝宽10 nm。
8) 菌悬液pH值测定
用pH计测定菌悬液的pH值。
1.4 统计分析
每个实验3次重复,利用SPSS 17.0统计软件,采用单因素方差分析进行显著性差异分析,P<0.05为有显著性差异。
2 结果与分析
2.1 电子束辐照对活菌数量的影响
不同辐照剂量下的活菌数N示于图1,lgN与辐照剂量的线性拟合方程为y=-1.459x+8.675 2,R2=0.985 1。由图1可见,lgN由对照组的8.9降至5.00 kGy时的1.4,各辐照组的活菌数与对照组相比,P<0.05,有显著性差异,说明电子束辐照对李斯特菌有明显的杀菌作用。
D10是指杀死90%微生物所需的辐照剂量,反映的是微生物对辐照的敏感性,其值越大表示微生物对辐照的耐受性越强,反之越敏感。由图1的线性方程可计算得电子束辐照对英诺克李斯特菌的D10为0.69 kGy,与Jeong等[13]的结果一致。Nam等[14]得出猪肉糜中单增李斯特菌的D10为0.58 kGy,这可能是由于所用试验菌种、杀菌介质以及初始菌浓度不同导致。
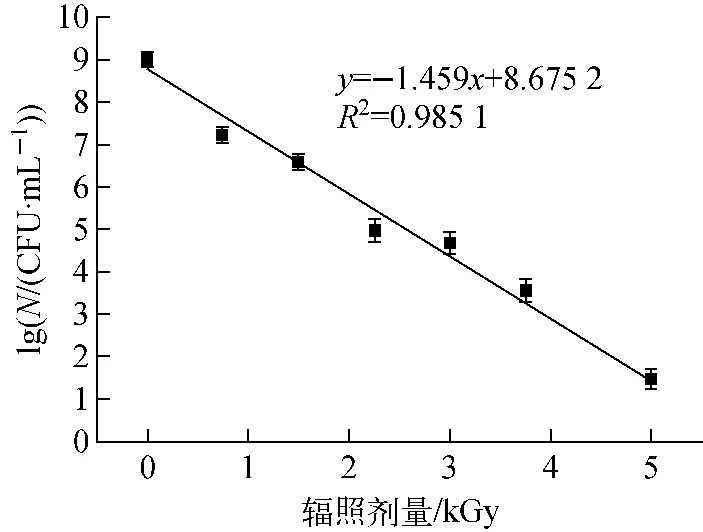
图1 不同辐照剂量下英诺克李斯特活菌数量Fig.1 Numbers of Listeria innocua under different irradiation dosages
2.2 电子束辐照对细胞膜通透性的影响
由于核酸中含有嘌呤、嘧啶碱基,蛋白质中含有酪氨酸和色氨酸残基的苯环,这些结构都具有共轭双键,所以在紫外光区具有强烈的光吸收,核酸和蛋白质的最大吸收峰分别在260 nm和280 nm附近[15-16]。故可通过测定上清液在260 nm和280 nm处的紫外吸光度来反映紫外吸收物质的泄漏量[17]。
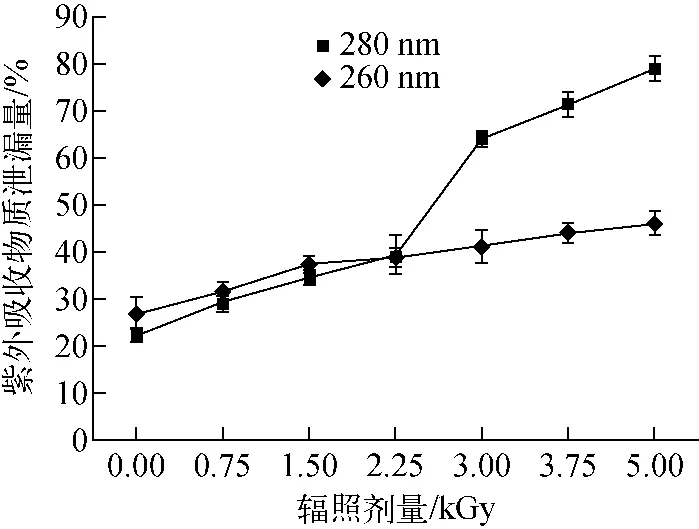
图2 不同辐照剂量下英诺克李斯特菌紫外吸收物质的泄漏量Fig.2 Leakage of intracellular UV-absorbing substance from Listeria innocua under different irradiation dosages
电子束辐照处理后,英诺克李斯特菌紫外吸收物质的泄漏量示于图2。沸水浴15 min处理可严重破坏细菌细胞膜的完整性,使细胞膜变为全透性,因此将对阳性对照组紫外吸收物质的泄漏量设置为100%。由图2可知,紫外吸收物质的泄漏量随辐照剂量的增加而逐渐增加。可见,随着剂量的增加更多的核酸和蛋白质泄漏到细胞外,说明辐照使细胞膜完整性遭到破坏,通透性增大,失去细胞生长繁殖所需的蛋白质和遗传物质,进而导致细菌死亡,这与Fiester等[18]的研究结果相似。样品经5.00 kGy辐照处理后,核酸类物质及蛋白质的泄漏量分别为46%和79%,杀菌率已达99%以上,但泄漏程度与阳性对照组相比均存在显著差异,P<0.05,说明电子束辐照对英诺克李斯特菌细胞膜通透性的影响并未达到热处理的程度,这可能是由于辐照与热处理对细菌细胞膜的作用途径及机理不同。
2.3 电子束辐照对离子泄漏量的影响
不同剂量下细胞中离子的泄漏量列于表1。由表1可知,除3.75 kGy剂量外,辐照组其他剂量下的菌体胞外Na+离子含量与对照组相比均无显著性差异,P>0.05,表明并非剂量越高菌体胞外Na+离子浓度越高,这可能是由于钠钾转运体的存在,细菌本身就生长在膜外高钠的环境中。随着辐照剂量的增加,K+、Ca2+、Mg2+离子外泄增多。各辐照组胞外K+、Ca2+的浓度除0.75 kGy外均显著高于对照组,P<0.05,K+离子从对照组的(0.589±0.031) mmol/L升至5.00 kGy时的(2.219±0.024) mmol/L,胞外浓度上升了73%;Ca2+离子从对照组的(0.147±0.021) mmol/L升至5.00 kGy时的(0.543±0.019) mmol/L,胞外浓度也上升了73%;各辐照组胞外Mg2+的浓度均显著高于对照组,从对照组的(0.014±0.005) mmol/L升至5.00 kGy辐照组的(0.193±0.015) mmol/L,胞外浓度上升了93%,与其他离子浓度的变化趋势相比,胞外Mg2+的浓度受辐照影响的变化趋势更明显。K+、Mg2+离子是维持细胞内渗透压平衡的重要无机盐离子[19],Ca2+是胞内的一种重要信使,调节着细胞增殖、代谢等细胞过程[20],胞内离子大量泄漏,离子稳态遭到破坏,最终导致菌体代谢紊乱,加速死亡。
2.4 电子束辐照对Na+K+-ATP酶、Ca2+ Mg2+-ATP酶活性的影响
在细胞受到胁迫时,原核生物细胞膜上的ATP酶活性会发生变化[21]。Na+K+-ATP酶、Ca2+Mg2+-ATP酶是镶嵌在细胞膜脂质双分子层中的一种蛋白质,是重要的载体,在维持细胞容积恒定、细胞内外渗透压平衡等方面发挥着重要作用,还可为蛋白质的合成提供必要的离子浓度,能催化ATP为细胞供能,为某些物质的运输提供驱动力[22]。电子束辐照对Na+K+-ATP酶、Ca2+Mg2+-ATP酶活性的影响列于表2。由表2可知,随着电子束辐照剂量的增加,英诺克李斯特菌Na+K+-ATP酶、Ca2+Mg2+-ATP酶活性呈降低的趋势,0.75 kGy时,Na+K+-ATP酶、Ca2+Mg2+-ATP酶的活性均低于对照组,但影响不显著,P>0.05。1.50~5.00 kGy时Na+K+-ATP酶、Ca2+Mg2+-ATP酶的活性均显著低于对照组,P<0.05,且Ca2+Mg2+-ATP酶活性的变化趋势较Na+K+-ATP酶的更明显,这可能是由于Ca2+Mg2+-ATP酶对辐照较为敏感造成的。Na+K+-ATP酶、Ca2+Mg2+-ATP酶不同程度的失活,使细菌胞内物质运送、能量转换、信息传递等正常生理代谢紊乱,导致细菌死亡。Mézešová等[23]和Matsuda等[24]均发现经过射线处理,细胞中Na+K+-ATP酶的活性显著降低,造成阳离子的主动运输减少、阳离子泵受到损害。
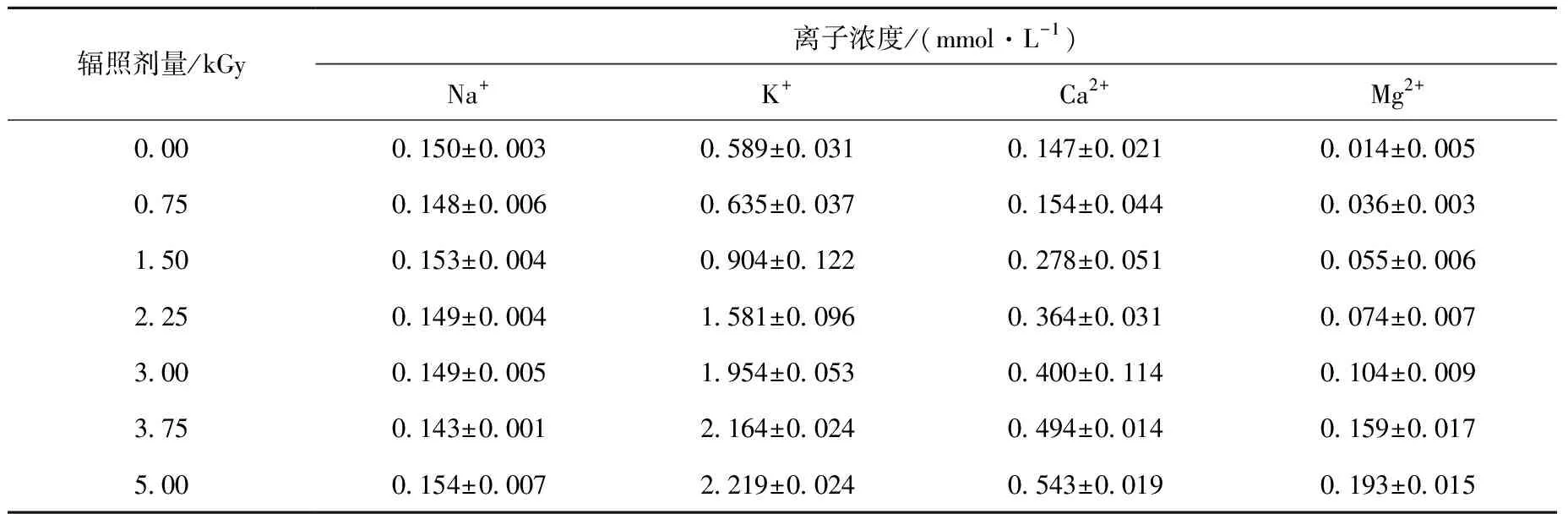
表1 不同辐照剂量下英诺克李斯特菌离子的泄漏量Table 1 Leakage of intracellular ion from Listeria innocua under different irradiation dosages
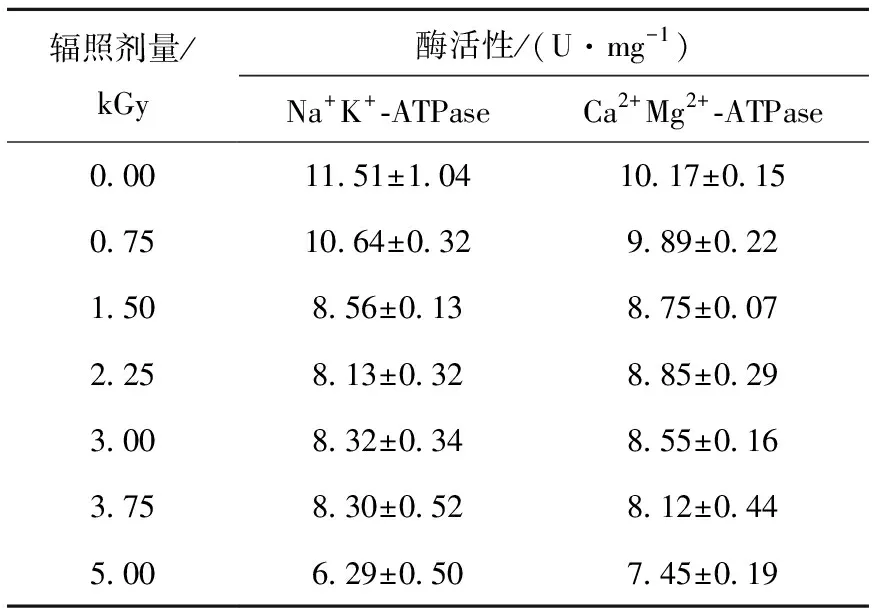
表2 不同辐照剂量下英诺克李斯特菌细胞膜ATPase的活性Table 2 Cell membrane ATPase activity of Listeria innocua under different irradiation dosages
2.5 电子束辐照对膜电位的影响
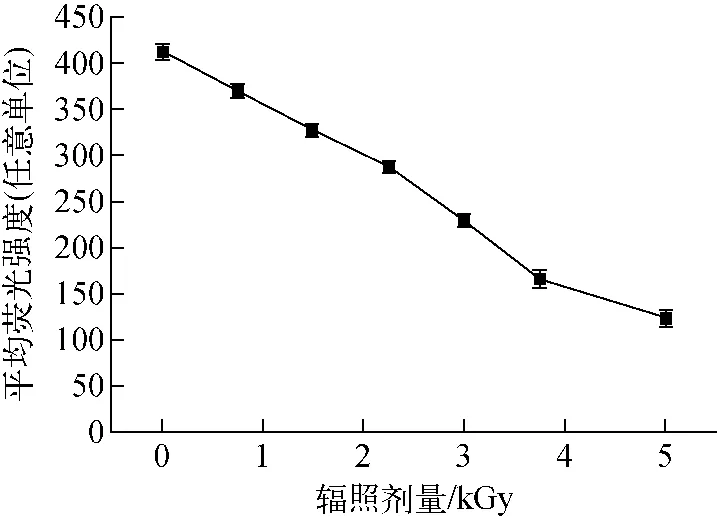
图3 不同辐照剂量下英诺克李斯特菌的膜电位Fig.3 Membrane potential of Listeria innocua under different irradiation dosages
膜电位是细胞膜内外两边的电位差[25-26],具有完整细胞结构及代谢旺盛的细菌,细胞膜内外存在一定的电位差[27]。如果膜电位降低说明细胞发生了去极化,反之,说明细胞发生了超极化[28]。荧光强度大小可反映膜电位的变化,电子束辐照对英诺克李斯特菌膜电位的影响示于图3。由图3可知,对照组菌悬液的平均荧光强度为413.375±4.830,随着辐照剂量的增加,膜电位迅速下降,0.75 kGy的电子束辐照使菌悬液的平均荧光强度下降10%,与对照组相比存在显著性差异,P<0.05,经过5.00 kGy的电子束辐照,菌悬液的平均荧光强度下降70%,膜电位下降的趋势与胞内离子的泄漏量趋势相一致。
2.6 电子束辐照对菌悬液pH值的影响
pH值变化一直被认为是微生物致死的一个重要因素[29],菌悬液pH值降低会造成微生物新陈代谢的酶失活,进而导致微生物死亡。不同剂量下英诺克李斯特菌菌悬液的pH值示于图4。从图4可看出,经过5.00 kGy的电子束辐照处理后,菌悬液pH值从6.24±0.17下降到5.43±0.04。说明电子束辐照显著降低了菌悬液的pH值,这与顾春晖等[30]的研究结果一致。这主要是由于辐照过程发生了H2O→e-aq(2.6)+H·(0.55)+OH·(2.7)+H2(0.45)+H2O2(0.71)+H3O+(2.6) 反应,该反应产生了大量的H3O+[31],这一方面会引起菌悬液pH值的下降,另一方面OH·、H·、e-aq会与胞内大分子物质发生交联,致使大分子物质变性,如会导致DNA单链和双链片段的形成,引起DNA构象的整体变化[32]。
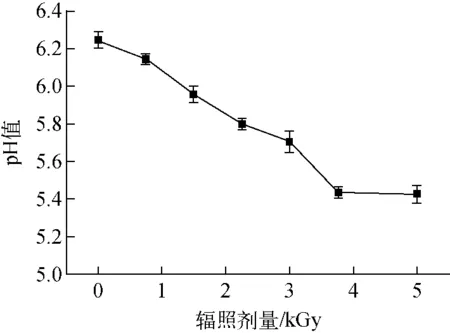
图4 不同辐照剂量下英诺克李斯特菌菌悬液的pH值Fig.4 pH of Listeria innocua suspension under different irradiation dosages
3 结论
1) 电子束辐照可有效杀灭英诺克李斯特菌,剂量越高,杀菌效果越好,其D10为0.69 kGy。
2) 电子束辐照使英诺克李斯特菌细胞膜通透性增大,导致紫外吸收物质大量泄漏,胞内离子泄漏结果也表明一定剂量辐照后英诺克李斯特菌细胞膜完整性被破坏,且离子稳态被瓦解。
3) 电子束辐照后,英诺克李斯特菌Na+K+-ATP酶、Ca2+Mg2+-ATP酶活性降低,膜电位及菌悬液pH值也发生了一定程度的改变,表明辐照后李斯特菌胞内物质运送、能量转换等正常生理代谢发生紊乱。
综上可知,电子束辐照对英诺克李斯特菌生理特性有着显著的影响,这可能是导致其死亡的重要原因,有关死亡机理的研究还有待于进一步深入。

