黄芩苷诱导小鼠结肠癌发生坏死性凋亡作用的体外研究*
杨爱霞,吴彪,何伟,胡必成,黄鹤归,徐蕾,张力凡
(武汉市第一医院1.药学部;2.胃肠外科;3.实验中心,武汉 430022)
结直肠癌是全球发病率最高的三大常见癌症之一[1],发病率呈现逐年上升的趋势[2]。目前的治疗方法主要有手术切除、辅助化疗和放射治疗(放疗)等[3]。研究者们发现一些药物能够通过诱导肿瘤细胞发生坏死性凋亡达到广谱抗肿瘤作用。坏死性凋亡(necroptosis)是区别于坏死和凋亡的一种新的死亡方式,是非Caspase依赖的程序性死亡,在肿瘤和心血管、神经退行性疾病[4-5]的发生发展中有着重要意义。黄芩苷具有明显的抗肿瘤作用,可以通过多途径来产生抗肿瘤作用[6-7],包括抗癌、抗炎、抗氧化和神经保护等[8-11]。黄芩苷是从中药黄芩中提取的一种黄酮类化合物[12],具有明显的抗癌作用。笔者通过体外实验观察黄芩苷诱导结肠癌细胞发生坏死性凋亡,为黄芩苷临床抗肿瘤应用提供实验依据。报道如下。
1 材料与方法
1.1仪器 流式细胞仪(德国Leica公司,型号:FACSVantage SE);激光共聚焦荧光显微镜(德国Leica公司,型号:TCS SP5);倒置显微镜(日本 OLYMPUS公司,型号:IX71)、照像系统(日本 OLYMPUS公司);QPCR设备(Funglyn Biotech公司,型号:FTC2000);Western blotting设备(BIO-RAD公司) ;二氧化碳(CO2)培养箱(日本三洋公司);多功能酶标仪(美国 Thermo Fisher公司);细胞培养瓶及细胞培养板购于美国Costar公司;PHILIPS TECNAI-10透射电子显微镜(荷兰飞利浦公司)。
1.2试剂 黄芩苷购自中国食品药品检定研究院,批号:110715,含量:93.3%,使用二甲亚砜(DMSO)配制成浓度为100 μmol·L-1的溶液。RPMI 1640 培养基和胎牛血清购自美国Gibco公司,胰蛋白酶、青霉素-链霉素溶液(上海碧云天生物技术有限公司);磷酸盐缓冲液(PBS,北京中杉公司); DMSO(美国Amresco公司);CCK-8试剂盒(货号:96992)购于美国Sigma公司;碘化丙啶(PI,货号:ST511)、DAPI(货号:C1006) 染色液、抗荧光淬灭剂均购于上海碧云天生物技术有限公司;一抗:RIP3(兔来源)(货号:ab62344)、内参一抗β-actin(兔来源)购于美国Abcam公司;二抗:羊抗兔购于美国IgGAbcam公司。 z-VAD-fmk(Caspases抑制剂,货号:187389-52-2)。
1.3细胞株 小鼠结肠癌细胞CT26.WT细胞系,购于中国科学院上海细胞库。
1.4细胞培养及分组 将细胞培养于含10%优质胎牛血清和1%青霉素-链霉素双抗的RPMI 1640培养基中,2~3 d换液1次,细胞80% 融合度时传代,可按照1∶3传代比例进行,于37 ℃,5% CO2及饱和湿度培养箱中培养。细胞分组:①正常对照组,加入新鲜培养基,常规培养;②黄芩苷组,加入100 μmol·L-1黄芩苷;③ z-VAD-fmk组,加入20 μmol·L-1z-VAD-fmk抑制剂;④联合用药组,加入终浓度为 20 μmol·L-1z-VAD-fmk1 h后加入100 μmol·L-1黄芩苷,继续培养72 h后收集样本作为药物模型(100 μmol·L-1黄芩苷)进行后续检测。
1.5CCK8法检测CT26.WT细胞存活率 收集生长状态良好的CT26.WT细胞,计数调整细胞浓度至1×105·mL-1,每组细胞设复孔3个,将96孔板移入培养箱中培养,孵育过夜,使细胞完全贴壁。将96孔板移入培养箱中培养(37 ℃,5%CO2),培养适当时间(24,48,72 h)。每孔加入CCK-8溶液10 μL,于培养箱内孵育4 h。用多功能酶标仪测定在450 nm处吸光度值。z-VAD-fmk预处理>1 h,将黄芩苷与抑制剂联合使用,加入96孔板中再进行检测。
细胞活力(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%,细胞抑制率(%)=1-细胞活力。
1.6PI单染流式细胞术(FCM)检测细胞死亡率 将处于对数生长期的CT26.WT细胞用6孔板培养,待细胞生长达到60%~70%,吸出旧培养基,按上述分组加药分别再继续培养8,16,24,32 h后,把细胞培养液吸出至合适离心管内,PBS洗涤贴壁细胞一次,加入适量胰酶细胞消化液消化细胞。室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,吸除胰酶细胞消化液。需避免胰酶过度消化,加入之前收集的细胞培养液,混匀,转移到离心管内,1000×g离心5 min,弃去上清液,收集细胞,用PBS轻轻重悬细胞并计数。加入PI染色液10 μL,轻轻混匀,冰浴避光放置。随即进行流式细胞仪检测。
1.7用DAPI染色检测CT26.WT细胞核的变化 细胞经过洗涤,在培养板中将已制备完成的细胞爬片用1×PBS浸洗3次,每次3 min;固定:用4%多聚甲醛(PBS配制)常温固定细胞爬片15 min。洗涤:1×PBS浸洗细胞爬片3次,每次3 min,吸水纸吸干残留较多的PBS。染核:滴加DAPI避光孵育5 min,对标本进行染核,1×PBS浸洗爬3次,每次3 min,洗去多余DAPI。用吸水纸吸干爬片上的残留PBS,用含抗荧光淬灭剂封片;然后在激光扫描聚焦显微镜下观察采集图像。
1.8透射电镜观察CT26.WT细胞死亡形式 将固定好的组织样本做透射电子显微镜观察组织细胞内的细胞器形态变化。透射电子显微镜由华中科技大学电子显微镜室提供技术支持。对CT26.WT细胞进行扩大培养,待细胞生长增殖良好,并有8个10 cm2瓶皿70%细胞量时,对细胞分组,分别进行以上加药处理72 h。收集:将细胞用胰酶消化,调整浓度为(1~5)×105·mL-1,转移到EP管中,3000 r·min-1(有效离心半径10 cm)离心3 min,弃去上清液。依次用4 ℃,2.5%戊二醛2 h,1%四氯化锇25~30 min进行固定,用PBS洗2遍,每次10 min,将固定的细胞团块移入灭菌的青霉素小瓶中。再依次用50%,70%丙酮溶液各1次,90%丙酮2次,100%丙酮3次,每次12 min,进行脱水。弃去残余脱水剂,室温下依次加入丙酮-EPON812包埋剂3~4 mL,维持30 min、纯包埋剂1~2 mL,反应2 h,进行完全包埋。在60 ℃烤箱下烘烤24 h,混合包埋剂包埋的样品直至固化为包埋硬块。用超薄切片机将标记好包埋硬块切为厚度约1 μm的半薄切片。经干燥、染色、再次切片、形成薄膜、再染色,用醋酸双氧铀染色液及铅染色液于室温下各染色10,12 min,冲洗并用滤纸吸干后用透射电子显微镜仔细观察样品细胞的超微结构。
1.9QPCR法检测细胞RIP3 mRNA的变化 将分组细胞匀浆:对于贴壁生长的细胞,可将培养基弃除后,直接将总RNA提取剂TRIzol试剂加到培养板中。每10 cm2加入TRIzol试剂1 mL,用微量加样吸头反复吹打匀浆,直至细胞全部溶化。将上述匀浆液室温放置5 min,待核酸和蛋白充分解离。每毫升TRIzol 试剂用量的匀浆液中加入三氯甲烷0.2 mL,盖紧管盖,手动剧烈震摇15 s,然后室温静置2~3 min。4 ℃,10 000 r·min-1(有效离心半径10 cm)离心10 min。将上清液弃除,每管加入75%乙醇1 mL润洗,盖紧管盖,轻轻晃动试管,以去除残留的异丙醇和盐份。4 ℃ 7 500 r·min-1(有效离心半径10 cm)离心5 min。将上清液弃除,打开管盖,将RNA 沉淀干燥(室温挥发或真空干燥)。将RNA 沉淀溶解于适量(20~50 μL)的无RNase水中。QPCR法检测各组RIP3mRNA表达水平。CT值表示每个反应管内的荧光信号到达设定的域值时所经历的循环数。△Ct=目的基因Ct-内参基因Ct,相对表达量=2(-△Ct),相对比值=目的基因相对拷贝数/内参基因相对拷贝数。
1.10Western blotting 法检测CT26.WT细胞坏死性凋亡相互作用蛋白RIP3蛋白表达 总蛋白提取:细胞裂解贴壁细胞,弃掉培养基,用PBS洗1次。悬浮细胞,收集细胞离心,PBS洗1次。通常每106个细胞加细胞组织快速裂解液RIPA缓冲液0.1 mL。裂解液和细胞充分接触冰上放置,用枪头轻轻吹打,使细胞充分裂解。再轻轻倾斜培养皿,然后将其转移到1.5 mL离心管,剧烈振荡30 s。4 ℃,12 000 r·min-1(有效离心半径10 cm),离心15 min,吸取上清液,电泳。电压80 V跑过浓缩胶后转换至120 V,待溴酚蓝跑至胶板底部刚好没有跑出即可。将夹子打开使黑的一面保持水平,在上面依次垫海绵垫、滤纸、胶、PVDF膜(经甲醇活化)、滤纸、海绵垫;同时将电泳液换成转移液。将电流调整到恒流200 mA,转移1~3 h。取出膜,并做好正反面标记,在TBST中清洗1 min,然后用5%脱脂牛奶封闭液室温封闭2 h。用封闭液将对应一抗稀释成一定的浓度(1:500),内参一抗的稀释终浓度为1:1000,然后温育1.5 h或4 ℃孵育过夜。用TBST洗3次,每次5 min。用封闭液将二抗稀释成一定的浓度(1:1000),然后温育1.5 h。用TBST清洗4次,每次5 min。曝光。将电致化学发光(electrochemilu-cminesence,ECL)曝光液按A液:B液1:1混匀后均匀覆盖在整片膜上,反应2 min,放入曝光仪曝光检测。

2 结果
2.1黄芩苷对小鼠结肠癌细胞CT26.WT的增殖抑制作用 随着黄芩苷浓度的增加和作用时间的延长,CT26.WT细胞的存活率明显降低(图1)。黄芩苷浓度为100 μmol·L-1时,24,48,72 h细胞存活率分别为(93.58±1.25)%,(78.55±6.31)%和(44.60±4.89)% 。实验中将100 μmol·L-1作为后续实验中所用的浓度。在Caspase抑制剂处理 >1 h后,加用黄芩苷100 μmol·L-1处理72 h细胞的存活率,与正常对照组比较,黄芩苷组和联合用药组差异有统计学意义(P<0.05),见图2。



2.2CT26.WT细胞的死亡率 PI染色结果显示:黄芩苷处理不同时间后各组细胞死亡情况,正常对照组细胞死亡率为(10.54±0.19)%;与对照组比较,黄芩苷组死亡率为(34.93±0.16)%,明显上升;与黄芩苷组比较,联合用药组死亡率为(23.27±1.20)%,明显降低(P<0.01),即Caspase抑制剂降低黄芩苷的作用,抑制剂处理过的细胞死亡比例明显下降。z-VAD-fmk组细胞死亡率为(11.23±0.59)%,与联合用药组比较差异有统计学意义(P<0.01)。
2.3CT26.WT细胞核的改变 细胞进行DAPI染色后,用荧光显微镜观察结果显示,DAPI染色呈蓝白色荧光。正常对照组与z-VAD-fmk组细胞核呈浅蓝色,均匀淡染;与正常对照组比较,黄芩苷组核浓染,出现碎裂现象;与黄芩苷组比较,联合用药组核浓染,有更加明显核碎裂现象。激光扫描共聚焦显微镜下观察CT26.WT细胞图像见图3。

A.正常对照组;B.黄芩苷组;C.z-VAD-fmk组;D.联合用药组;与正常对照组比较,*1P<0.01;与z-VAD-fmk组比较,*2P<0.01

A.normal control group;B.baicalin group;C.z-VAD-fmk group;D.baicalin+z-VAD-fmk group;Compared with normal control group,*1P<0.01; Compared with z-VAD-fmk group,*2P<0.01
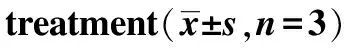
2.4CT26.WT细胞超微结构的变化 用透射电子显微镜观察结果表明,与正常对照组比较,黄芩苷作用后细胞的超微结构明显改变,细胞破裂。线粒体肿胀、细胞内容物外泄;与黄芩苷组比较,联合用药组细胞略显皱缩,染色质边聚,线粒体肿胀程度减弱。透射电镜观察CT26.WT细胞药物处理后超微结构改变见图4。
2.5细胞RIP3 mRNA的表达 荧光定量PCR检测结果显示,与对照组比较,单独使用黄芩苷与联合抑制剂处理细胞均能显著上调其mRNA表达(P<0.01),说明黄芩苷可以上调细胞的RIP3 mRNA的表达;而抑制剂可以减弱RIP3的基因表达作用(P<0.01)。黄芩苷与联合使用Caspase抑制剂z-VAD-fmk对RIP3 mRNA表达的改变见图5。
2.6CT26.WT细胞RIP3蛋白表达量 Western blotting结果显示,与正常对照组比较,黄芩苷可以明显激活RIP3蛋白的表达;联合用药也可以激活RIP3蛋白的表达,而作用弱于黄芩苷;z-VAD-fmk组RIP3蛋白的表达减弱,黄芩苷组、z-VAD-fmk组与联合用药组比较差异有统计学意义(P<0.05)。见图6。
3 讨论
坏死性凋亡是一种与坏死具有相似的形态学特征,细胞体积及胞内细胞器肿胀,包膜完整性破坏,内容物外泄,且为非Caspases 依赖性的程序性细胞死亡,即在泛Caspases 抑制剂(z-VAD-fmk)的条件下,死亡受体与配体的结合可触发坏死性凋亡。 RIP3 是诱导细胞坏死过程所必需的,而RIP1只有在 RIP3 存在的条件下才能发挥诱导细胞坏死的作用,在非Caspase酶依赖性的细胞坏死中起重要作用。坏死性凋亡的调节涉及一系列分子的表达与活化,RIP3在此过程中发挥重要的作用[13-14]。

A.正常对照组;B.黄芩苷组;C.z-VAD-fmk组;D.联合用药组

A.正常对照组;B.黄芩苷组;C.z-VAD-fmk组;D.联合用药组

A.正常对照组;B.黄芩苷组;C.z-VAD-fmk组;D.联合用药组;与黄芩苷组比较,*1P<0.01;与z-VAD-fmk组比较,*2P<0.01

A.normal control group;B.baicalin group;C.z-VAD-fmk group;D.baicalin+z-VAD-fmk group;Compared with baicalin group,*1P<0.01; Compared with z-VAD-fmk group,*2P<0.01
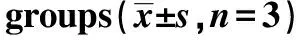
采用CCK-8法检测细胞活性的改变,经过不同处理的4组样品,结果差异有统计学意义,提示黄芩苷可以诱导结肠癌细胞的死亡;分析方法中采用流式细胞法检测细胞的凋亡情况,源于现有报道中反映黄芩苷能够诱导细胞凋亡。凋亡的发生均有Caspase酶的参与,因此采用广谱Caspase抑制剂作为对照,易于观察出区别于细胞的形态和指标的变化,区别凋亡和坏死性凋亡的发生。本研究显示,黄芩苷在诱导细胞凋亡的同时,细胞也发生区别于凋亡的死亡方式。为证明细胞在药物处理后细胞核也发生的变化,本实验中采用DAPI对细胞核直接染色,随后在荧光显微镜下观察,经过黄芩苷处理过的细胞,细胞核浓染,出现明显的核碎裂现象。采用透射电子显微镜观察细胞质中线粒体的形态改变,线粒体发生明显的坏死特征,肿胀明显,并有内容物外泄,这是区别于凋亡的关键特点。RIP3是坏死性凋亡最关键的标志性蛋白,通过QPCR和WB法检测到它的基因和蛋白的表达明显增加。

A.正常对照组;B.黄芩苷组;C.z-VAD-fmk组;D.联合用药组;与黄芩苷组比较,*1P<0.05;与z-VAD-fmk组比较,*2P<0.05
图64组细胞RIP3蛋白条带与蛋白表达情况
A.normal control group;B.baicalin group;C.z-VAD-fmk group;D.baicalin+z-VAD-fmk group;Compared with Baicalin group group,*1P<0.05; Compared with z-VAD-fmk group,*2P<0.05
Fig.6ProteinbandsandproteinexpressionofRIP3infourgroupsofcells
经过上述实验:从细胞形态上,细胞膜、细胞质的线粒体、细胞核都发生形状的改变;以及坏死性凋亡受体相互作用蛋白RIP3水平发生明显的变化。由于本课题尚未完成,关于线粒体膜电位、ATP水平、LDH水平将在后续实验中逐步完善。因此,可以初步推断黄芩苷诱导小鼠结肠癌细胞发生了坏死性凋亡,且发现在联合使用Caspase抑制剂z-VAD-fmk时,黄芩苷诱导坏死性凋亡水平有所降低。因此,笔者认为:经黄芩苷处理后的细胞在发生凋亡的同时,也发生坏死性凋亡。
随着对坏死性凋亡研究的深入,在肿瘤对化疗药物引导的细胞凋亡产生抵抗情形下,研究者将治疗肿瘤的方向逐渐转向药物诱导肿瘤细胞坏死性凋亡,并发现一些药物能够通过诱导肿瘤细胞发生坏死性凋亡达到抗肿瘤作用。多种癌症研究中均发现,黄芩苷可以通过多条途径产生抗肿瘤作用。通过本研究加深了对细胞死亡方式的理解和认识,为后续研究奠定基础,也为黄芩苷在凋亡抑制或抵抗的情况下,在临床抗肿瘤应用提供了实验依据。

