中缝背核5-HT神经元在丙泊酚麻醉-觉醒过程中的作用
张鸿磊,李敬,张林勇,鄢贞琦
(遵义医科大学,贵州遵义563000)
全身麻醉药物应用临床已逾百年,但是其具体作用机制现在仍不明。研究显示,全身麻醉意识消失和恢复时产生的脑电变化与大脑睡眠状态及觉醒状态的脑电改变类似[1]。Brown等[2~5]研究中,功能核磁共振显示,在丙泊酚麻醉状态和睡眠状态下,下丘脑和丘脑区域的抑制输出均增强;且脑电图也均以慢波节律为主,提示丙泊酚麻醉和睡眠-觉醒过程可能存在共同的神经环路。有研究认为,睡眠-觉醒相关通路可能参与全身麻醉药物的麻醉作用[3]。中缝背核是脑内合成和释放5-羟色胺(5-HT)神经元聚集的重要区域,广泛投射至端脑、中脑和间脑[6],参与调控多种生理功能如睡眠-觉醒[7]、奖赏行为[8]、觅食行为[9]、疼痛的耐受性[10]以及情绪相关行为等。近年大量研究[11,12]提示,中缝背核内5-HT神经元及其投射区域是脑内的重要觉醒通路,中缝背核的5-HT神经元在觉醒期间释放的5-HT增加,且其神经元的电活动也明显增强。丙泊酚为临床常用麻醉药物,其主要作用于γ氨基丁酸(GABAA)受体,使细胞内CL-内流产生抑制神经元活动,而中缝背核的5-HT也广泛分布GABAA受体。以上研究结果提示,中缝背核的5-HT神经元可能参与丙泊酚麻醉-觉醒过程。为进一步探讨中缝背核的5-HT神经元在全身麻醉过程中的作用,2017年8月~2018年4月,本研究观察了激动或抑制中缝背核的5-HT神经元后,丙泊酚麻醉大鼠苏醒时间及脑电波的变化。
1 材料与方法
1.1 实验动物、试剂及仪器 健康SPF级成年雄性SD大鼠30只,300~350 g,购自第三军医大学实验动物中心,动物许可证号:SCXK(渝)2007-0005。1%丙泊酚(阿斯利康公司,国药准字H20030427)、GABAA受体激动剂(蝇蕈醇,Sigma公司,美国)、GABAA受体抑制剂(荷苞牡丹碱,Sigma公司,美国)。大鼠脑立体定位仪(STOELTING公司,美国)、动物保温系(STOELTING公司,美国)、颅骨钻(STOELTING公司,美国)、手术显微镜(WPI公司,美国)、钨丝电极(Tungsten Microelectrode,300K-500K:美国)、微量注射泵(史密斯公司,中国)。
1.2 中缝背核微注射模型的建立及分组 按40 mg/kg腹腔注射10%水合氯醛麻醉后,大鼠固定于脑立体定位仪,切开头皮暴露颅骨,根据大鼠脑立体定位图谱定位中缝背核:前后:+7.8 mm,深度:6.5 mm,并行颅骨钻孔术,暴露硬脑膜并轻轻拨开,将套管针放置到中缝背核内;在前额叶运动皮层即M区(前后:+2.0 mm,ML:+1.8 mm,DV:-2.0 mm)左右分别置入2个脑电记录电极,待术后大鼠恢复1周后进行组织学定位,套管位置位于中缝背核即为模型制作成功。将微注射模型随机分为激动剂组、拮抗剂组、对照组,各10只。
1.3 丙泊酚麻醉及GABAA受体激动剂、抑制剂给予方法 将各组大鼠置于固定鼠笼中暴露尾静脉,24 G动物静脉留置针置入大鼠尾静脉,固定尾静脉套管后,待大鼠恢复30 min后丙泊酚麻醉,以11 mg/kg诱导剂量推注丙泊酚,记录大鼠从开始麻醉给药到觉醒的时间。大鼠麻醉后即翻正反射消失后,轻柔置入微注射套管内芯,激动剂组、拮抗剂组、对照组分别给予GABAA受体激动剂(蝇蕈醇 0.5 nmol/μL)、GABAA受体抑制剂(荷苞牡丹碱0.5 nmol/μL)、生理盐水各1 μL,待大鼠苏醒,记录麻醉苏醒时间。
1.4 脑电活动观察 经尾静脉推注丙泊酚(11 mg/kg)快速诱导,使大鼠意识消失,取下微注射导管帽,拔出导管芯,连接好注射内管和微量注射泵,尾静脉连接延长管连续泵注丙泊酚(60 mg/kg·h)维持30 min,用脑电图连续记录M区皮层脑电活动。在麻醉维持30 min,三组大鼠中缝背核脑区微注射GABAA受体激动剂、GABAA受体抑制剂和生理盐水各1 μL。麻醉继续维持10 min停止微注射,用脑电图记录微注射给药后10 min脑电活动,取出微注射管芯和延长管。
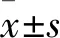
2 结果
2.1 三组麻醉苏醒时间比较 对照组、激动剂组及抑制剂组麻醉苏醒时间分别为(844.11±75.66)、(1 167.74±93.95)、(636.44±66.17)s。与对照组相比,激动剂组大鼠麻醉苏醒时间延长(P<0.05),抑制剂组麻醉苏醒时间缩短(P<0.05)。
2.2 三组脑电波变化情况 丙泊酚麻醉时,激动剂组微注射GABAA受体激动剂前δ波(1~4 Hz)比率为0.292 6±0.142 7、β波(12~25 Hz)比率为0.280 4±0.104 6,注射GABAA受体激动剂后δ波比率为0.459 6±0.223 0、β波比率为0.189 7±0.086 6。与微注射前比较,激动剂组微注射后脑电图δ波比率增高(P<0.05)、β波比率降低(P<0.05)。丙泊酚麻醉时,拮抗剂组微注射GABAA受体拮抗剂前δ波比率为0.407 0±0.072 8、β波比率为0.215 2±0.033 1,注射GABAA受体拮抗剂后δ波比率为0.210 4±0.096 9、β波比率为0.350 2±0.079 7。与微注射前比较,微注射后拮抗剂组δ波比率降低(P<0.05)、β波比率增高(P<0.05)。丙泊酚麻醉时,激动剂组微注射生理盐水前δ波比率为0.312 5±0.132 7、β波比率为0.234 6±0.153 2,注射生理盐水后δ波比率为0.341 2±0.146 8、β波比率为0.245 9±0.124 5。与微注射前比较,对照微注射后脑电图δ波比率和β波比率比较,P均>0.05。
3 讨论
网络调控学说认为,丙泊酚产生的全麻效应可能与作用于睡眠-觉醒神经环路有关。Purdon等[5]研究认为,丙泊酚麻醉诱导意识消失的特征性脑电图为睡眠梭形波,而睡眠梭形波也是非快动眼睡眠期(NREMS)的特征脑电。近年研究均提示网状上行激动系统参与全身麻醉过程[13~15]。网状上行激活系统是维持机体觉醒的重要通路,而中缝背核是其中的重要核团,越来越多的研究表明中缝背核分泌的5-HT在觉醒过程起着一定的作用。研究[15]发现,中缝背核的5-HT神经元在觉醒期稳定放电,在慢波睡眠期(SWS)和NREMS放电明显减少,而在快动眼睡眠期(REMS)电活动则完全受到抑制。Mukaida等[16]发现,异氟醚可以减少皮层及海马中的5-HT水平,而被氟西丁抑制5-HT摄取的大鼠则需增加异氟醚的麻醉浓度,上述研究均提示中缝背核的5-HT神经元可能参与调控麻醉的觉醒过程。
Cui等[17]实验发现,在中缝背核脑区微注射神经元兴奋剂Ca2+,5-HT释放增加,5-HT神经元的c-fos表达量(反映神经元活动)明显增加,大鼠觉醒时间增加,而SWS和REMS时间均减少;同时经典促觉醒核团蓝斑核(LC)和穹窿周围区的c-fos表达量也增加,促睡眠核团腹外侧视前核(VLPO)的c-fos表达量则减少。Monti等[6]研究认为,GABA可调控中缝背核突触前膜的兴奋性,在中缝背核微注射GABAA受体激动剂可以增加REMS睡眠时间,给予5-HT受体抑制剂则明显减少REMS睡眠时间。本研究结果提示抑制中缝背核5-HT神经元活动可延迟丙泊酚麻醉大鼠苏醒,而激活中缝背核的5-HT神经元可加速丙泊酚麻醉大鼠的觉醒,说明中缝背核5-HT神经元可促进丙泊酚麻醉大鼠的苏醒。
脑电图能较客观地反映皮层神经元的兴奋性,一般认为睡眠期间是以低频(<8 Hz)波(δ波、θ波)为主,在清醒期间则是以高频β波为主。在异氟醚麻醉下,Pillay等[13]电刺激促觉醒核团脑桥网状核,发现皮层的兴奋性增加,且δ波和θ波的比率显著降低。在丙酚麻醉中,中央内侧丘脑微注射去甲肾上腺素可缩短麻醉苏醒时间,同时皮层的θ波比率也降低[18]。利用光遗传技术发现,激活中缝背核的多巴胺神经元可以促进受试动物觉醒并且δ波明显减少,而用药物遗传学选择性抑制中缝背核的多巴胺神经元则受试动物觉醒时间缩短[7]。在中缝背核微注射Ca2+螯合剂乙二醇二乙醚二胺四乙酸可以明显增加戊巴比妥麻醉期间的慢波频率[19]。本研究中,大鼠M区皮层脑电图结果显示,微注射GABAA受体抑制剂激活中缝背核后δ波比率降低,β波比率增高,皮层兴奋性增高,脑电波呈觉醒趋势改变,麻醉大鼠苏醒时间缩短;微注射GABAA受体激动剂抑制中缝背核的5-HT,δ波比率增高、β波比率降低,脑电波呈睡眠的趋势改变,麻醉大鼠苏醒时间延长。提示中缝背核的5-HT神经元参与丙泊酚麻醉的苏醒过程中。
综上所述,网状上行系统中缝背核的5-HT神经元在丙泊酚麻醉-觉醒过程中发挥着促觉醒作用,但由于麻醉及神经网络的复杂性,明确中缝背核的5-HT神经元具体作用机制及其调控的通路还有待深入探讨。

