废水中重金属离子去除技术的研究及进展
刘扬志,刘鹏
(1.中国华电集团有限公司河南分公司,郑州 450046;2.华电郑州机械设计研究院有限公司,郑州 450046)
0 引言
当前国内一些地区水环境质量较差,水体中常见的污染物有氮氧化物(NOx)、硫氧化物(SOx)、碳氧化物(COx)、硫化氢(H2S)、挥发性有机物(VOCs)、含氮化合物(NCCs)、含硫化合物(SCCs)、重金属离子、染料、药品以及个人护理用品(PPCPs)[1],严重影响我国群众健康和经济的可持续发展。
其中,重金属作为典型的无机污染物,具有富集性、毒性、不易降解等特性,会损害生物体中枢神经系统,并在脑、肝等主要器官中富集,对生物体产生极大危害[2]。我国在2011年发布的《重金属污染综合防治“十二五”规划》中要求,到2015年,“重点区域”的铅、汞、铬、镉和类金属砷等重点重金属污染物的排放量要比2007年减少15%;我国于2015年正式颁布了《水污染防治行动计划》(简称“水十条”),该计划以改善水环境质量为核心,切实加大水污染防治力度,从而总体改善全国水环境质量、实现生态系统良性循环,这也标志着我国对水污染问题的整治进入战略性攻坚阶段。因此,如何处理重金属废水并有效回收重金属资源已成为当今社会面临的重要问题。
本文总结了近年来与处理重金属离子污染相关的5种处理技术及应用,并对重金属离子的进一步去除研究提出了展望。
1 化学沉淀法
化学沉淀法是指向废水中投加化学物质,使其和废水中的目标污染物发生直接的化学反应,生成难溶于水的沉淀物,以分离、除去污染物的方法。该方法常用于处理含汞、铅、铜、锌、六价铬、硫、氰、氟、砷等有毒化合物的废水。根据沉淀物的类型,化学沉淀法又可分为氢氧化物沉淀法、难溶盐沉淀法和铁氧体法3种。
氢氧化物沉淀法又称中和沉淀法,将碱加入到废水中后,水中的重金属离子会以氢氧化物或金属盐的形式沉淀析出。虽然该方法具有技术成熟、管理方便、自动化程度高等优点,但也存在着重金属污泥可能对环境造成二次污染、处理成本高、重金属脱除效果不理想等缺点[3]。
难溶盐沉淀法是指沉淀剂与重金属离子反应,最终以难溶化合物(如硫化物、碳酸盐、磷酸盐以及钡盐等)的形式脱除。以硫化物沉淀法为例,若溶液的pH值大于硫化物沉淀平衡pH值,金属硫化物沉淀将析出,若pH值过低,会有H2S气体生成。该方法通过调控溶液pH值可选择性地沉淀出溶度积较小的金属硫化物。目前,这类技术主要的研究方向在如何避免或减少H2S的产生、提高硫化渣中有价金属品位、增加硫化渣回收收益及降低回收成本[4]。
铁氧体法通过向废水中投放铁盐,调控工艺条件,使重金属离子在铁氧体的包裹、夹带作用下进入铁氧体的晶格中形成复合铁氧体,再采用固液分离的方法一次脱除多种重金属离子[5]。该方法具有脱除效果好、沉渣量小、化学性质较稳定并可同时脱除多种重金属离子等优点,但也存在着无法单独回收个别金属、处理后水中盐分较高、无法处理含汞和络合物的废水等不足之处。所以,许多学者提出了该方法与其他污水处理方法相结合的工艺(如电偶-铁氧体法、电解-铁氧体法、铁氧体-高梯度磁分离法)。
2 离子交换法
离子交换法是利用离子交换剂中可交换基团与溶液中各种离子间离子交换能力的不同进行分离的一种方法。其关键在于选择合适的离子交换剂和吸附、淋洗的条件。交换剂中交换基团的性质、交联度、粒度和交换容量的大小,对交换过程有着重要影响。Oehmen A等[6]在试验中对离子交换膜生物反应器(IEMB)进行了研究,对比了5种膜(Ionics CR61CMP,Nafion 117,Selemion CMV,Fumatech FKL和 Fumatech FKE)对Hg(Ⅱ)通量的差异。研究发现有较高离子交换能力、含水量和离子通量的生物膜 Fumatech FKE具有较高的脱汞率;用HgCl2对其预处理后,Hg(Ⅱ)的通量急剧增加,除汞率高达98%以上。作为高效的离子交换剂和吸附剂,离子交换树脂受到诸多学者的重视。如Stefan Simina 等[7]使用PuroliteS930离子交换树脂联合脱除水中Ca2+,Ni2+,Pb2+和Al3+,结果表明,PuroliteS930树脂对Ni2+表现出较高的选择性。张惠欣等[8]合成了5种杂多酸盐型离子交换剂,并测试其在含锰废水中对钙离子和锰离子的吸附性能,结果表明,这5种离子交换剂对钙离子的交换反应都很容易发生,其中微晶介孔材料焦磷钨酸锆的选择性与钙分子筛接近,而交换速率和交换容量能明显优于钙分子筛,性能尤为突出。离子交换过程符合准二级动力学模型和Laugmuir单分子层吸附模型。
由于重金属废水中金属主要以离子形式存在,使用离子交换技术处理不仅可以实现废水中重金属离子的脱除,还可以对重金属离子进行回收利用,实现废物资源化综合利用。因此,设计、开发选择性高、交换容量大、易解吸的离子交换材料是该技术在重金属废水处理中被广泛应用的重要前提条件。
3 电解法
电解法是指直接或间接地利用电解作用或利用电解产生的金属氢氧化物的凝聚作用,把水中污染物去除。以电化学法处理六价铬废水为例,六价铬通常以Cr2O72-和CrO42-的形式存在于废水中,通过铁离子和氢离子对六价铬进行还原,形成沉淀,发生的电极反应如下[9]。
(1)间接还原


(2)阴极还原

(3)

(4)
(3)沉淀去除

(5)

(6)
Nanseu-Njiki C P等[10]研究了铝铁电解脱汞法中电极距离、电流密度及废水初始pH值对脱汞率的影响。研究表明在电极距离为3 cm、电流密度为2.500~3.125 A/cm2的条件下,pH值从3到7时,Hg(II)脱除率大于99%;其电解脱汞率不受污水中有机物的影响,且铁电极达到最大脱汞率的时间远短于铝电极。罗志勇等[11]采用络合-超滤-电解集成技术处理重金属离子,在最佳试验条件下,回收Cu,Zn的电流效率可达60%以上,能耗分别为11.5 kW·h/kg和14.0 kW·h/kg,且重金属离子去除率几乎达100%,该技术实现了废水再生利用和重金属回收的双重目的。严刚等[12]发现,电解时间的缩短一方面是由废水质量浓度的降低和电流密度的增加引起,另一方面也与脱汞废水在进入电解装置前是否通过加碱沉淀预处理有关。
电解法是近年发展起来的颇具竞争力的重金属废水处理方法,具有无需添加化学试剂(氧化剂或絮凝剂)、处理效率高、占地面积小、噪声少、不造成二次污染等优点;但耗电量大、成本过高、析氧/析氢等副反应多等缺点限制了其进一步的工程应用。随着科技的发展,新型电化学反应器、电解法与其他方法的结合,以及传统电化学处理工艺的改进都将成为该方法的主要方向。
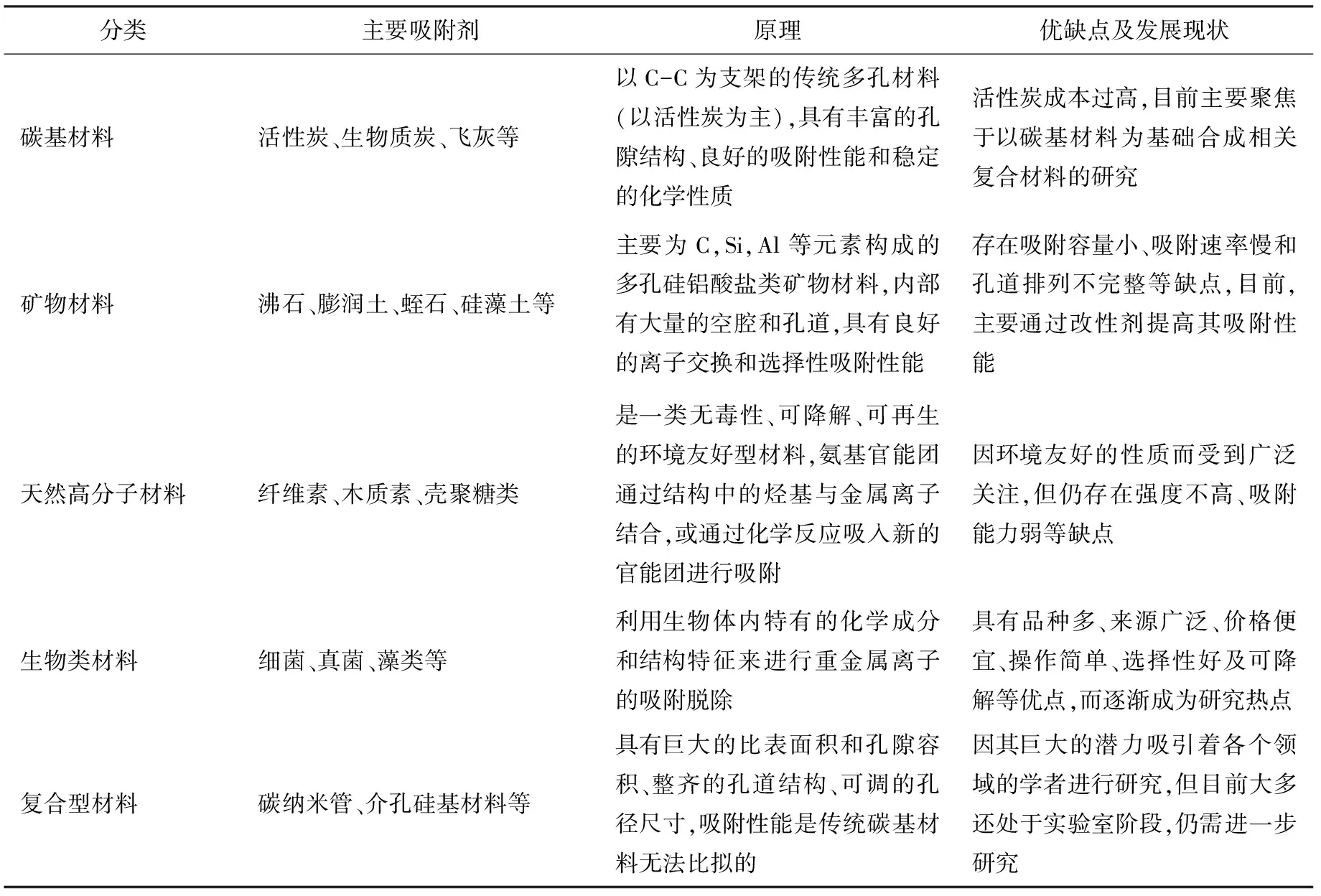
表1 常见的吸附材料及其优缺点Tab.1 Common adsorption materials and their advantages and disadvantages
4 氧化技术
氧化技术是通过强活性的自由基来降解有机污染物的一种水处理技术,它可以使难降解的有机污染物发生开环、断键、加成、取代、电子转移等反应,使大分子有机物转变为小分子、易降解的物质,以达到无害化处理的目的。其中,光催化氧化技术是利用氧化剂在光辐射下产生氧化能力较强的自由基来氧化污染物的一种高级氧化技术[13]。
5 吸附法
吸附法利用多孔性固体吸附剂处理污染物,使其中的一种或几种组分通过分子引力或化学键力的作用被吸附在固体表面,从而达到分离的目的。吸附法在重金属离子脱除方面除了具有操作简单、能耗低、无二次污染等优点外,还具备脱除产物易回收利用、符合循环经济和可持续发展要求等特性,被认为是最有前景的水处理方法[16]。
5.1 常用吸附材料
吸附剂对重金属污染物的脱除能力主要取决于其结构和性质。优秀的吸附剂应具备价格低廉、制备简单、性质稳定、吸附容量大、易脱附和再生效果好等特点。常用的吸附材料有活性炭、飞灰、膨润土、木质素、壳聚糖、黏土、沸石等传统材料及碳纳米管、氧化硅等无机物和聚乙烯树脂等合成类材料,具体分析见表1[17-26]。目前,吸附法仍存在着成本过高、吸附容量小、吸附速率慢和选择性差等缺点,分析原因主要是材料的比表面积和孔径小、孔道排列不完整等。因此,未来重金属废水吸附的发展方向应聚焦于新型、高效、绿色环保型吸附材料的设计、开发与应用上。
5.2 新兴的吸附材料
国内外学者聚焦于通过某些有机物(如烃基、羧基、巯基等)将传统材料改性,增加其吸附性能,并寻求新型复合材料来替以Si-O和C-C为支架的传统多孔材料。这些新型的材料因具有巨大的比表面积、高孔隙率、独特的微观结构和特殊的物化性能,而被广泛地应用于催化、气体储存、分离等领域,在水处理方面的应用前景也十分广泛。
5.2.1 石墨烯及其复合材料
石墨烯(graphene)既是最薄的材料,也是最强韧的材料,断裂强度比最好的钢材还要高200倍;同时它又有很好的弹性,拉伸幅度能达到自身尺寸的20%。石墨烯因具有巨大的比表面积、电传导性、化学稳定性等优异的物理、化学特性,吸引着各个领域的学者。
布林朝克等[27]通过一步共沉淀法制备了部分还原氧化石墨烯-四氧化三铁复合物(PRGO-Fe3O4),开展了水中Mn2+的吸附研究。结果表明,PRGO-Fe3O4中Fe3O4颗粒分布均匀,剩磁和矫顽力均很小,当废水的pH值为7、PRGO-Fe3O4的质量浓度为500 mg/L时,吸附量可达404.49 mg/g,对Mn2+的吸附率可达99.35%。经5次循环吸附后,复合材料的吸附效率仍可达78%。此外,Fe3O4颗粒可防止氧化石墨烯(GO)片层堆叠,同时利用其磁力实现GO的高效脱离。Qu Z等[28]通过水热反应制备了Ag/graphene复合材料,当pH值<5时,对Hg2+的吸附效率可高达99%,吸附过程符合拟二级反应动力学模型。王艳春等[29]利用瞬时加热还原氧化石墨的方法制备石墨烯,将热还原的石墨烯用于水中Pb2+的吸附试验,研究不同条件下的吸附情况,并通过Langmuir和Freundlich吸附等温式对实验数据进行拟合。结果表明,Langmuir等温式计算的最大吸附量为86.50 mg/g,相关系数(R2)达到0.998 2;Langmuir常数(K1)为10.7。实验证明石墨烯具有超强的吸附能力,吸附过程以单分子层的化学吸附为主,吸附动力学符合准二级动力学模型。
5.2.2 金属有机骨架
金属有机骨架材料(MOFs)是一种以无机金属离子与有机配体通过自组装的方式形成的多孔材料,它既有别于沸石和分子筛等无机材料,也不同于常用的有机聚合物。作为一种新型多孔功能材料,它横跨了晶体工程学、无机化学、材料化学、配位化学、超分子化学、有机化学、物理化学等多个学科[30]。MOFs材料(常见的3种微观结构如图1所示)因其微观结构可调节性、巨大的比表面积、良好的拓扑结构、高孔隙率、选择性吸附以及优异的光、电、磁性能,在气体储存、蒸汽吸收、化学物质分离、生物制药、物质聚合、磁力、物质催化以及荧光识别等领域受到了广泛关注[31-38],目前已成为跨学科的研究热点之一。

图1 典型MOFs材料的微观结构Fig.1 Micro-structures of typical MOFs
Ke F等[39]通过水热法合成了硫醇改性的Cu-BTC材料,在水中进行Hg2+和Pb2+的选择性吸附脱除试验:通过硫醇基与Cu-BTC的不饱和金属中心进行配位,提高了Cu-BTC在水中的稳定性,具体过程如图2所示。通过不同剂量的乙二硫醇对Cu-BTC进行改性。结果表明,骨架中S/Cu摩尔比=0.92时,Cu-BTC对Hg2+的吸附量达到最大值714.29 mg/g,即使Hg2+的初始浓度低至81 μg/g时,去除率高达90.74%。

图2 硫醇改性的MOFs材料的原理[40]Fig.2 Mercaptan modified MOFs material synthesized by coordination bond[40]
Ke F的另一篇文章[40]以硫醇改性的Cu-BTC材料为基础材料,通过后合成法成功把Fe3O4引入到材料中,制备出硫醇改性Fe3O4@Cu3(BTC)2磁性微球,来进行Hg2+和Pb2+的联合脱除。试验结果表明,复合材料Fe3O4@Cu3(BTC)2-SH磁性微球在其他金属离子共存的情况下,依然对Hg2+和Pb2+展现出了高度的选择性吸附能力,通过EXD光谱分析仪对S/Cu摩尔比=0.54和S/Cu摩尔比=1.13的Fe3O4@Cu3(BTC)2-SH磁性微球进行分析,结果表明硫醇改性后Fe3O4@Cu3(BTC)2磁性微球的S/Cu摩尔比与负载到材料上的S含量之间呈正比关系,通过填入Fe3O4,引入磁性成分,使材料后期分离更加容易。
He J等[41]在实验室条件下,通过反应合成原位(in-situ)溶剂热合成法成功在Al2O3基质表面合成了Zr-MOFs薄膜,并通过与Zr-MOFs吸附剂的对比试验,在水中进行了氟离子的脱除研究。合成过程如图3所示。通过初始质量浓度、流动速度和温度的变化,研究各因素对Zr-MOFs吸附剂和Zr-MOFs薄膜吸附性能的影响,结果表明:Zr-MOFs吸面积可达740.28 m2/g,当氟离子质量比为200 mg/g时,最大吸附量可达102.40 mg/g;Zr-MOFs薄膜也展示出了优秀的吸附能力,当氟离子质量浓度分别为5,8,10 mg/L时,厚度为20 μm的Zr-MOFs薄膜吸附容量分别达到5 510,5 173,4 664 L/m2,平均脱除率可达到98%,完全可以应用到氟离子的脱除上。这项研究成果进一步肯定了MOFs材料在水处理方面的能力,并展示了处理MOFs薄膜技术的可行性。
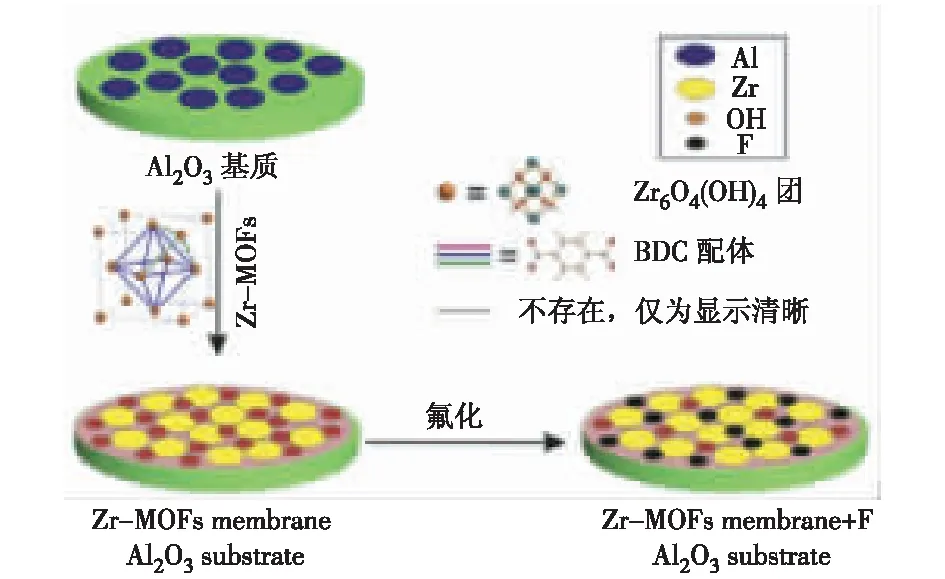
图3 Zr-MOFs薄膜合成示意图[41]Fig.3 Synthesis schematic diagram of Zr-MOFs thin film
除此之外,Fu Y Y等[42]在SiO2微球表面循环3次生长ZIF-8晶体,得到了厚度为400 nm的ZIF-8包覆层,MOF@SiO2是指以MOFs为内核、SiO2为外壳的复合材料。SiO2壳层可赋予材料良好的水分散性、生物兼容性以及介孔结构等特性。赵祯霞[43]等以Zn(O2CCH3)2为锌源合成了纳米级的MOF-5晶体,并以此为晶种在多孔Al2O3载体表面形成连续的晶种层,进而制备出了超薄的MOF-5晶体膜等。
6 结论
随着科学技术和科研水平的不断提高,涌现出了大量的吸附材料,并逐渐在环境保护和修复方面展现了广阔的应用前景。然而很多材料(如MOFs材料和GO材料等)仍处于实验室研究阶段,并没有大规模用于实际的工业废水处理,这主要是由于吸附材料在批量制备、吸附后的污染物去除以及成本过高等缺陷,需要国内外科研工作者的进一步深入研究。因此,设计并开发生物兼容、环境友好、绿色新型、高效低毒的吸附材料是当前处理化工、农业、医药等领域产生的水体污染的研究热点之一。

