球孢白僵菌(Beauveriabassiana)NO6的分离、鉴定与除草活性
王 伟,程 亮,朱海霞,郭青云
(1. 青海大学,西宁 810016; 2. 青海省农林科学院,西宁 810016;3.青海省农业有害生物综合治理重点实验室,西宁 810016;4.农业部西宁作物有害生物科学观测实验站,西宁 810016)
野燕麦(AvenafatuaL.)为禾本科燕麦属小麦田伴生性杂草,一年生或越年生,属田间恶性杂草,在世界各地农田均有分布。其分蘖力强、适应能力强、繁殖率高,对田间农作物构成主要威胁[1]。目前,中国16个省(区)约160万hm2农田遭受不同程度野燕麦的侵害,其中冬麦区危害率达15.6%,春麦区危害率达25.3%,每年导致粮食减产约17.5亿kg[2]。目前,对野燕麦的防除主要采取小麦播前选种、人工拔除以及采用化学防除等方法,但小麦播前选种与人工拔除不仅成本昂贵,而且防除效果也不理想,因此大田喷施化学除草剂就成为防除野燕麦的首要措施[3],但采用化学除草剂防除存在诸多弊端,如环境污染、抗药性等一系列问题。因此,开展新型除草剂的研究,尤其是微生物源除草剂的研究,对发展生态农业、防除田间杂草具有重要的现实意义。
利用自然界生物中具有生物活性的代谢产物开发成新的生物源除草剂是杂草防除的一个重要途径和未来发展方向。自然界中的微生物(包括真菌、细菌、病毒)是开发成为生物除草剂的重要来源,其中应用最广的为真菌。目前,有超过40个属的真菌已经或者正在被考虑开发成为生物源除草剂[4]。近年来,随着生防真菌的发掘和研究,寻找新的具有除草活性的真菌难度越来越大,因此从盐碱地等极端环境中分离具有优良除草活性的特殊菌株逐渐成为研究的热点[5]。由于盐碱地具有高的盐碱、高渗透压的特殊环境,其中蕴含着特殊的微生物资源,目前所利用的特殊环境微生物资源仅是自然界存在微生物资源的一小部分[6]。本研究从青海省尖扎县坎布拉镇盐碱土样中筛选得到除草活性较高的NO6菌株,对该菌株进行种属鉴定,并对其次级代谢产物进行初步研究,对今后农田杂草的防除和开发盐碱地生态环境土壤微生物资源具有重要意义。
1 材料与方法
1.1 材 料
菌株是从青海省尖扎县坎布拉镇海拔2 800 m盐碱土壤中筛选得到的真菌菌株。杂草野燕麦(Avenafatua)种子采自青海省农林科学院植保所试验田,由青海省农业有害生物综合治理重点实验室保存。
1.2 主要仪器试剂
台式冷冻离心机(Sigma公司)、旋转蒸发仪(上海市爱朗仪器有限公司)、生化培养箱(宁波江南仪器厂)、PCR仪(Bio-Rad公司)、显微镜(Olympus公司)、高效液相色谱仪(江苏汉邦科技有限公司)。石油醚、正丁醇、乙酸乙酯、葡萄糖、氯化钠(分析纯,天津大茂化学试剂厂)、琼脂粉(美国Sigma公司)、析硅胶(200~300目,青岛海洋化工有限公司)、薄层层析硅胶板(青岛海洋化工有限公司)。HPLC甲醇(德国默克公司)。马铃薯葡萄糖琼脂培养基(PDA)。
1.3 菌株的分离、纯化
参照方中达[7]的方法。称取土壤样品10 g放入盛有90 mL灭菌超纯水的三角瓶中,振荡20 min,使土壤与水充分混合。用无菌水对混合液进行梯度稀释至10-2、10-3、10-4等不同体积分数稀释液。取100 μL稀释液涂布于PDA固体培养基表面,每个体积分数3个重复,28 ℃恒温箱中培养3~5 d,待菌落长出后,从菌落边缘挑取少量菌丝,进行再次纯化后保存于PDA试管斜面中,备用。
1.4 菌株发酵滤液及粗提物的制备
分离获得的菌株接入PDA液体培养基中,28 ℃、200 r/min摇床震荡培养5~7 d,将发酵液8 000 r/min离心5 min,弃沉淀,取上清过0.22 μm滤膜去除菌体,得到发酵滤液。NO6菌株发酵滤液用等体积石油醚、乙酸乙酯和正丁醇萃取2~3次,至萃取液变为无色,经减压浓缩后分别得到石油醚提取物、乙酸乙酯提取物和正丁醇提取物。
1.5 除草活性测定
除草活性测定采用培养皿分析法[8]。分别测定菌株发酵滤液和各提取物对野燕麦除草活性。选择饱满完整的杂草种子,用10 g/L次氯酸钠溶液进行表明消毒,无菌水冲洗3次,在12孔板的孔中铺上圆滤纸片,加入待测发酵滤液1 mL,每孔置10粒种子进行除草活性测定。每处理重复3次,另设清水作为空白对照,28 ℃智能光照培养箱培养,处理3~5 d后测定根长和芽长,计算抑制率。按如下公式计算抑制率:抑制率=[(空白对照组的根(芽)长-处理组的根(芽)长)/空白对照组的根(芽)长]×100%。
将粗提物用二甲基亚砜溶解,配制成100 μg/mL的药液。在12孔板的孔中铺上圆滤纸片,加入待测药液1.0 mL,待溶剂挥发干后,加入1.0 mL蒸馏水,选择10粒成熟度一致的露白的杂草种子置孔中,保鲜膜封好,于28 ℃智能光照培养箱培养,每处理重复3次,测定根长和芽长,计算抑制率。
1.6 除草活性物质分离纯化
经大批发酵,获得菌株NO6发酵液共36 L,发酵液经5 000 r/min冷冻离心30 min,收集上清液部分。加入等体积的乙酸乙酯萃取3次,合并乙酸乙酯相40 ℃减压浓缩,再用甲醇浸提2遍,过滤除去不溶物,50 ℃减压浓缩除去甲醇得浸膏31 g。粗提浸膏首先经过正相硅胶柱层析,二氯甲烷/甲醇(体积比为25∶1、20∶1、15∶1、10∶1和1∶1)梯度洗脱,每50 mL洗脱液收集为一瓶,TLC检测洗脱进程,同时进行除草活性检测,最终合并活性馏分。利用制备型高效液相色谱仪(20 mm×250 mm,10 μm)在流动相为φ=48%甲醇、检测波长为220 nm、流速为3 mL/min、进样量为100 μL的色谱条件下,对上述经过硅胶柱层析所得的活性馏分进行分析,并检测其除草活性。
1.7 菌株的鉴定
1.7.1 形态学鉴定 菌株形态学鉴定参考《真菌鉴定手册》[9],根据菌落的生长特性、颜色、菌丝的形态特征、孢子的形态进行鉴定。
1.7.2 分子鉴定 真菌基因组DNA的提取使用Ezup柱式SK8259试剂盒[生工生物工程(上海)股份有限公司]。采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行ITS序列扩增。电泳回收产物由生工生物工程(上海)股份有限公司纯化并测序。利用Blastn(http://blast.ncbi.nlm.nih.gov/)与GenBank 数据库中的序列进行比对,获得同源性高的菌株ITS序列,利用Clustal W 按最高同源性的原则进行排序,之后利用MEGA 5.05软件构建系统发育树,确定菌株分类地位。
1.8 数据统计与分析
利用SPSS 20.0软件对试验数据进行差异显著性分析(Duncan多重比较分析,P=0.05)。
2 结果与分析
2.1 菌株发酵液及粗提物的除草活性测定
2.1.1 菌株发酵液对燕麦种子萌发的抑制效果 采用浓度梯度稀释法,从青海尖扎县坎布拉镇土壤中共分离得到9株真菌菌株(表1)。采用不同菌株发酵滤液对野燕麦种子萌发的抑制作用进行测定。试验结果表明:菌株NO6发酵滤液对野燕麦的胚根和胚芽萌发均有很强的抑制作用,抑制率分别达到93.10%和91.20%,菌株NO8-5和NO2-4发酵滤液对野燕麦种子的萌发抑制作用次之;菌株F8、1和NO9-1发酵滤液对野燕麦的胚芽和胚根抑制率低于60%;F10和G14发酵滤液对燕麦种子萌发抑制率均较低,对燕麦胚芽抑制率分别为-22.98%、-22.01%,胚根抑制率均低于30%,表明其对燕麦的胚芽生长有一定促生作用。
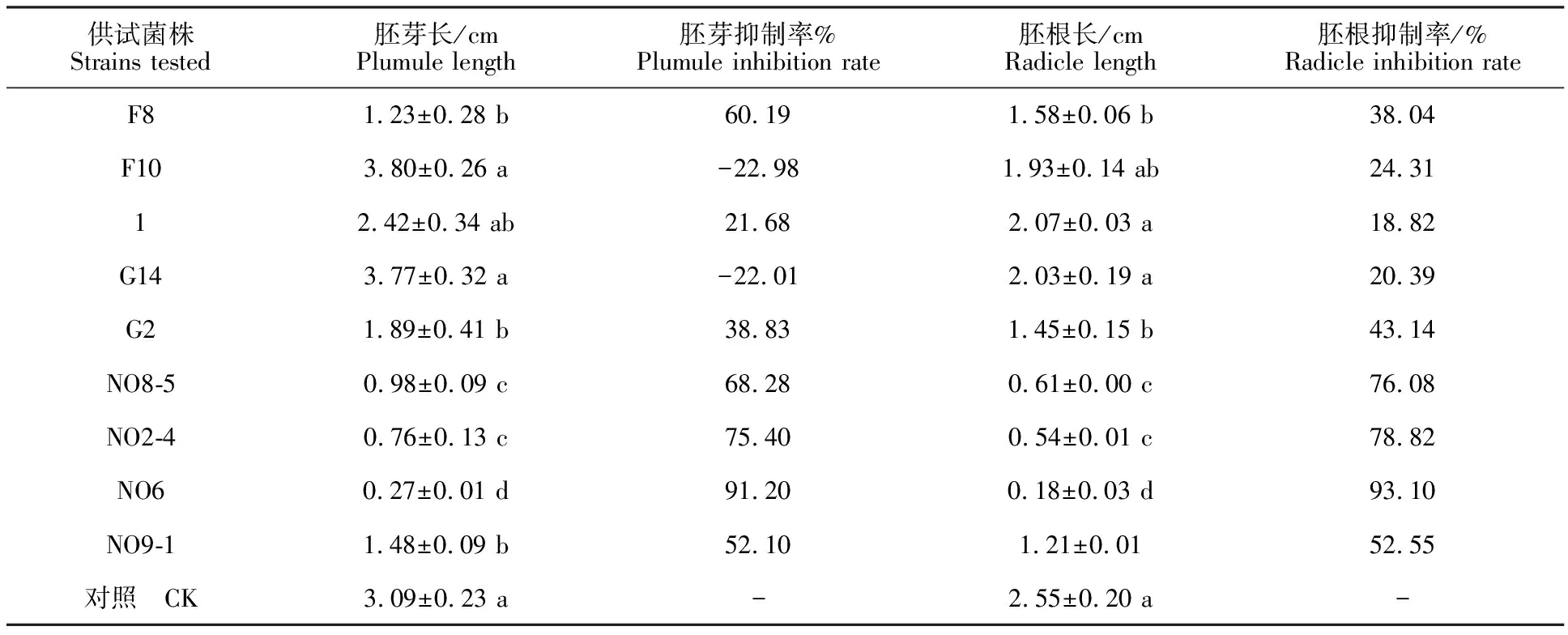
表1 不同菌株发酵液抑制野燕麦种子萌发效果Table 1 The germination effect ofAvenafatua L. seeds inhibited by different biocontrol strains
注:数值为“平均值±标准误”,同列数据后不同小写字母表示在0.05水平差异显著,下同。
Note:Data were presented as “mean±SE”, data with different lowercase letters within a column indicated significant difference at 0.05 level,the same below.
2.1.2 粗提物对燕麦种子萌发的抑制效果 综合考虑,选用对野燕麦胚根和胚芽抑制作用显著的真菌菌株NO6,制备提取该菌株的粗提物,通过培养皿分析法测其不同粗提物处理对野燕麦胚根和胚芽的抑制作用。由表2可知,在100 μg/mL 的质量浓度条件下,菌株NO6各粗提物对野燕麦胚根和胚芽的抑制作用存在显著差异。其中乙酸乙酯粗提物对野燕麦胚芽抑制率达到97.09%,对胚根的抑制率为96.08%,要显著高于正丁醇和石油醚粗提物的抑制作用,正丁醇和石油醚粗提物的除草抑制活性相当,达到90%以上,但这两者处理之间没有显著差异。

表2 培养皿分析法测定菌株NO6对野燕麦的防除效果Table 2 The control effect of fungi strain NO6 on Avena fatuaby Petri dish analysis
2.2 除草活性物质分离纯化
乙酸乙酯萃取得到的粗提物,按极性由弱到强的溶剂系统进行梯度洗脱后,共收集500个馏分,经过TLC检测合并得到16个馏分(编号为Fr1~Fr16),各馏分旋转蒸发至干后的甲醇溶解液,经培养皿分析法进行除草活性检测,结果显示16个合并馏分具有不同程度的除草活性(图1),表现为胚芽和胚根受到不同程度的抑制,其中以馏分Fr4除草活性最强,馏分Fr3和Fr5的对野燕麦有弱的抑制生长作用,初步确定除草活性成分主要分布在Fr3~Fr5号馏分中,同时对具有除草活性的馏分Fr3~Fr5进行TLC检测(图2),确定合适展开剂的比例,为下一次硅胶柱层析提供合适的洗脱剂比例。

左边A1~A4分别代表Fr1~Fr4;B1~B4代表Fr5~Fr8;C1~C4代表Fr9~Fr12;右边A1~A4分别代表Fr13~Fr16;B1~B4为空白对照。
A1-A4 represent Fr1-Fr4; B1-B4 represent Fr5-Fr8 and C1-C4 represent Fr9-Fr12 on the left,respectively.A1-A4 represents Fr13-Fr16 and B1-B4 represents blank control.
图1菌株NO6发酵液正相硅胶柱分离的不同馏分除草活性检测
Fig.1DifferentfractionherbicidalactivitytestseparatedbynormalphasesilicagelcolumnofstrainNO6fermentationliquid

图2 菌株 NO6发酵液正相硅胶柱分离的除草活性馏分的TLC检测Fig.2 TLC assays of different herbicidal fractions of strain NO6 broth after normal phase silica gel column purification
将硅胶柱层析中得到的具有较强除草活性组分Fr4转溶于甲醇进行HPLC分析。图3为馏分Fr4的HPLC分析图,可见该组分包括3个组分,其保留时间分别为13.852 min、29.718 min、66.868 min,分别标记为组分1、组分2和组分3,分别将这3个组分收集制备,培养皿分析结果显示(图4),组分3有明显的除草活性,其对野燕麦胚芽、胚根的抑制率分别达到87.74%和93.17%。组分1和甲醇洗脱组分除草活性较低。需要指出的是,组分2对野燕麦胚芽、胚根的抑制率分别为-36.13%和-99.08%,这表明其对野燕麦种子萌发有较强的促生作用(表3)。
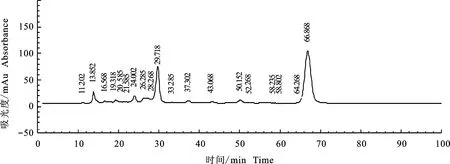
图3 馏分4 的HPLC峰谱图Fig.3 HPLC results of herbicidal components Fr4
2.3 菌株的鉴定
2.3.1 形态学鉴定 菌株NO6的菌落呈圆形,绒状、丛卷毛至粉状,培养初期多呈白色,后期变成淡黄色,偶成淡红色,背面无色或淡黄色至粉红色。菌丝生长缓慢,但产孢速度较快。分生孢子梗多不分枝,垂直着生于菌丝分枝或短的小分支上。分生孢子球形至近球形,或呈卵圆型,无色透明,壁薄(图5)。
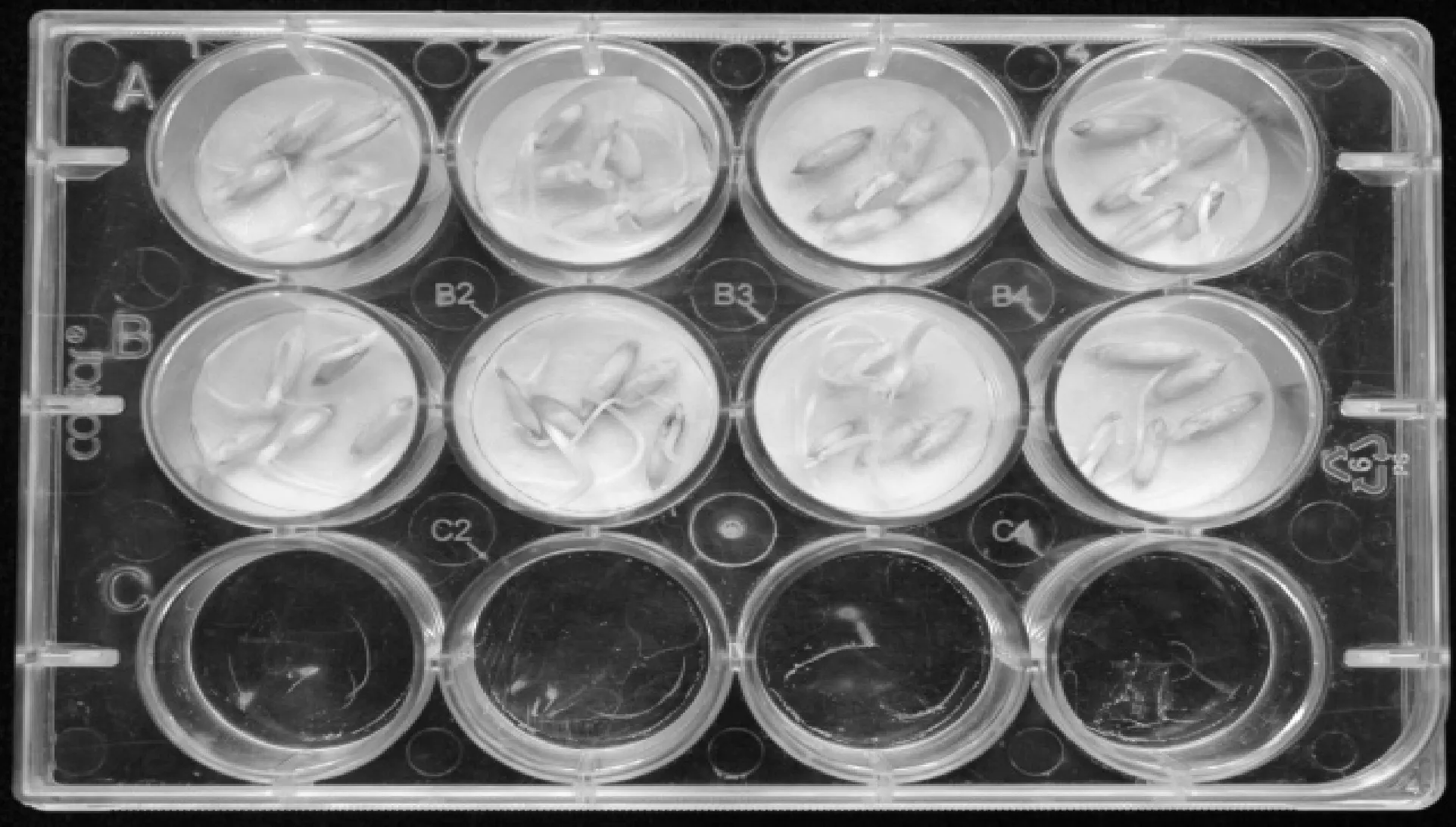
A1,A2,A3分别代表峰1,2和3馏分,A4代表甲醇洗脱组分,B1~B4代表空白对照 A1, A2, and A3 represent peak 1, 2 and 3 components, respectively. A4 represent component washed down by methanol. B1-B4 represents CK

图4 馏分4反相HPLC分离的不同组分除草活性检测Fig.4 Herbicidal activities of different components about fraction Fr4 after reverse HPLC purification

A.菌落 Colony;B.分生孢子梗 Conidiophore;C.分生孢子 Conidia
2.3.2 分子鉴定 菌株NO6经rDNA-ITS序列通用真菌引物PCR扩增后,获得552 bp大小的序列片段(图6),将序列测定结果上传至GenBank,其序列登录号为MH091336。利用GenBank数据库中BLASTn软件对该序列和GenBank中已登陆的rDNA-ITS序列进行同源性比较,该菌与球孢白僵菌同源性均在99%以上,调取其中与之同源性较高的菌株rDNA-ITS序列,利用软件Clustal W进行多重匹配排列分析,采用邻近法构建菌株系统发育树,结合菌株形态,确立该菌株的种属关系。由系统发育树(图7)可以看出,菌株NO6与Beauveria属内各种的一致性均在99.0%以上,系统发育分析归于同一分支,并结合其形态学特征,确定NO6菌株均为球孢白僵菌(Beauveriabassiana)成员。
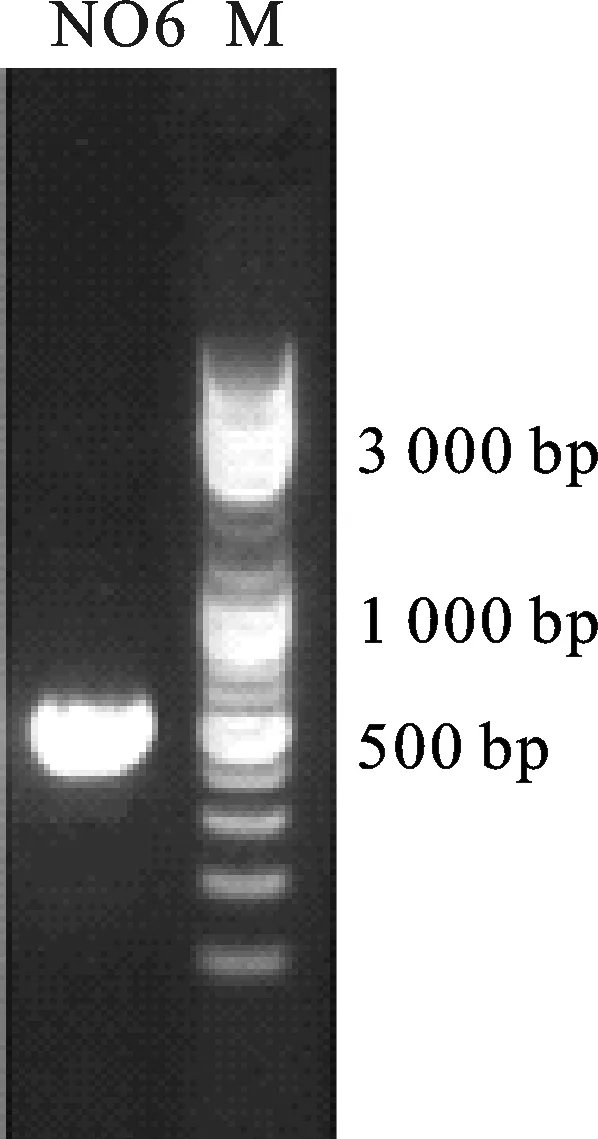
图6 NO6菌株的PCR产物的10 g/L琼脂糖凝胶电泳Fig.6 Electrophoresis of 10 g/L agarose gel of PCR production for strain NO6

图7 基于ITS rDNA序列Blast结果构建的菌株NO6的系统发育树Fig.7 Phylogenetic tree of fungi strain NO6 based on Blast results of ITS rDNA sequence
3 结论与讨论
微生物作为一类重要的天然生物资源,特别是近些年来,从特殊生境微生物中寻找具有生物活性代谢产物成为一个热点研究领域,尤其在真菌生物活性物质研究和开发利用领域,人们陆续从中分离和开发出新一代抗生素、抗病毒抗肿瘤药物和生物农药产品等。这些物质在医疗保健、生物农药、生物肥料、绿色饲料及环境保护等领域发挥着举足轻重的作用,日益受到研究者的青睐和重视。本试验从青海省尖扎县坎布拉镇盐碱土壤分离出具有除草活性的NO6真菌菌株,经过菌落、菌丝和孢子形态特征以及rDNA-ITS序列鉴定,初步确定该菌株为球孢白僵菌Beauveriabassiana。球孢白僵菌(Beauveriabassiana)隶属于白僵菌属,该属真菌分布广泛,是世界最常见的土壤虫生真菌[10],也是植物内生真菌[11],对多种植物害虫、病原菌有很好的抑制作用,可以提高寄主植物的抗病虫能力并促进植物生长,具有双重生防活性和促生作用[12-13]。本试验分离得到的具有除草活性的菌株NO6,是盐碱土壤微生物资源真菌的首次报道。
微生物能够产生种类繁多、结构新颖、活性多样和作用靶标特异的次级代谢产物,已成为发现新药先导化合物的重要来源。近年来,随着对微生物次级代谢产物的深入研究,人们在发掘大量有价值的活性天然产物的同时,对于微生物资源的重复筛选工作日益突现,发现具新颖结构的活性物质的机率逐渐下降。针对这一问题,不断拓展微生物药物新资源,从特殊生境中寻求结构新颖活性物质就成为研究者关注的热点[14-15]。关于特殊环境微生物次生代谢产物中具有抗菌、抗肿瘤研究报道的较多[16-17],而对具有除草活性的代谢产物鲜有报道,靳丽萍等[18]报道从黄蜻幼虫肠道中分离出拟盾壳霉属真菌,采用色谱分离技术从乙酸乙酯粗提物中分离出除草活性成分,在质量浓度为100 μg/mL,对稗草和反枝苋幼根生长有明显的抑制作用,抑制率分别为94.1%和79.0%。周瑜等[19]从青海高原分离的链霉菌,其发酵液经溶剂萃取、层析和色谱技术分离纯化出除草活性物质,该物质在低质量浓度下可使杂草黄化,高质量浓度时可抑制杂草种子发芽。薛章荣等[20]在东部海岛中分离链霉菌,其发酵液中含有除草活性物质,该物质在75 g/hm2剂量下,对阔叶杂草千金子、牛筋草、反枝苋和鳢肠的抑制率高达96.0%~100.0%。
针对微生物的代谢产物的分离和纯化,可以通过柱层析法[21]分离发酵产物的化学成分,现主要采用的是薄层层析[22]、凝胶过滤色谱法[23]和液相色谱等。本试验采用硅胶柱层析和半制备HPLC的方法对菌株NO6除草物质进行分离纯化,初步得到3个活性组分,其中第3组分的除草活性明显强于其他组分,并明确各组分的保留时间及HPLC分析条件,为进一步分析除草活性组分的化学结构奠定基础。
本研究从青海尖扎县坎布拉盐碱土中共分离得到9株生防菌株,通过培养皿分析初筛,以真菌菌株NO6发酵液表现出相对较高抑制效果。通过对发酵液进行溶媒萃取,发现菌株NO6乙酸乙酯粗提物表现出相对较高的除草活性。采用多种色谱分离技术,对NO6菌株代谢产物进行分离获得1个除草活性组分。上述研究结果提示盐碱土壤真菌代谢产物具有很好的除草生物活性,可能具有以往农用药剂不同的作用靶点,是开发新颖生物除草剂的重要资源之一,值得进一步研究。

