鞣花酸对BRCA1沉默的三阴性乳腺癌MDA-MB-231细胞生物学行为的影响及其作用机制
韦柳霞 何美玲 黄俊清 黄少欣 梁莉 何丽凤 张玉梅
三阴性乳腺癌(triple negative breast cancer,TNBC)是一种特殊的乳腺癌类型,占乳腺癌的15%~20%[1],具有较高的异质性及异型性,目前尚缺乏有效的治疗靶点,预后较差[2]。乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1) 是 DNA损伤同源重组修复网络中的关键因子,对维持基因组稳定具有重要作用。研究表明,BRCA1突变与TNBC发生发展密切相关,20%的TNBC存在BRCA1功能缺失[3-4]。鞣花酸(ellagic acid,EA)是一种存在于葡萄、石榴皮、草莓、坚果等植物组织中的多酚类植物化学物质,具有抗炎、抗氧化、抗纤维化、免疫调节等特性[5]。研究发现EA主要通过诱导肿瘤细胞凋亡以及抑制细胞周期、血管生成、癌细胞转移而发挥抗癌作用,在乳腺癌等多种肿瘤治疗中显示良好的抗癌效果[6-8]。本研究构建BRCA1沉默的人三阴性乳腺癌MDA-MB-231细胞株,探讨EA对其细胞增殖、迁移和侵袭能力的影响及作用机制,为TNBC诊疗寻找新的靶点。
1 材料与方法
1.1 主要材料
人三阴性乳腺癌细胞株MDA-MB-231购自中国科学院细胞库;BRCA1 siRNA和阴性对照siRNA均购自广州锐博生物科技有限公司。转染试剂 LipofectamineTM3000购自美国Invitrogen公司;BRCA1、PARP1兔抗鼠多克隆抗体购自美国Abcam公司;山羊抗兔IgG二抗购自上海碧云天生物技术有限公司;高纯度EA(批号:476-66-4,100 g/瓶)购自北京雅安达有限公司。
1.2 细胞培养
MDA-MB-231细胞置于含10%胎牛血清的DMEM高糖培养基,并于 37 °C、5%CO2培养箱中培养,每 3~4 d换液传代。取对数生长期细胞,并用0.25%胰蛋白酶消化成单细胞悬液,用于后续实验。
1.3 实验分组和siRNA转染
转染验证实验分为对照组(MDA-MB-231细胞加转染试剂LipofectamineTM3000)、阴性对照组、siRNA-1组、siRNA-2组和siRNA-3组。将对数生长期的MDAMB-231细胞接种于6孔板(3×105/孔),当融合度为50%~60%时转染。根据LipofectamineTM3000试剂说明进行细胞瞬时转染,分别将5 μL siRNA(BRCA1 siRNA或阴性对照siRNA)和5 μL LipofectamineTM3000溶于200 μL Opti-MEM无血清培养基中进行转染。
1.4 MTT法检测细胞增殖能力
1.4.1 EA对MDA-MB-231细胞增殖能力的影响 取对数生长期的单细胞悬液接种于96孔板(4×103/孔),共3板,培养18 h后更换新的培养基,每板分别加入不同浓度的 EA(0 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL和 20 μg/mL),每个处理组设 6 个复孔,于 37 °C、5%CO2培养箱中分别培养24 h、48 h、72 h。各孔加入10 μL 0.5%MTT溶液,避光孵育4 h,弃上清后加入150 μL二甲基亚砜,振荡10 min,用酶标仪测波长为490 nm的吸光度值(OD值),计算细胞增殖抑制率。细胞增殖抑制率(%)=[1-(EA组 OD值-空白组 OD值)/(对照组OD值-空白组OD值)]×100%。同时计算各时间点EA的IC50值,确定后续实验的药物浓度。
1.4.2 EA对BRCA1沉默的MDA-MB-231细胞增殖能力的影响 将阴性对照siRNA和siRNA-1转染后的MDA-MB-231细胞以及未转染的MDA-MB-231细胞分别接种于96孔板(4×103/孔),培养18 h后更换新的培养基,分别加入100 μL终浓度为5 μg/mL的EA,并分别设为阴性对照组、siRNA+EA组和EA组,同时设置对照组(siRNA+LipofectamineTM3000)。每组设6个复孔,于37°C、5%CO2培养箱中分别培养0 h、24 h、48 h、72 h、96 h。按 1.4.1 方法测定 OD 值。实验重复3次。
1.5 RT-qPCR法检测BRCA1和PARP1 mRNA的表达水平
收集各组细胞,按照Trizol试剂说明书提取细胞总RNA,测定RNA纯度及含量,按M-MLV反转录试剂盒说明书对mRNA进行反转录。引物序列由上海生物工程公司合成,以GAPDH为内参。引物序列:GAPDH上游引物为5′-CAGGAGGCATTGCTGATGAT-3′,下游引物为 5′-GAAGGCTGGGGCTCATTT-3′;BRCA1上游引物为 5′-ACCTTGGAACTGTGAGAACTCT-3′,下游引物为 5′-TCTTGATCTCCCACACTGCAATA-3′;PARP1 上游引物为 5′-CGGAGTCTTCGGATAAGCTCT-3′,下游引物为 5′-TTTCCATCAAACATGGGCGAC-3′。反应体系为20 μL。PCR 反应条件:变性 95 °C 15 s,退火 60 °C 60 s,延伸 72 °C 15 s,40 个循环。采用 2-ΔΔCt计算mRNA的相对表达量。实验重复3次。
1.6 Western blot检测BRCA1和PARP1蛋白的表达水平
收集并裂解各组细胞,提取细胞总蛋白,按BCA蛋白定量试剂盒使用说明书进行蛋白定量分析。加入蛋白样品(50 μg/孔),于8%聚丙烯酰胺凝胶电泳1.5 h,转至PVDF膜,用含5%脱脂奶粉的TBST封闭孵育1 h,加入一抗(稀释比例为 1∶500),4 °C 下孵育过夜,加入二抗(稀释比例为1∶1 000),孵育1 h。ECL化学发光曝光检测,凝胶成像仪观察分析。实验重复3次。采用Image Lab软件分析蛋白条带灰度值,蛋白相对表达量=PARP蛋白条带灰度值/GAPDH内参蛋白条带灰度值。
1.7 划痕实验检测细胞迁移能力
将对照组、EA组、阴性对照组和siRNA+EA组细胞接种于6孔板,并于37°C、5%CO2培养箱中培养,待细胞融合度达80%~90%时弃培养基,以无菌PBS清洗,以200 μL移液器枪头在培养板每孔的中央沿垂直于横线划一直线。无菌PBS漂洗2次去除划下细胞,在倒置显微镜下拍照并记为0 h。EA组、阴性对照组和siRNA+EA组细胞加入2 mL终浓度为5 μg/mL的EA,对照组加入2 mL不含EA的DMEM高糖培养基,继续培养48 h。倒置显微镜下观察24 h、48 h时各组划痕的愈合情况并拍照记录。采用Image Pro Plus 6.0软件计算各时间点划痕宽度并计算细胞迁移率。细胞迁移率(%)=[(0 h划痕宽度-24 h(或 48 h)划痕宽度)/0 h划痕宽度]×100%。
1.8 Transwell小室检测细胞的迁移和侵袭能力
对照组、EA组、阴性对照组和siRNA+EA组细胞消化后,加入无血清培养基调整细胞密度为1×104·mL-1,分别接种于含 Matrigel基质胶和不含Matrigel基质胶的24孔Transwell小室上室中,每室200 μL;下室含20%FBS的DMEM高糖培养基,每孔700 μL。常规培养24 h后取出小室,PBS清洗,擦拭上室内细胞,用结晶紫染色,PDS漂洗。于倒置显微镜下观察,拍照,200倍镜下随机选取5个视野计数并计算平均值。
1.9 统计学方法
采用SPSS 25.0软件进行数据分析和Graphpad prism 7作图。计量数据以均数±标准差(±s)表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 鞣花酸对MDA-MB-231细胞增殖的影响
MTT 实验结果显示,不同浓度的 EA(1~20 μg/mL)处理MDA-MB-231细胞24~72 h均能抑制细胞增殖,见表1。根据MTT实验结果,可计算出EA作用于MDA-MB-231 细胞 24 h、48 h、72 h 的 IC50分别为13.739 μg/mL、10.645 μg/mL、5.344 μg/mL,考虑不同浓度的EA对MDA-MB-231细胞的增殖均有抑制作用,而1 μg/mL EA作用于MDA-MB-231细胞24 h内抑制率与未加药组无明显差异,因此选择5 μg/mL EA用于后续实验。
2.2 构建BRCA1沉默的MDA-MB-231细胞
Western blot检测结果显示,对照组、阴性对照组和siRNA-2组在201 kD处存在BRCA1蛋白条带,而siRNA-1组和siRNA-3组不表达BRCA1(图1A)。RT-qPCR结果显示,对照组、阴性对照组、siRNA-1组、siRNA-2组和siRNA-3组的BRCA1 mRNA相对表达量分别为1.018±0.078、1.000±0.088、0.057±0.024、0.423±0.069和0.260±0.023,组间差异有统计学意义(F=145.602,P<0.001)。其中,对照组与阴性对照组比较差异无统计学意义(P>0.05);与对照组和阴性对照组相比,siRNA-1组、siRNA-2组和siRNA-3组的BRCA1 mRNA相对表达量均明显降低(均P<0.001),且siRNA-1组的相对表达量最低,说明siRNA-1组中BRCA1基因的沉默效果最好(图1B),因此选择siRNA-1组的MDA-MB-231细胞用于后续实验。
表1 不同浓度的EA对MDA-MB-231细胞增殖能力的影响(±s)Tab.1 Effect of different concentrations of EA on the proliferation of MDA-MB-231 cells(±s)
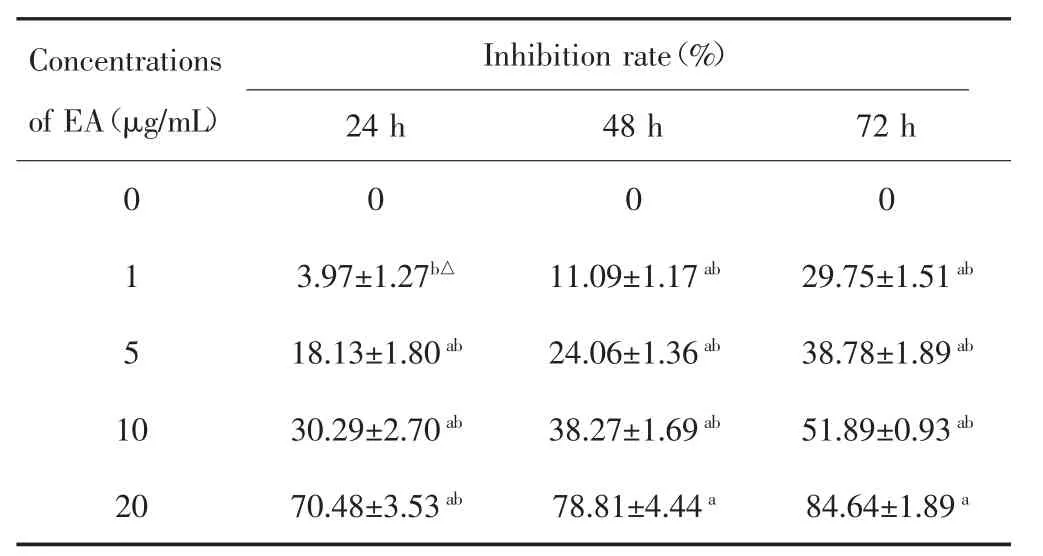
表1 不同浓度的EA对MDA-MB-231细胞增殖能力的影响(±s)Tab.1 Effect of different concentrations of EA on the proliferation of MDA-MB-231 cells(±s)
aComparison of inhibition rates between different drug concentrations at the same time point,P<0.05;bComparison of inhibition rates at different time points in the same drug concentration group,P<0.05;△Compared with the 0 μg/ml EA group,P>0.05
Concentrations of EA(μg/mL) 24 h 48 h 72 h 0 0 0 0 1 3.97±1.27b△ 11.09±1.17ab 29.75±1.51ab 5 18.13±1.80ab 24.06±1.36ab 38.78±1.89ab 10 30.29±2.70ab 38.27±1.69ab 51.89±0.93ab 20 70.48±3.53ab 78.81±4.44a 84.64±1.89a Inhibition rate(%)

图1 沉默BRCA1对MDA-MB-231细胞中BRCA1表达的影响Fig.1 Effect of transfection of BRCA1 siRNA on BRCA1 expression in MDA-MB-231 cells
2.3 EA对BRCA1沉默的MDA-MB-231细胞增殖能力的影响
MTT实验结果显示,作用24 h后,对照组、EA组、阴性对照组和siRNA+EA组OD值差异无统计学意义(F=2.871,P=0.104)。作用 48 h、72 h 和 96 h后,4 组的OD值差异均有统计学意义(P<0.001)。两两比较发现,siRNA+EA组的OD值均低于对照组、EA组和阴性对照组(P<0.001),见表 2。
表2 EA对BRCA1沉默的MDA-MB-231细胞增殖能力的影响(±s)Tab.2 Effect of EA on proliferation of BRCA1 silenced MDA-MB-231 cells(±s)
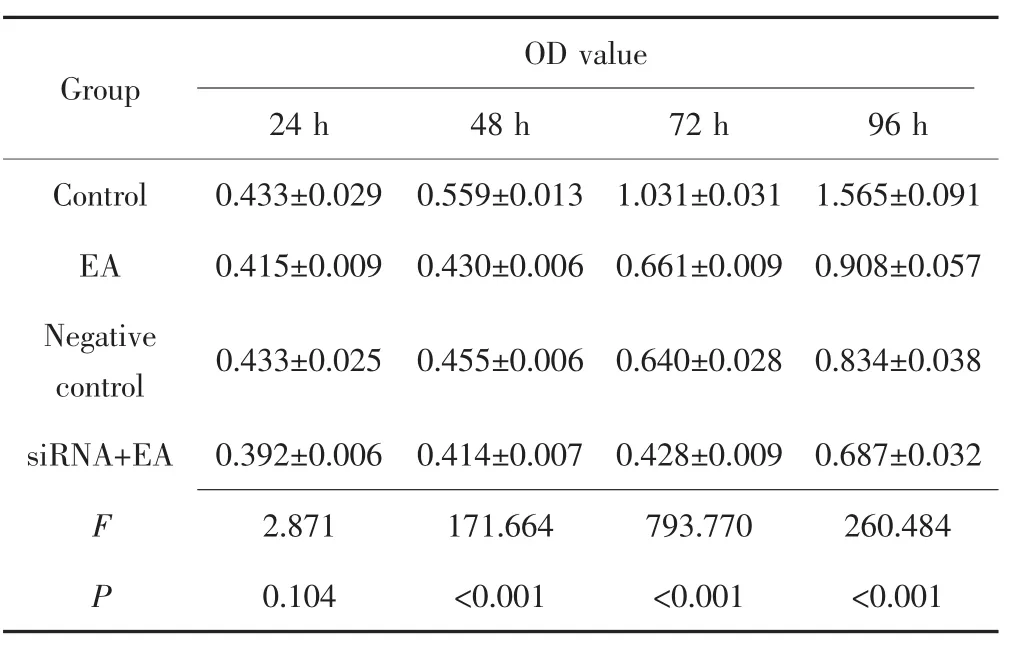
表2 EA对BRCA1沉默的MDA-MB-231细胞增殖能力的影响(±s)Tab.2 Effect of EA on proliferation of BRCA1 silenced MDA-MB-231 cells(±s)
Group 24 h 48 h 72 h 96 h Control 0.433±0.029 0.559±0.013 1.031±0.031 1.565±0.091 EA 0.415±0.009 0.430±0.006 0.661±0.009 0.908±0.057 Negative control 0.433±0.025 0.455±0.006 0.640±0.028 0.834±0.038 siRNA+EA 0.392±0.006 0.414±0.007 0.428±0.009 0.687±0.032 F 2.871 171.664 793.770 260.484 P 0.104 <0.001 <0.001 <0.001 OD value
2.4 EA对BRCA1沉默的MDA-MB-231细胞迁移能力的影响
划痕实验结果显示,培养24 h和48 h后,对照组、EA组、阴性对照组和siRNA+EA组细胞的迁移率差异均有统计学意义(F=42.749,57.167;均 P<0.001);两两比较显示,siRNA+EA组细胞迁移率均较其他组低(P<0.01),见图 2。


图2 划痕实验检测EA对BRCA1沉默的MDA-MB-231细胞迁移能力的影响(×100)Fig.2 Effect of EA on migration ability of BRCA1 MDA-MB-231 cells detected by scratch assay(×100)
Transwell小室迁移实验结果显示,培养24 h后,对照组、EA组、阴性对照组和siRNA+EA组细胞穿膜数差异有统计学意义(F=93.250,P<0.001);且 siRNA+EA组的穿膜细胞数明显低于其他组(P<0.001),见图3。

图3 Transwell小室实验检测EA对BRCA1沉默的MDA-MB-231细胞迁移能力的影响(×200)Fig.3 Effect of EA on migration ability of BRCA1 silenced MDA-MB-231 cells detected by Transwell chamber(×200)
2.5 EA对BRCA1沉默的MDA-MB-231细胞侵袭能力的影响
Transwell小室侵袭实验结果显示,对照组、EA组、阴性对照组和siRNA+EA组细胞穿膜数差异有统计学意义(F=47.745,P<0.001)。其中,EA组、阴性对照组和siRNA+EA组的细胞穿膜数均较对照组明显减少(P<0.001),且 siRNA+EA 组最少,见图 4。
2.6 EA对BRCA1沉默的MDA-MB-231细胞中PARP1表达的影响
Western blot和RT-qPCR检测检测结果显示,对照组、EA组、阴性对照组和siRNA+EA组的PARP1蛋白表达量分别为 0.49±0.03、0.30±0.02、0.36±0.01 和0.07±0.01,差异有统计学意义(F=228.194,P<0.001);PARP1 mRNA 表达量分别为 1.005±0.005、0.841±0.008、0.703±0.005 和 0.352±0.011,组间比较差异有统计学意义(F=7 790.139,P<0.001),进一步两两比较发现,siRNA+EA组PARP1蛋白和mRNA表达量均低于其他组(P<0.001),EA组与阴性对照组比较差异亦有统计学意义(P<0.05),见图 5。

图4 EA对BRCA1沉默的MDA-MB-231细胞侵袭能力的影响(×200)Fig.4 Effect of EA on invasion ability of BRCA1 silenced MDA-MB-231 cells(×200)
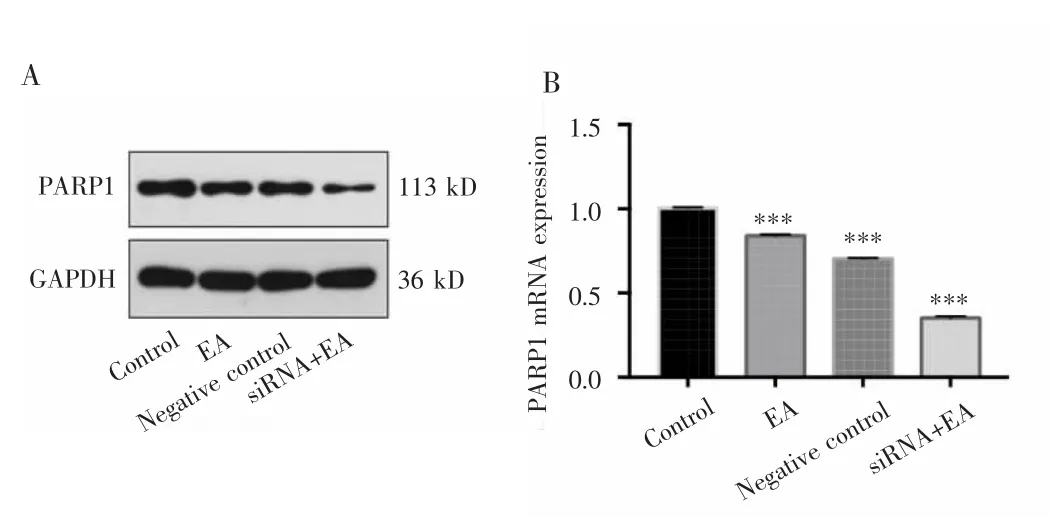
图5 EA对MDA-MB-231细胞中PARP1表达的影响Fig.5 Effect of EA on the expression of PARP1 in MDA-MB-231 cells
3 讨论
TNBC的发生发展由多基因、多通路、多分子蛋白共同参与。TNBC因缺乏有效的治疗靶点,内分泌治疗效果差,目前主要以蒽环类、紫杉类、铂类等传统药物化疗为主,但大多数患者化疗后耐药,疗效亦不理想。有研究观察EA对乳腺癌细胞的影响,发现20 μmol/L和40 μmol/L EA可抑制人乳腺癌 MCF-7细胞中DNA甲基转移酶的活性,从而影响DNA甲基化[9]。另有研究发现,15 μg/mL和20 μg/mL EA 可在 G0/G1期阻滞细胞周期且诱导细胞凋亡,从而抑制MCF-7细胞增殖[10-11]。而 WANG 等[6]研究发现,2.5~20 μmol/L的EA作用于乳腺癌MDA-MB-231细胞12~48 h后,可抑制细胞的增殖和血管生成。本研究采用不同浓度的 EA(1 μg/mL、5 μg/mL、10 μg/mL 和 20 μg/mL)分别作用MDA-MB-231细胞24 h、48 h和72 h后,发现不同浓度的EA均可抑制MDA-MB-231细胞增殖,且其IC50分别为 13.739 μg/mL、10.645 μg/mL、5.344 μg/mL,因此选择5 μg/mL EA进行后续实验。
BRCA1不仅可激活S期、G2/M期DNA损伤检测点,还可激活后续的DNA损伤修复机制,引起肿瘤细胞对化疗药物(如铂类)耐药,如BRCA1功能缺失,可使肿瘤细胞对顺铂敏感[12-13]。多项研究报道,与其他化疗方案比较,BRCA1/2突变TNBC患者采用以铂类为基础的化疗方案更能获益[14-15]。本研究利用脂质体法将BRCA1 siRNA转染MDA-MB-231细胞,成功构建BRCA1沉默的MDA-MB-231细胞,并采用5μg/mL EA处理,结果发现EA作用可明显抑制BRCA1沉默的MDA-MB-231细胞的增殖、迁移和侵袭能力,且较未沉默BRCA1的MDA-MB-231细胞的增殖、迁移和侵袭能力降低,与上述文献报道一致,说明BRCA1缺失对EA抗三阴性乳腺癌产生积极的影响。
王东等[16]报道,EA可破坏HEK-293细胞内氧化-抗氧化平衡,使细胞处于氧化应激状态,造成细胞DNA损伤。另有研究发现,EA可通过调节TGF-β/Smad3信号通路而抑制MCF-7细胞增殖[10-11]。此外,EA还可通过PI3K、mTOR等多种信号通路发挥抗乳腺癌作用[17-19],而这些信号通路均涉及多种DNA损伤修复的关键因子。聚腺苷酸二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]是参与 DNA 损伤修复的核酶,PARP1为最主要成员之一,具有DNA损伤修复、维持基因组稳定和调控细胞代谢、增殖、凋亡等作用[20-21]。TNBC患者多伴BRCA1基因突变或缺失,致使DNA损伤不能通过HRR机制有效修复,导致DNA损伤不断积累;而当TNBC患者PARP1蛋白表达上调[22],PARP1抑制剂可用于阻断DNA单链断裂修复,上述两种因素共同杀伤肿瘤细胞,即为“协同致死”机制原理,这正是PARP抑制剂用于BRCA突变或缺失患者的理论依据。初步的临床试验研究已证实,BRCA基因突变或缺失的TNBC患者对PARP抑制剂更敏感,疗效更明显[23-25]。而在前列腺癌[26]及结肠癌[27]研究中发现,EA 在诱导细胞凋亡过程中,均涉及DNA片段化从而导致PARP被切割裂解相关机制。为了明确BRCA1缺失及其相关DNA同源重组修复通路是否对EA抗TNBC产生影响,本研究利用RT-qPCR和Western blot检测EA作用BRCA1沉默和正常的MDA-MB-231细胞后PARP1的表达情况,结果显示,siRNA+EA组中PARP1 mRNA和蛋白的表达量均明显降低,表明EA可显著抑制BRCA1沉默的三阴性乳腺癌MDA-MB-231细胞的PARP1表达,其作用机制可能与BRCA1缺失导致其相关DNA修复通路障碍有关。
综上,EA可显著抑制BRCA1沉默的三阴性乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭,可能与抑制DNA修复通路中关键因子PARP1的表达,从而造成相关DNA修复通路障碍有关。但是,BRCA1突变形式多样,EA对BRCA1突变的三阴性乳腺癌细胞株生物学行为的影响及其作用机制有待在其他三阴乳腺癌细胞中验证,并探讨更多DNA修复通路相关基因的作用。

