茶黄素药理功效及分离纯化研究进展
涂云飞
(1.中华全国供销合作总社杭州茶叶研究院,浙江杭州310016;2.浙江省茶资源跨界应用技术重点实验室,浙江杭州 310016)
茶树(Camellia sinensis)鲜叶可通过传统的萎凋、揉捻及通氧“发酵”等工序制成红茶。红茶中茶黄素类 (Theaflavins,TFs)主要有4种化合物,即茶黄素(Theaflavin,TF)、茶黄素-3-单没食子酸酯 (Theaflavin-3-Gallate,TF-3-G)、 茶黄素-3’-单没食子酸酯 (Theaflavin-3’-Gallate,TF-3’-G)、茶黄素-3,3′-双没食子酸酯(Theaflavin-3,3’-Gallate,TF-3,3’-G),单体化学结构式如图1所示。茶黄素类可由茶鲜叶中对应的儿茶素类(Catechins),即表儿茶素(Epi-Catechin,EC)偶联表没食子儿茶素 (Epigallo-Catechin,EGC),EC偶联表没食子儿茶素没食子酸酯(Epigallo-Catechin Gallate,EGCG),表儿茶素没食子酸酯(Epi-Catechin Gallate,ECG)偶联EGC,ECG偶联EGCG,并在多酚氧化酶酶促氧化条件下合成。
当前世界茶叶贸易以红茶为主,占茶叶总交易量的70%。茶黄素作为红茶中一类具有苯骈罩酚酮结构的多酚,最初是由ROBERTS等于1957年从红茶提取物中分离鉴定,并因固体呈橙黄色而得名。茶黄素对人体具有广普性药理功效,并对红茶的口感滋味及品质高低起着十分重要的作用。因此,精制、富集、纯化茶黄素亦成为红茶深加工领域研究的热点。文章就近年来茶黄素的药理功效及分离纯化研究现状作总结与展望。
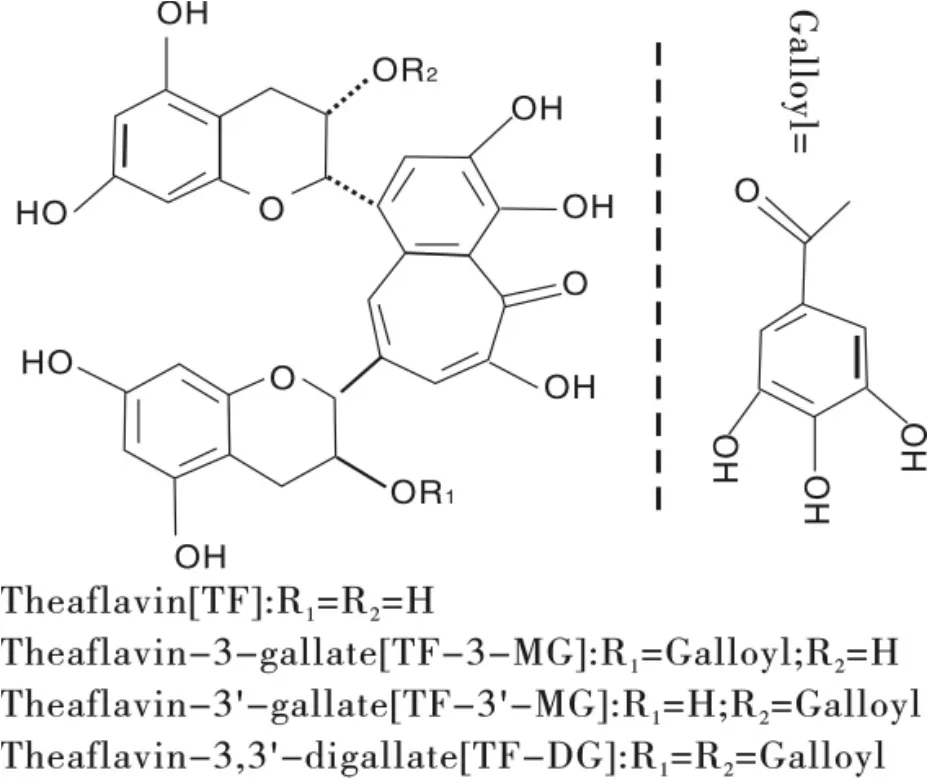
图1 茶黄素类化合物化学结构示意图Fig.1 Chemical structure of theaflavins
1 茶黄素的药理功效
1.1 抗氧化
自由基(Free Radical,FR)学说认为,正常人体内的自由基与抗氧化物质处于平衡状态。当人体器官和组织的细胞膜在自由基过量时便可能遭受其进攻,引起脂质过氧化、蛋白质变性、DNA链断裂、细胞解体、机体衰老,并可能诱发肿瘤等恶性疾病。体内过量的超氧阴离子及双氧水等,是产生毒副作用的重要因素。细胞中的主要抗氧化酶超氧化物歧化酶(Superoxide Dismutase,SOD)能够将超氧阴离子催化分解为双氧水(Hydrogen Oxygen,H2O2),H2O2在过氧化氢酶(Catalase,CAT)或硒谷胱甘肽过氧化物酶 (Selenium-glutathione Peroxidase,Se-GSH-Px)催化作用下迅速转化为无毒的O2和H2O。TFs具有良好的抗氧化性,如TFs可以清除自由基,防止脂质过氧化,提高SOD、谷光甘肽硫转移酶(Glutathione S-Transferase,GST)、醌还原酶(Quinone Reductase,QR)的活性,增强人体免疫力。
在低密度脂蛋白 (Low Density Lipid,LDL)模型中,TFs能够抑制二价铜离子介导的脂质过氧化[1-2]。研究表明,巨噬细胞中LDL氧化程度与金属离子浓度有关[3],金属离子浓度升高,LDL氧化程度也升高,而TFs能抑制LDL的氧化,这与它能螯合金属离子有关。YOSHIDA等[4]和HAN等[5]用TFs类化合物分别处理鼠巨噬细胞和人内表皮细胞,以考察细胞LDL氧化能力,结果显示TFs能与脂质氧合酶的活性中心铁结合,从而降低脂质氧合酶的活性,并抑制细胞LDL氧化。另外,TFs对外源性因子引起的生物膜脂质过氧化反应有较好的效果。如持续高强度的有氧运动会使肌肉酸痛肿胀,每天给予高强度有氧运动的男大学生1760 mg富含茶黄素的红茶提取物,持续9天,发现其能够缓解酸痛肿胀[6-7],即茶黄素能够提高肌肉损伤恢复能力并降低氧化应激程度。
茶黄素作为天然植物多酚类成分,可形成氢自由基,淬灭体内产生的自由基,从而保护组织,起到延缓衰老、抗突变、抗癌、杀菌消炎、防治心血管疾病和动脉粥样硬化等功能,故在医药领域得到人们广泛关注。因此,加强茶黄素类成分抗氧化机理研究与临床用药的应用显得尤为迫切。
1.2 抗心脑血管疾病
心血管疾病是心脏和血管疾患的总称,包括高血压、冠心病、脑血管疾病(中风)、周围血管疾病、血栓性疾病、动脉粥样硬化、心力衰竭、心脏病等。经济转型、城市化、工业化及全球化带来生活方式的改变,包括吸烟、缺乏活动、不健康饮食是导致心血管疾病增加的重要因素。每年死于心血管疾病的人数多于其它任何病因,成为全球头号死因。MARON等[8]设计了一种含有75 mg TFs、150 mg儿茶素和150 mg其他多酚的胶囊,给予240名18岁以上高胆固醇成年人群低脂饮食12周,且每日服用该胶囊。结果表明试验组能够使总胆固醇及低密度脂蛋白分别降低11.3%和16.4%,高密度脂蛋白与甘油三酯增长2%左右,降脂效果优于不含TFs的绿茶多酚胶囊。
茶黄素不仅通过抑制脂肪酸合成、激活脂肪酸的氧化消耗来降低脂肪积累,也通过肝激酶B(Liver Kinase B1,LKB1) 与活性氧途径激活 5"—磷酸腺苷 (Adenosine 5"-Monophosphate,AMP)依赖的蛋白激酶(Activated Protein Kinase,AMPK)达到抑制乙酰辅酶A羧化酶,降低肝脏脂质累积的作用[9]。在试验组与对照组在粪便量上没有显著差异的情况下,茶黄素能够抑制高脂饮食肥胖鼠体重增加及内脏脂肪累积[10]。茶黄素可以明显抑制由胶原、ADP、 前列腺素 H2 (PGH2)/血栓素 A2(TxA2)(TP)受体激动剂 U46619等多种刺激剂引起的人体血小板聚集[11],且呈现出剂量依赖效应。茶黄素还是血小板非受体酪氨酸激酶 (Non-Receptor Cytoplasmic Tyrosine Kinases,SYK) 胶原引起的血小板活性的一个重要的靶点抑制剂,茶黄素组和对照组相比,小鼠肠系膜动脉血管形成血栓性堵塞的时间明显延长,充分证明了茶黄素对血小板功能的抑制,且优于目前临床使用的抗血小板药物,如存在着出血、引起胃肠道不适等副作用的药物阿司匹林。
1.3 抗炎症作用
炎症(Inflammation)是机体对于刺激的一种防御反应,表现为红、肿、热、痛和功能障碍,包括感染引感染性炎症及非感染性炎症。任何能够引起组织损伤的因素,如致炎因子(Inflammatory Agent)都可成为炎症的原因。每日口服5 mg/kg剂量的 TF-3,3’-G能够显著改善三硝基苯磺酸(Trinitro Benzene Sulfonic Acid,TNBS) 诱导的结肠炎,降低结肠上皮粘膜肿瘤坏死因子(Tumor Necrosis Factor,TNF-α)、白细胞介素-12(Interleukin 12,IL-12)、人干扰素-g(Interferon-g,IFN-g)及诱导型一氧化氮合酶 (Inducible Nitric Oxide Synthase,iNOS)基因与蛋白表达水平[12]。 同时茶黄素能抑制佛波酯促使的TNF-α、白细胞介素 1β(Interleukin-1 beta,IL-1β)及白细胞介素 6(Interleukin 6,IL-6)的活性[13]。
TFs能够有效阻止脂多糖(Lipopolysaccharide,LPS)诱导的巨噬细胞促炎反应,包括抑制IL-6、单核细胞趋化蛋白(Monocyte Chemoattractant Protein-1,MCP-1)、细胞间粘附分子-1(Intercellular Adhesion Molecule-1,ICAM-1)的表达,并有效阻止LPS诱导的核因子抑制蛋白(Inhibitor of Nuclear Factor kappa B alpha,IκBα) 与核易位蛋白(Nuclear Translocation of REL-Associated Protein,RelA),胞外信号调控激酶(Extracellular Signal Regulated Kinase,ERK1/2)、c-Jun 氨基末端激酶(c-Jun-N-Terminal Kinase,JNK)及 p38 丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,p38 MAPK)的表达[14];在急性肺损伤小鼠模型中,TF-3,3’-G通过减少促炎因子降低急性肺损伤(Acute Lung Injury,ALI), 抑制 LPS 诱导的 JNK及p38 MAPK丝裂原活化蛋白激酶的表达。
风湿性关节炎 (Rheumatoid Arthritis,RA)或骨关节炎(Osteoarthritis,OA)最明显的特征是关节软骨的损伤。引起关节损伤和疼痛的IL-1β和IL-18在RA和OA中促炎症因子发挥重要作用。在IL-1β诱导建立的OA细胞模型中,TF-3,3’-G能够明显改善OA软骨细胞形态,上调软骨细胞分子标志物 II型胶原(Type II Collagen,Col II)mRNA的表达,还可以下调炎症因子IL-1β与IL-6 mRNA的表达,降低炎症诱导酶环氧化酶(Cyclooxygenase-2,COX-2)蛋白表达量;并可增强软骨细胞合成因子活性、减弱分解因子活性并抑制细胞炎症反应,有效延缓大鼠软骨细胞炎性退变进程[15]。
同时,茶黄素还可显著下调由血管紧张素II(Angiotensin II,AngII)诱导的促炎因子 IL-6 mRNA的表达,降低由AngII刺激产生的大鼠血管平滑肌细胞(Vascular Smooth Muscle Cell,VSMC)中ROS水平,达到抵抗AngII引起的大鼠VSMC细胞炎症作用[16]。
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)的突出特征是慢性炎症致气道阻塞,引起不完全可逆的气流受限,从而引发一系列临床症状。以往的研究表明,气道黏液高分泌是导致气流受限的危险因素。在刺激气道的各种炎性因子中,中性粒细胞弹力蛋白酶(Neutrophil Elastase,NE)被认为是肺炎性级联反应的终效应分子,以及炎症气道微生态平衡的重要恶化性推动因素[17],茶黄素被证明能够起到抑制气道黏液高分泌的作用。此外以高频雾化的方式使大鼠吸入茶黄素乳酸-羟基乙酸共聚物(Poly Lactic Co Glycolic Acid,PLGA)纳米粒,能够抑制香烟引起的炎性气道黏蛋白 (Mucoprotein 5AC,MUC5AC)高分泌作用[18]。
1.4 抗病毒与抗菌作用
严重急性呼吸系统综合症(Severe Acute Respiratory Syndrome,SARS)由 SARS 冠状病毒引起,该病毒属于包膜病毒,包含正极性单链RNA,其所含有的一个开放的阅读框用于编辑两个重叠的多聚蛋白,PP1a(Polyprotein-1a,450 kDa)与PP1ab(Poplyprotein-1ab,750 kDa)负责病毒的复制。同时冠状病毒都编辑生成Papline类似蛋白及胰凝乳蛋白酶(Chymotrypsin,3CLPro)类似蛋白,用于病毒成熟过程中蛋白水解加工。Papline类似蛋白水解酶在PP1a蛋白上只含不超过2个的剪切位点,而3CLPro蛋白酶在PP1a与PP1ab内在区域含有至少11个剪切位点。在720个筛选的天然化合物中仅发现TF-3,3’-G能够有效抑制3CLPro[19]。并且SARS冠状病毒在胃肠道中的复制非常活跃,红茶中的茶黄素类化合物具有预防该病毒对人体的侵染的应用潜力。
1%的乳酸(pH4.0)能显著抑制对于单纯性1型与2型疱疹病毒所引起的生殖器溃疡,但当pH>4.5时,则失去抑制活性状态。茶黄素特别是TF-3,3’-G 能够在 5.7>pH>4.5 区间独立发挥作用[20],并在非洲绿猴肾细胞及人非小细胞肺癌细胞A549中得到验证[21]。同时茶黄素还能够抗流感病毒[22],通过与血凝素HA2亚基结合,抑制病毒的神经氨酸酶活性从而抵抗高致病性禽流感(H5N1)病毒[23]的感染。并且,TFs可作为第二代杀微生物剂用于预防人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)的性传播,在高浓度时,还能抑制逆转录酶的活性[24]。
白念珠菌(C.Albicans)是一种腐物寄生菌[25],作为机会性条件致病菌,平时生存于人体的皮肤、粘膜、消化道及其他脏器中。当机体抵抗力降低时,白色念珠菌就会繁殖,达到一定量时,人体就会发病,通过微感染而引起的粘膜念珠菌病,对癌症、HIV及重症病人还会造成致命性打击。茶黄素对白念珠菌NCTC 3255和NCTC 3179能够起到很强的抑制作用,其最低抑制浓度为1024 μg/mL,联合儿茶素时其最低抑菌浓度降为128 μg/mL。
1.5 抗肿瘤
癌症与原癌基因的转录表达有着密切的关系。TF-3,3’-G能够通过溶酶体途径有效降低原癌基因丝裂原活化蛋白激酶 (Mitogen-activated Protein Kinase,MAPK)及丝苏氨酸蛋白激酶(Serine/threonine-protein kinase,Raf-1) 总量,10 μM TF-3,3’-G就能起到体外抑制由磷酸化丝裂原活化蛋白激酶磷酸化的细胞核内激活转录因子(p44 MAP kinases Ets-like protein 1,Elk-1)的作用,提示饮用含有TFs的红茶对癌症有预防作用[26]。同时,表皮生长因子在肿瘤中具有重要的促进作用,TF-3,3’-G诱导表皮生长因子受体内吞与降解作用,激活表皮生长因子受体泛素化与酪氨酸激酶活化,达到抑制肿瘤细胞体外增殖作用,下调表皮生长因子EGFR在JB6 Cl41细胞中的表达[27]。
在肝癌细胞体外处理中,茶黄素类化合物能够通过抑制STAT3信号转导与转录激活因子磷酸化,并进一步阻止其下游抗凋亡蛋白BCL-2与生存素(Survivin)及入侵相关蛋白MMP-2、MMP-9来达到显著抑制肝癌细胞的迁移、入侵的作用,诱使其凋亡[28]。此外,茶黄素类化合物对人类白血病细胞系HL-60与K-562呈剂量依赖性抑制,阻止细胞于G1期,活化Caspase 3和Caspase 8,下调BCL-2,同时上调BAX蛋白[29]。
同时,TF-3,3’-G显著降低由雄激素应答引起的人前列腺癌细胞LNCaP生长,抑制雄激素受体(Androgen Receptors,AR),降低雄激素诱导的前列腺特定抗原分泌及脂肪酸合成蛋白水平[30]。在乳腺癌小鼠模型中,每天给予0.05%的红茶提取物能够使其瘤体积变小(减小40%~42%),使剪切活化的Caspase 3水平增高,凋亡率增加,并活得更长[31]。在卵巢癌模型中,TF-3,3’-G通过上调p27,下调CyclinD1、CDK4和p-Rb蛋白水平诱导卵巢癌细胞OVCAR-3细胞周期阻滞于G0/G1期,推测Notch-1、Chk2、p27作为双酯型茶黄素的靶点,参与其抗癌作用[32-33]。
对于毒性化学试剂诱导的癌症,茶黄素也有预防与治疗作用。当小鼠口腔长期暴露于N-亚硝基二乙胺 (N-nitrosodiethylamine,NDEA)类化合物,不仅体重降低,而且会诱导口腔癌与肝癌。在其癌症发展过程中,茶黄素能精密、严格调控被化学试剂诱导而自动更新调整的Wnt/β-catenin信号通路,Hh/Gli1路及相关的G1/S-特异性周期蛋白-CyclinD1,cMyc及伴随下调上皮型钙黏附蛋白(E-cadherin)EGFR 基因表达[34]。 另外,TFs能够阻止具有致癌性的二噁英类化合物与细胞中芳香烃受体(Aryl Hydrocarbon Receptor,AhR)结合,并进一步阻止其与对应的DNA位点结合[35],达到预防作用。
1.6 茶黄素其它药理功效
在氧嗪酸钾诱导的小鼠高尿酸血症动物模型中,10 mg/kg茶黄素可明显降低血清尿酸水平与LDL水平;相比别嘌醇,其对肾脏并无明显损伤作用。茶黄素能分别升高钠磷共转运通道蛋白4(Sodium-Phosphate Transporter 4,NPT4)、 葡萄糖转运蛋白 9(Glucose Transporter 9,GLUT9)及尿酸盐转运蛋白 1 (Uric acid transporter 1,RAT1)的mRNA表达水平,可降低有机阴离子转运体1(Organic Anion Transporter 1,OAT1)、有机阴离子转运体 2(Organic Anion Transporter 2,OAT2)及钠氢交换调节因子3(Na+/H+Exchanger Regulatory Factor 3,NHERF3/PDZK1)表达;同时茶黄素还能够降低高尿酸血症小鼠血清尿酸,其降低血清尿酸作用[36]与抑制黄嘌呤氧化酶活性、调节相关阴离子转运体mRNA及其蛋白表达水平相关。
另一方面,将TF-3,3’-G负载于纳米修饰羟基磷灰石 (Nano Modified Hydroxyapatite,Nano-HAp)上,能够促进大鼠股骨缺损修复[37],且低浓度的TF-3,3’-G微球颗粒可促进骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)增殖及成骨因子和成血管因子的基因表达,及诱导成骨基因骨形态发生蛋白2(Bone Morphogenetic Protein 2,BMP-2)信号通路,丝裂原活化蛋白激酶(Mitogen-activated Protein Kinase,MAPK)信号通路中的ERK途径与p38途径参与BMSCs成骨分化的过程。另外,大剂量使用糖皮质激素容易引起股骨头坏死,激素性股骨头坏死采用骨髓间充质干细胞基础上联合茶黄素治疗效果理想[38],建模后4~8周空骨陷窝阳性数显著少于其他对照组。
2 茶黄素的富集纯化技术
2.1 茶黄素的富集技术
化工、核能与制药等工业的发展促使分离技术的发展,其中吸附性分离是通过吸附剂选择性物理吸附气体或液体中的目标分子,达到分离纯化的目的。大孔吸附树脂主要是以苯乙烯、二乙烯苯为原料合成的一种内部呈交联网状结构的新型非离子型高分子聚合物吸附剂,粒度为20~60目,具有比表面积大,在天然产物的富集纯化方面已得到了广泛应用。屠幼英公开了一种从红茶色素溶液中分离高纯度茶黄素的方法发明专利[39],该专利以大孔吸附树脂 AB-8、NKA-9或 Mitsubishisp-207为分离介质,并以20%~60%乙醇水溶液为洗脱溶液,分离制备得到高纯度茶黄素。徐懿等[40]进一步比较了 AB-8、NKA-9、SP-207 三种树脂对茶黄素的吸附与解析率,发现这3种树脂中AB-8对茶黄素的吸附作用最好,SP-207的吸附率约为47%,但是其特点是洗脱剂乙醇几乎可以全部解析被吸附的茶黄素。
郁军等[41]比较了3种不同极性的大孔吸附树脂NKA-9、AB-8和ADS-7对茶黄素的吸附纯化效果,结果发现茶黄素单体纯度与纯化条件密切相关。贾振宝等[42]亦以红碎茶为原料,比较了不同大孔吸附树脂对茶黄素的吸附与解析能力,发现HPD-300树脂对茶黄素有较高的吸附与解析能力,茶黄素的纯度由18.4%提高到67.2%[43-44](纯度由比色法测定),回收率达到73.7%。
2.2 茶黄素的单体制备技术
茶黄素单体最初是由ROBERTS等利用纸层析的方法制备鉴定,后来DAVIS等[45]用凝胶SephadexLH-20作为载体并以乙醇洗脱,获得茶黄素单体,并进行了结构解析。LEUNG等[46]先利用硅胶粗分茶黄素后,再利用70%的乙醇进行凝胶SephadexLH-20洗脱以获取其单体组分。凝胶SephadexLH-20适合茶黄素、茶黄素单没食子酸酯及茶黄素双没食子酸酯的分离,但对于茶黄素单没食子酸酯中的同分异构体的拆分效率较低。同时,中国专利[47]公布了一种以微晶纤维素和低取代度羟丙基纤维素先富集茶黄素再用Sephadex LH-20 凝胶, 实现茶黄素 TF、TF-3-G、TF-3’-G及 TF-3,3’-G 有效分离。
利用高速逆流色谱[48]也能够实现分离纯化,TF、TF-3-G、TF-3’-G 及 TF-3,3’-G 单体组分,其所采用的溶剂系统为乙酸乙酯-正己烷-甲醇-水(3∶1∶1∶6,v/v)。 相对于 Sephadex LH-20 柱色谱法,高速逆流色谱法无不可逆吸附,不会对体系造成污染。WANG等[49]进一步在该体系中添加乙酸并以正已烷-乙酸乙酯-甲醇-水-冰醋酸(1∶5∶1∶5∶0.25,v/v)进行高速逆流色谱运行500 min后一次性获得了四种茶黄素单体,纯度均达到90%以上。另外,发明专利[50]采用了凝胶柱层析和高速逆流色谱相结合的方法,从红茶提取物中大批量分离制备四种高纯度茶黄素单体的方法。以乙醇或丙酮作为凝胶色谱的洗脱剂,以烷烃-脂肪酸酯-脂肪醇-水组成的高速逆流色谱分离体系,可从茶黄素粗提物中分离制备10 g以上的茶黄素单体,产品纯度在97%以上。
另外,近年来中低压色谱[38]也应用到茶黄素单体的分离当中。谢练武等[51]以茶黄素混合物为原料,通过二醇基键合(diol)硅胶制备色谱分离纯化获得高纯度(纯度>95%)的 TF(95.6%)、TF-3-G(95.2%)、TF-3’-G(99.8%)和 TF-3,3’-G(96.3%)四种单体。与此同时,林丹[52]以自制茶色素(茶黄素含量65.2%)为原料,应用中压色谱MPLC方法对茶黄素进行分离纯化,实现了在190 min内TF、TF-M-G及TF-3,3’-G三种茶黄素纯品的制备,纯度分别为92.6%,98.9%,98.7%;三种茶黄素纯品得率51.5%,总回收率达79.0%。进一步优化条件后,以550 min分离一次得到四种主要茶黄素单体, 纯度分别为 92.6%(TF),96.5%(TF-3-G),94.8%(TF-3’-G),98.7%(TF-3,3’-G);四种茶黄素单体得率为53.5%,总回收率达82.1%。市场上,茶黄素粗品中以TF-3,3’-G含量较为丰富,而其它三种单体含量较低为特点。高速逆流色谱及中低压色谱近年来随着技术的进步也逐步走向工业化生产当中,制备茶黄素单体时,可利用高速逆流色谱联合Sephadex LH-20凝胶色谱柱、硅胶柱联合Sephadex LH-20凝胶色谱柱对其进行初步的精制或硅胶柱层析纯化。
3 展望
茶黄素作为红茶中含有苯骈罩酚酮结构的功能活性多酚类化合物,具有抗氧化、抗肿瘤、抗流感病毒及HIV病毒,调节免疫细胞功能,保护心脑血管等独特的作用;并对红茶茶汤的口感滋味及品质功效起着积极的作用,目前已受到国内外的广泛关注。精制富集纯化茶黄素成为茶叶深加工领域研究的热点,当前富集茶黄素的技术手段主要为大孔吸附树脂,大孔吸附树脂现虽已被广泛应用于茶黄素、黄酮、皂苷、生物碱类等天然化合物的富集纯化中,但大孔吸附树脂一般会残留危害人体的致孔剂,长期使用过程中树脂降解产物也会对产品造成安全隐患。另一方面,茶黄素制备过程所涉及的工艺路线长,耗时多,茶黄素制备过程易氧化且制量少,让一般研究工作者望而退步。寻求利用高性价比,且对生态环境无污染的绿色化、可再生性吸附材料富集制备高纯度茶黄素类化合物,将会对茶叶精深加工及其医药领域产生重要影响。

