CHD8蛋白与乙肝相关性肝癌肝移植术后肿瘤复发的相关性分析
陈慧娟,王培晓,黄丽虹,陈新国,张红英,张庆(.中国人民解放军总医院第三医学中心,北京 00039;.河南省儿童医院,河南 郑州 45008)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌。2018年世界将约有1 810万新发癌症病例和960万癌症死亡病例,其中约有84.1万例新发肝癌,78.2万例肝癌死亡,而中国仍然是肝癌的高危地区[1]。目前手术切除或肝移植依旧是最好的治愈手段,但术后肿瘤复发是影响患者生存率的重要因素。因此,探索肝癌肝移植术后肿瘤复发的相关机制变得尤为重要。
以往研究发现染色质调节因子的异常表达可以引起癌症中染色质结构的改变,促进肿瘤发生。其中染色体结构域解旋酶DNA结合蛋白8(chromodomain helicase DNA-binding protein 8,CHD8)编码的CHD8蛋白就是一种ATP依赖的含染色质和SNF2-related helicase /ATPase结构域的染色质重塑蛋白,有研究提示该基因可能通过与其他基因的相互作用参与肿瘤的发生发展过程[2]。目前CHD8与肝癌的相关研究尚无报道。
1 材料与方法
1.1 研究对象:回顾性分析2007年1月—2012年6月期间,中国人民解放军总医院第三医学中心收治的251例肝移植术的乙肝相关性HCC患者的临床及随访资料。所有患者肝移植术前均被检测为乙肝表面抗原阳性,肝移植后病理均确诊为HCC,随机选取5例正常供肝组织(健康供肝者的肝穿标本)作为对照组,251例患者随访截止至2017年12月。
1.2 材料及标本处理:术中采集的251例病肝标本、邻近癌旁组织及5例正常供肝组织标本经固定、包埋后切片。CHD8蛋白抗体购自北京博奥森生物技术有限公司。山羊抗兔IgG/HRP聚合物购自北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 免疫组织化学染色:石蜡切片脱蜡水化,PBS缓冲液中洗涤3 min×3次,采用高温高压法进行组织修复(2.5 min),PBS缓冲液洗涤3 min×3次,放入3%的双氧水中(10 min)除去内源性过氧化物酶,PBS洗涤后加一抗,4℃冰箱过夜,PBS洗涤3次,二抗37℃温育20 min,PBS洗涤3次,新配置DAB显色,显微镜下观察,阳性显色为棕黄色,自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,氨水返蓝,梯度乙醇由低到高脱水干燥,中性树脂封片。
1.3.2 染色结果的判定标准:阳性染色呈棕黄色颗粒,强度由弱至强分别记分:无黄色颗粒样沉淀为0分、淡黄色为1分、棕黄色为2分、深棕黄色为3分。阳性细胞百分比对应的值:阳性的细胞数<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。染色强度+阳性细胞百分比记分:阴性为0分,+为1~2分,++为3~4分,+++为5~6分。
1.4 复发判断指标:在肝移植术后的随访期间,肿瘤复发或转移主要通过监测血清甲胎蛋白水平、腹部B超、胸部X线或3~6个月进行一次腹部CT或MRI扫描,以及全身骨扫描来协助诊断。必要时可进行肝脏穿刺活检明确是否复发。
1.5 统计学分析:CHD8基因的表达强度与251例肝癌患者的临床病理指标的相关性分析,两组比较采用mann-whitney U 检验,多组间比较采用Kruskal-wallis H检验相关分析。P<0.05为差异有统计学意义,以上均采用SPSS 11.0软件分析。
2 结 果
2.1 CHD8在乙肝相关性肝癌组织中的表达(表1):结果显示,CHD8在癌组织中表达定位于细胞质,细胞核和细胞间质未见阳性表达,阳性染色呈棕黄色颗粒(图1)。CHD8在癌组织中表达的阳性率为65.3%,中-强阳性率(++~+++)为47.8%;在癌旁组织中表达的阳性率为84.9%,中-强阳性率为75.7%。对照组中的表达阳性率80%。结果显示CHD8在肝癌组织的阳性表达率低于临近的癌旁组织,差异有统计学意义(P<0.01)。
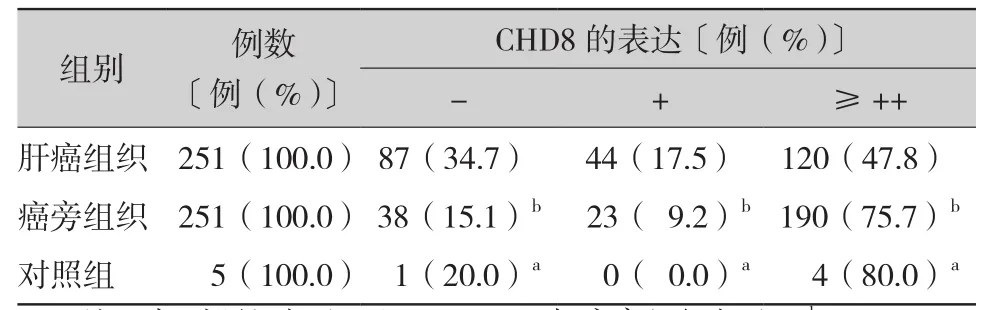
表1 CHD8在乙肝相关性肝癌组织中的表达
图1 CHD8在乙肝相关性HCC组织中阳性表达(200×)
2.2 CHD8在癌组织中表达与肝癌临床病理指标(表2):本研究表明,CHD8的表达与术前的微卫星灶(P<0.01)、血管侵犯(P<0.01)密切相关,与淋巴结转移无关。并且CHD8在肝癌中的表达与肝移植术后肿瘤复发(P=0.01)、肺转移(P=0.04)、除肝及肺外其他部位(骨、脑、肾上腺等)转移(P=0.00)具有相关性,与肝内复发无相关性(P>0.05)。

表2 CHD8在癌组织中的表达与肝癌临床病理指标及术后肿瘤复发的相关性分析
2.3 CHD8在癌组织中的表达与术前乙肝指标的相关性(表3):研究结果表明,在乙肝相关性的肝癌患者中,肿瘤中CHD8的表达与乙型肝炎e抗原(hepatitis B e antigen,HBeAg)(P=0.04)具有相关性,而与乙型肝炎病毒(hepatitis B virus,HBV)DNA的水平无关。
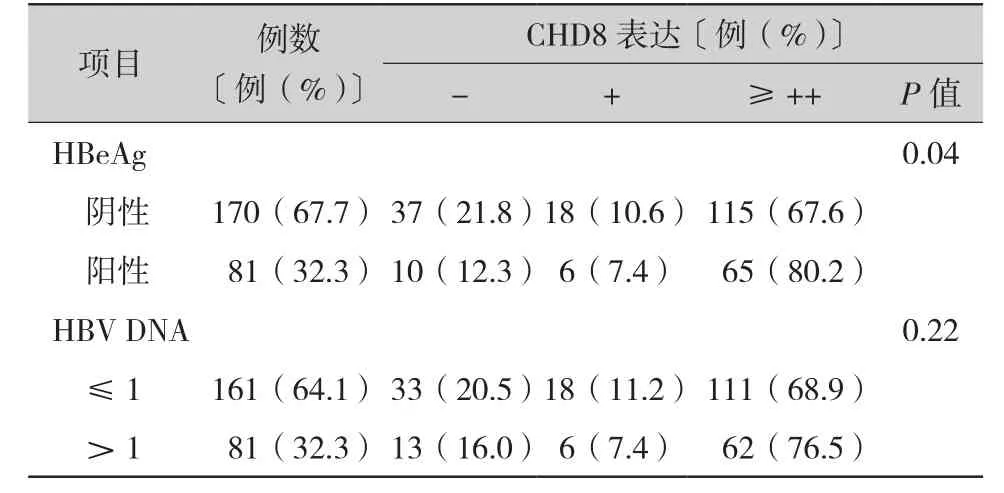
表3 CHD8在癌组织中的表达与术前乙肝指标的相关性
3 讨 论
正常的染色质调节是维持基因组功能的核心,而异常的染色质调节是癌症发生的驱动因素,如白血病中染色质调节因子的突变常导致了大量造血干细胞成为白血病干细胞[3]。CHD8基因属于染色体结构域解旋酶DNA结合蛋白家族成员,它是孤独症谱系障碍(autism spectrum disorder,ASD)中最常见的突变基因之一,近些年来愈来愈多的研究发现该基因在多种肿瘤存在较高的突变,如胃癌组织中CHD8 mRNA的表达显著降低,并且降低CHD8的表达能促进胃癌细胞的增殖[4-5],结直肠癌中CHD8的拷贝数变异(copy number variation,CNV)与结直肠癌的发生风险相关,并且CHD8较高的突变率显示出CHD8的表达缺失[6-7]。同时CHD8在乳腺癌[8-9]、前列腺癌母细胞性浆细胞样树突状细胞肿瘤[10]、结节性硬化症相关肾透明细胞癌[11]中都存在突变。这些改变可能通过CHD8介导的染色质重塑失调而促成癌症的发生与转移。
目前关于CHD8与肝癌发生发展的研究国内外尚无报道。本文首次探索了CHD8在肝癌组织中表达情况及其临床意义。研究结果显示,CHD8在肝癌组织中阳性表达定位于细胞质,在乙肝相关性肝癌中的表达主要与患者术前微卫星灶、血管侵犯等肿瘤病理指标显著相关,以往研究表明肿瘤血管侵犯和肿瘤肝外侵犯是HCC肝移植术后复发的独立危险因素[12-13]。本研究发现CHD8在肝癌组织中的阳性表达还与肝移植术后肺转移及其他远处转移显著相关。因此认为CHD8在癌组织中过表达可能与肝癌肝移植术后肿瘤复发、转移相关。此外,本文研究结果提示CHD8的表达与HBeAg有相关性,Yamasak等[14]研究发现HBeAg阳性导致持续性HBV感染中HCC发病的风险增加,而对于肝癌切除术后的患者,血清HBeAg阳性对复发和长期存活均有负面影响[15]。HBeAg能引起肝脏炎症反应,增加肝硬化及肝癌的发生风险[16],且HBeAg能损害抑癌基因P53的活性[17]。既往文献报道CHD8可以调节P53与Wnt通路的关键因子β-catenin蛋白,而P53是一个重要的抑癌和促凋亡基因[18],因此CHD8的表达可能受HBV复制的影响,与肝癌的发生相关。目前CHD8在肝癌中的作用机制尚不明确,Bae等[19]和Sawada等[20]通过酵母双杂交筛选发现,CHD8可以与β-连环蛋白结合,抑制β-连环蛋白的转录,以及对细胞周期调控中的作用,包括促进参与G1 / Stransition的E2F靶基因的转录[21],而CHD8的消耗能增强HOXA2表达,调节染色质修饰酶的募集[22]。本文推测肝癌组织中的CHD8低表达可能引起P53的调节下降,导致P53对DNA修复和促凋亡功能下降,使损伤的DNA存活克隆致使肿瘤的形成,但需进一步研究证实。
综上,我们的研究初步表明CHD8蛋白的表达与肝移植术后,乙肝相关性肝癌的复发、转移相关,可能作为CTNNB1及P53的调控因子参与了肝癌的复发与转移[7,20,23]。

