胍丁胺的柱前衍生方法及评价
周 娟,张惠静,胡岚岚 综述,汤建林△ 审校
(1.陆军军医大学第二附属医院临床药理基地,重庆 400037;2.陆军军医大学药学院药物分析与分析化学教研室,重庆 400038)
胍丁胺是精氨酸脱羧基生成的内源性代谢产物,广泛存在于植物、细菌及哺乳类动物的各种组织中。研究表明,胍丁胺生物学作用丰富,内源性胍丁胺及其相应的受体在中枢神经系统内构成了阿片功能的调节系统[1];外源性胍丁胺的初步药理学研究证明,胍丁胺能增强吗啡镇痛[2],降低其成瘾性及抗耐受作用[3-4],而且抗抑郁[5-6]和抗焦虑[7]作用明显,具有良好的研究及应用前景[8]。胍丁胺极性强、相对分子质量小,其结构中无紫外和荧光吸收基团,难以气化,且内源性胍丁胺含量低,生物样品中干扰成分较多,一般方法难以检测[9],因此,对胍丁胺的定量测定成为研究胍丁胺生物学作用亟待解决的重要问题。近年来,通过衍生化作用改变胍丁胺的极性,增大其在色谱柱上的保留,并增大分析物的相对分子质量,使之与内源性小分子杂质分离[10],实现内源性胍丁胺的定量测定。胍丁胺的柱前衍生定量分析方法主要有柱前衍生化高效液相色谱法(HPLC)、柱前衍生化气相色谱法、柱前衍生化色谱-质谱联用技术等,这些方法各具特点,因而适用范围各不相同。目前,常用的衍生化试剂包括邻苯二甲醛(OPA)类,该试剂与胍丁胺衍生需要巯基试剂的参与,常用的巯基试剂包括巯基乙醇(ME)[11]、巯基丙酸(3-MPA)[12]、N-乙酰-L-半胱氨酸(NAC)[13],以及2,3-萘二甲醛(NDA)[14]、4-氟-7-硝基-2,1,3-苯并氧杂噁二唑(NBD-F)[15]、氯甲酸-9-芴基甲酯(FMOC-Cl)[16]、乙酰丙酮(AA)类[如三氟乙酰丙酮(TFAA)、六氟乙酰丙酮(HFAA)[17]等]。本文对胍丁胺近年来常用的柱前衍生化试剂进行了总结,并对各种衍生试剂的优缺点、最佳衍生条件及检测方法做了比较全面地分析,旨在为后期测定胍丁胺的含量及生物学研究提供方法与思路。
1 OPA
OPA是目前应用最为广泛的衍生化试剂,在巯基试剂(如ME、3-MPA、NAC等)的作用下胍丁胺和OPA迅速反应生成具有较强荧光的异吲哚衍生物,见图1。该反应所需条件较温和(室温、碱性),反应迅速,样品制备简单,适用于大量生物样品的分析测定。
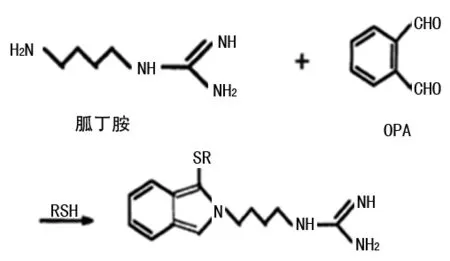
图1 胍丁胺与OPA类衍生试剂的反应方程式
1997年FENG等[11]首次利用OPA-ME作为胍丁胺柱前衍生化试剂,通过HPLC荧光检测器测定大鼠脑内及人血浆中胍丁胺的水平。文献中将50 mg的OPA溶解在1 mL甲醇中,加入53 μL的ME和9 mL的硼酸钾缓冲溶液(0.2 mol/L,pH=9.4)混匀,于4 ℃冰箱放置不超过3 d。衍生过程取15 μL的样品和15 μL的OPA-ME衍生试剂在室温条件下混合反应2 min,后立即取20 μL进样分析。该方法选择同型半胱氨酸为内标,灵敏度高,检出限为0.1 pmol/L。该方法中单一样本检测时间长(t=80 min),因此,并不适合用于常规检测。苏瑞斌等[18]利用OPA-ME柱前衍生化HPLC荧光检测法测定大鼠不同脑区及NG-108-15细胞内胍丁胺的含量。结果显示正常大鼠不同脑区和NG108-15细胞内胍丁胺的含量分别为0.80~1.71 μg/g湿脑组织、0.044 mg/g蛋白。宋滇文等[19]选择微量OPA-ME柱前衍生技术,通过荧光检测器测定大鼠脊髓组织中胍丁胺的含量,检测限可达到3.85 pmol/L。目前OPA-ME作为胺类化合物柱前衍生试剂应用广泛,但是OPA-ME在反相柱分离过程中部分衍生化合物会发生裂解,因此,必须严格控制衍生化反应的时间。
相关文献表明,OPA-3-MPA与多胺的衍生反应迅速(<5 min),且具有较高的灵敏度和准确度。MARKOWSKI等[12]使用OPA-3-MPA进行柱前衍生,通过HPLC荧光检测器(λex=338 nm,λem=455 nm)测定人体尿液中精氨酸及胍丁胺在内的12种代谢产物。方法中称取40 mg OPA溶解在0.8 mL甲醇中,加入40 μL的3-MPA和7.2 mL硼酸盐缓冲溶液(0.2 mol/L,pH=9.0)混匀,于黑暗低温中保存不超过2 d。将制备好的50 μL样品与50 μL的OPA-3-MPA衍生试剂涡旋混合,室温下精确反应2 min,立即取20 μL注入HPLC荧光测定系统中,胍丁胺的检出限为28 nmol/L,保留时间为44 min。
多胺可以与OPA和NAC反应形成相对稳定的衍生产物,即OPA-NAC-多胺。DAI等[13]采用HPLC荧光检测器,以OPA-NAC作为柱前衍生化试剂,测定猪肝脏、空肠、回肠等组织中的胍丁胺含量。试验中称取50 mg OPA和50 mg NAC溶解于1.25 mL甲醇中,加入40 mmol/L硼酸钠缓冲液(pH 9.5)11.2 mL和0.4 mL Brij@-35,轻轻混匀。该衍生试剂须在HPLC分析当天新鲜配制,并避光储存在4 ℃,24 h内使用。此方法特异性强,不受氨基酸的干扰,胍丁胺的保留时间约为9 min,检测限为0.5 nmol/mL或0.1 nmol/mg生物样品组织,且衍生化溶液中使用的OPA对HPLC系统没有不利影响。据文献报道,与含有氨基或胺基的物质发生快速衍生化反应最佳的OPA浓度为1.95 mg/mL或14.5 mmol/L。OPA-NAC衍生化反应具有简单、快速、灵敏、重现型好等特点,可用于在线自动化柱前衍生,消除了手工操作中的错误,从而缩短反应产物形成到荧光检测之间的时间间隔,适合各种不同特性的生物样品和小体积/小量的衍生化反应,适用于农业和生物医学领域研究多胺的精确分析[20]。
2 NDA
NDA与胍丁胺在氰化物存在下反应简单快速,且衍生产物非常稳定,见图2。ROBERTS等[14]利用NDA柱前衍生HPLC荧光法测定小鼠脊髓给予胍丁胺后的药效学和药代动力学研究,实验中将组织提取物真空浓缩并悬浮于100 μL pH=9.4的硼酸盐缓冲液中;加入NaCN(40 μL,0.025 mol/L),然后加入甲醇配制的萘二甲醛(100 μL,0.05 mol/L),在室温下反应20 min,取5~10 μL反应混合溶液进样。CHEN等[21]通过NDA柱前衍生化毛细管电泳结合发光二极管诱导荧光检测(CE-LEDIF)法分离啤酒样品中的氨基酸和胺,检测到胍丁胺浓度为87.4 μmol/L。另外,ZHAO等[15]认为用NDA衍生胍丁胺其衍生产物对热稳定,且具有激光诱导荧光(LIF)检测有利的检测波长(λex=447 nm,λem=520 nm),但柱子对衍生物和过多的NDA保留极强,难以洗脱。
3 NBD-F
荧光标记试剂NBD-F用于柱前衍生化,所得到的衍生产物具有高的光稳定性和有利的最大激发波长(480 nm,接近氩离子激光发射器的激发波长488 nm),因此可用激光诱导荧光检测器(LIF)进行检测。ZHAO等[15]利用NBD-F作为柱前衍生化试剂结合LIF检测鼠脑、胃组织及人血浆中胍丁胺的含量反应方程见图3,检出限为5 nmol/L,检测时间<10 min。研究中指出,NBD-F与胍丁胺的衍生化反应需在一定温度下进行,如碱性环境下(pH=8.5)、温度T=60 ℃时,反应时间为40 min。室温条件下该衍生产物存放2 h仍保持稳定,经乙酸乙酯萃取后,于4 ℃冰箱可稳定保存数月。另外,文献中提到,NBD-F的浓度直接影响衍生物产量,当NBD-F与胍丁胺的比例大于120∶1时,荧光信号最大。用NBD-F衍生胍丁胺的有效pH范围为8.3~9.5,在溶液pH>9.5时,NBD-F将会发生明显的水解反应,从而导致色谱峰拖尾严重。PAULSON等[22]采用超高效液相-电喷雾串联质谱联用技术(UPLC-ESI-MS),以NBD-F作为柱前衍生试剂测定肺囊性纤维化患者痰样本中胍丁胺的含量,其检测限为40 nmol/L。总之,NBD-F衍生胍丁胺反应稳定,且荧光强度适宜,灵敏度高,可用于精确定性定量分析。但是由于该方法需要LIF或质谱联用技术进行检测,一般实验室无法普及。
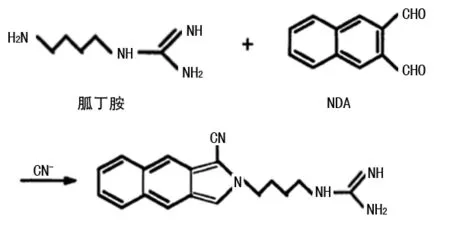
图2 胍丁胺与NDA类衍生试剂的反应方程式
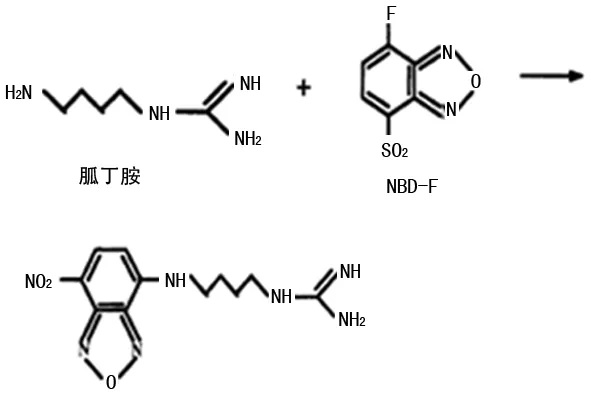
图3 胍丁胺与NBD-F的反应方程式
4 FMOC-Cl
FMOC-Cl能与伯胺、仲胺在介质pH 8.5~9.5发生反应,该衍生过程速度快、产物稳定、荧光强度高、灵敏度高,是一种较为理想的氨基酸定量分析的柱前衍生化试剂。BAUZA等[16]利用FMOC-Cl柱前衍生HPLC法测定白葡萄酒中5种氨基酸和8种胺类物质的含量,在20 μL白葡萄酒样品中加入50 μL缓冲溶液(pH=8.5)和100 μL FMOC试剂(8 mg FMOC/1 mL ACN)反应3 min后,加入300 μL淬灭剂(乙腈-乙酸-水,比例为20∶2∶3)。该方法检测得到胍丁胺的含量为4.1 mg/L。然而,FMOC衍生有一个众所周知的缺点,即宽试剂峰[FMOC-Cl和(或)FMOC-OH]的干扰效应。为了消除宽试剂峰的干扰,KIRSCHBAUM等[23]对衍生试剂用量、淬灭试剂最佳需要量及定量反应的最佳时间进行优化。结果表明,衍生过程中高浓度的FMOC-Cl衍生试剂和过量的淬灭试剂没有办法定量消除,氨基酸与FMOC-Cl的最佳反应时间为3 min,而对于具有较低反应速率的胺最佳反应时间为5 min。
5 AA
胍丁胺由于结构中没有吸收基团,难以气化,较难检测。丘忠丽等[17]以HFAA作为胍丁胺的衍生试剂,采用同位素稀释-气相色谱-质谱法检测大鼠血浆中的内源性胍丁胺,检出限为0.005 7 ng/mL。与同类衍生试剂AA、TFAA相比,HFAA衍生胍丁胺产率更高,且衍生产物最稳定、挥发度高(气化温度降低),从而促进了胍丁胺在气相色谱(GC)上获得较好的分离和检测。DOUGLAS等[24]利用该反应产物成环具有高度挥发性和良好的电捕获能力,通过负化学电离质谱(GC-NCI-MS)检测鼠脑组织中的胍丁胺,保留时间为2 min,检出限为25 fmol/L。但是该方法样品前处理较为复杂,需经过2次液液萃取。另外,阮志鹏[25]应用HFAA作衍生试剂,乙酸乙酯作催化剂,通过气相色谱氮磷检测器(GC-NPD)分析大鼠血浆中的胍丁胺浓度,其最低检测浓度为0.1 μg/mL,可用于胍丁胺的血药浓度分析及药代动力学研究。
6 小 结
随着内源性胍丁胺的生物学作用日益被广泛关注,以及外源性胍丁胺可能具有良好的新药开发前景和价值,胍丁胺衍生化高特异度与灵敏度的定量检测方法的建立成为众多研究者关注的重点。分析发现,各衍生试剂与胍丁胺反应的条件不同,生成的化合物稳定性、荧光强度亦有明显差异,笔者总结了几种常用的衍生试剂与胍丁胺发生衍生反应的条件,见表1。

表1 不同衍生试剂与胍丁胺衍生的条件
注:-表示无此项
目前,柱前衍生化色谱/质谱技术广泛应用于样品中胍丁胺的检测,常用衍生试剂包括OPA、NDA、NBD-F、FMOC-Cl等。OPA类衍生试剂与胍丁胺反应快速、简单,过量的衍生试剂对检测不产生干扰,衍生产物具有高度荧光。但是该类衍生试剂不与次级氨基酸发生反应;衍生试剂不稳定,通常只能保存1~2 d,临用时须新鲜配制;衍生产物稳定性相对较差,限制了样品预处理程序的使用,如样品清洁和预浓缩。NDA与伯胺在氰化物存在下反应简单快速,且衍生产物非常稳定,但柱子对衍生物和过多的NDA保留极强,难以洗脱。NBD-F与胍丁胺反应衍生产物较单一,杂质干扰少,具有极佳的光稳定性。当溶液pH>9.5时,NBD-F将会发生明显的水解反应,导致色谱峰严重拖尾,所以需严格控制溶液的pH。FMOC-Cl能与伯胺和仲胺发生快速反应,衍生产物稳定,荧光强度高,灵敏度高。然而,FMOC-Cl不仅和氨基酸会发生多重衍生反应,而且易形成宽试剂峰干扰氨基酸分离,衍生过程中高浓度的FMOC-Cl和过量的淬灭试剂较难定量消除。HFAA与胍丁胺反应衍生物产率高、易挥发且稳定,但反应条件苛刻,需要较高温度和较长时间。在实际胍丁胺测定过程中选择衍生试剂需要根据自身试验需要,综合考虑衍生试剂是否容易获得、稳定性、衍生反应的快慢以及衍生产物的稳定性、灵敏度、检测限等。只有充分了解这些衍生试剂的特点,才能做出正确的选择,从而获得理想的测定结果。

