蜻蜓凤梨 AfACO1基因的克隆及乙烯响应特性分析
雷 明,王加宾,李志英,徐 立
(1.中国热带农业科学院 热带作物品种资源研究所,海南儋州 571700;2.农业部华南作物基因资源与种质创制重点实验室,海南儋州 571700;3.海南省热带作物种质资源遗传改良与创新重点实验室,海南儋州 571700;4.国家种质资源热带作物中期保存库,海南儋州 571700)
凤梨科(Bromeliaceae)植物包括58个属3 248个种,形态多样,广泛分布于热带亚热带地区[1-2]。人工栽培的凤梨可以分为2大类,一类是食用凤梨,即菠萝(Ananascomosus),一类是观赏凤梨。观赏凤梨形态多样、花期持久,虽然自20世纪90年代中期传入中国到现在不过30来年的时间,但市场发展迅速,已成为仅次于兰花和红掌的第3大热带花卉。
乙烯是一种重要的植物激素,参与种子萌发、幼苗生长、开花诱导、果实成熟、器官衰老和病原菌响应等诸多过程[3-4]。乙烯生物合成起始于S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)。从SAM合成乙烯需要2个关键的限速酶[5-6]。首先,在1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid synthase,ACC)合成酶(ACC synthase,ACS)的作用下,SAM被催化成ACC。其次,在ACC氧化酶(ACC oxidase,ACO)的作用下,ACC被催化成乙烯。通常植物内源乙烯一直维持在较低的水平,但生长发育阶段及胁迫处理会使其表达迅速上调,而在这个过程中,ACO至关重要[7-9]。ACO属于2OG-加氧酶超家族,该家族的酶利用非血红素Fe2+为辅因子,将分子氧整合进其他生物分子中。该家族的诸多成员具有一个高度保守的Fe2+结合基序,该基序由2个组氨酸和1个酸性氨基酸残基(Glu/Asp)组成[10-12]。ACO的反应底物为抗坏血酸,且需要CO2为激活因子[13]。
施加外源乙烯或乙烯衍生物(如乙烯利、乙炔等)可以促进凤梨科植物开花。利用14C 标记的乙烯利处理菠萝,4 h时,30%的乙烯利进入叶片,24 h时,60%的乙烯利进入叶片[14]。施用内源乙烯合成抑制剂aminoethoxyvinylglycine(AVG)能够延迟菠萝的自然开花时间,且乙烯诱导开花的时间也延长了[15-17]。因此,乙烯诱导凤梨科植物开花主要是外源乙烯引起内源乙烯含量增加所致。但到目前为止,鲜有关于凤梨科植物内源乙烯合成关键酶ACO编码基因的克隆和功能鉴定的报道。
蜻蜓凤梨(Aechmeafasciata)是一种广泛栽培的观赏凤梨品种。本研究首次从蜻蜓凤梨中克隆了ACO家族编码基因AfACO1,利用生物信息学技术对其编码的蛋白进行结构分析,验证其转录本的组织表达特异性,并研究其响应外源乙烯处理的表达模式。为进一步解析AfACO1在内源乙烯合成中的作用以及通过基因工程手段调控凤梨科植物开花提供理论依据。
1 材料与方法
1.1 材料与处理
蜻蜓凤梨取自中国热带农业科学院热带作物品种资源研究所离体保存与繁育研究室大棚(30~32 ℃)。幼株和成株分别为试管苗移栽成活后株龄6个月和11~14个月的植株。外源乙烯利处理时,分别取20 mL 不同试验质量浓度(0.3、0.6、1.2、2.4、4.8 g/L)的乙烯利灌心处理1、2、4、8、24、48 h,以清水灌心的材料为对照。不同组织材料在处理后迅速于液氮中冷冻,置于-80 ℃保存,备用。
1.2 总RNA提取及cDNA第1条链的合成
采用改良的CTAB法提取蜻蜓凤梨总RNA。cDNA第1条链的合成采用TranScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(Transgene),具体过程按照试剂盒说明书进行。
1.3 5′和3′ RACE
首先参照SMARTerTMRACE cDNA Amplification Kit(Clontech)的说明书合成5′和3′ RACE模板。根据已有的414 bp的序列,分别设计了5′和3′特异引物进行全长cDNA的扩增。其中,5′的外侧引物GSP51和内侧引物GSP52以及3′的外侧引物GSP31和内侧引物GSP32的序列见表1。采用OMEGA(Omega)的胶回收试剂盒纯化PCR条带。纯化后的特异条带分别连接到pEASY-blunt克隆载体上,测序。测序后的条带与转录组序列拼接后再做进一步验证分析。
1.4 生物信息学分析
利用NCBI网站的ORF Finder在线软件(http://www.ncbi.nlm.nih.gov/projects/gorf/)进行开放阅读框的预测分析;利用DNAMAN 6.0软件进行氨基酸序列的同源性比对;利用MEGA 6.0软件和邻接法进行进化树构建;利用ProtParam在线软件(http://web.expasy.org/protparam/)分析蛋白质相对分子质量和等电点;利用MEME在线软件(http://meme-suite.org/tools/meme)分析蛋白质的保守基序;利用Gene Structure Display Server 2.0 (http://gsds.cbi.pku.edu.cn/index.php)绘制基因结构示意图。
1.5 总DNA的提取及 AfACO1基因组序列的克隆
采用改良的CTAB法提取蜻蜓凤梨的总DNA。依据AfACO1的CDS序列设计引物(AfACO1CDS F和AfACO1CDS R)以DNA为模板扩增AfACO1的基因组序列。具体引物序列参见表1。
1.6 实时荧光定量PCR(quantitative real time PCR,qPCR)
PCR反应选用TransStart Tip Green qPCR SuperMix(Transgene)在Therma PikoReal 96TM荧光定量PCR仪(Thermo Fisher Scientific)上进行。反应体系(10 μL):qPCR混合反应液SuperMix 5 μL,模板1 μL,正反向引物各0.3 μL,灭菌的去离子水补齐至10 μL;反应程序:95 ℃预变性7 min,然后在95 ℃ 5 s、60 ℃ 30 s的条件下扩增40个循环,循环结束后65 ℃ 30 s,20 ℃停止。每个样品2个生物学重复,3次技术重复。以蜻蜓凤梨的β-actin(AfACTB)为内参采用双delta法分析数据。目的基因和内参基因的扩增效率通过制作标准曲线获得。所有引物序列见表1。
2 结果与分析
2.1 AfACO1 cDNA全长的克隆与序列分析
转录组数据获得1个与拟南芥ACO基因同源的片段。基于此,设计了RACE扩增引物,分别扩增得到了该基因的5′端序列和3′端序列(图1-A和B)。在此基础上,成功克隆了AfACO1cDNA 732 bp的全长(图1-C)。分析后发现,其含有1个63 bp的5′非编码区(5′ untrascriptional region,5′-UTR),1个198 bp的3′-UTR,以及1个471 bp的开放阅读框(open reading frame,ORF),编码156个氨基酸残基。
基于AfACO1的ORF序列,笔者从蜻蜓凤梨的DNA中克隆了AfACO1基因的全长,并对其基因结构进行分析,结果显示,不同于拟南芥的5个ACOs基因和水稻中的2个ACO1-likes基因序列结构,AfACO1基因由2个外显子和1个内含子组成(图2)。基因结构的差异暗示AfACO1可能具有某些功能上的差异性。
2.2 AfACO1蛋白的同源性和进化树分析
ProtParam在线软件计算结果显示,AfACO1蛋白相对分子质量为17.47 ku,等电点为8.46。为了探究AfACO1与其他物种中ACOs蛋白的进化关系,用邻接法(the neighbor-joining method,NJ method)构建进化树。结果表明,AfACO1与水稻(Oryzasativaspp.japonicacv.Nipponbare)中的2个OsACO1-like蛋白亲缘关系最近,暗示它们在功能上可能具有一定的保守性(图3)。
基于进化树分析结果,进一步对AfACO1蛋白的序列进行同源性比对。结果显示,AfACO1具有ACO的典型结构特征,即分别有辅因子亚铁离子结合位点(His-Xaa-Asp-Asp-Xaa-His)以及ACO家族蛋白辅助底物抗坏血酸结合位点(Arg-Xaa-Ser)(图4),暗示AfACO1可能是蜻蜓凤梨中功能ACO。

表1 本研究所用的引物Table 1 Primers used in this study

A.RACE PCR扩增 AfACO1 cDNA的5′端序列 RACE PCR amplification of 5′ fragments of AfACO1 cDNA;B.RACE PCR扩增 AfACO1 cDNA的3′端序列 RACE PCR amplification of 3′ fragments of AfACO1 cDNA;C.PCR扩增 AfACO1 cDNA的全长 PCR amplification of full length of AfACO1 cDNA;M.DL2000 marker
为了进一步探究AfACO1可能的功能,利用MEME在线软件对其全序列中的保守基序进行解析。由图5可知,相对于拟南芥的5个ACOs的8或9个基序数量来说,AfACO1的保守基序较少,只有4个,且这4个基序的序列更类似于水稻中的2个ACO1-likes的保守基序。
2.3 AfACO1在蜻蜓凤梨中的表达特性
为了研究AfACO1在蜻蜓凤梨各组织中的表达特性,提取了蜻蜓凤梨幼株、成株和抽薹39 d后的成株的外叶、心叶、茎和根的RNA,反转录成cDNA,并以此为模板进行qPCR检测。AfACO1的转录本在抽薹39 d后的成株的心叶和根中有显著高的表达,而在各个生长时期的茎中表达量一直较低(图6-A)。此外,还检测了AfACO1在抽薹39 d后的成株的各生殖器官中的相对表达量,发现除了心皮外,其他各组织中AfACO1的表达量均很低(图6-B)。
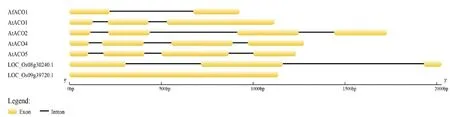
黄色矩形代表外显子,黑色实线代表内含子 Yellow rectangles and black solid lines indicate exons and introns, respectively; AfACO1.蜻蜓凤梨 ACO1 ACO1 of Aechemia fasciata; AtACO1.拟南芥 ACO1 ACO1 of Arabidopsis thaliana; AtACO2 .拟南芥 ACO2 ACO2 of Arabidopsis thaliana; AtACO4 .拟南芥 ACO4 ACO4 of Arabidopsis thaliana; AtACO5.拟南芥 ACO 5 ACO5 of Arabidopsis thaliana;LOC_Os08g30240.1.水稻的ACO1-like ACO1-like of Oryza sativa spp. japonica cv.Nipponbare;LOC_Os09g39720.1.水稻的ACO1-like ACO1-like of Oryza sativa spp. japonica cv.Nipponbare
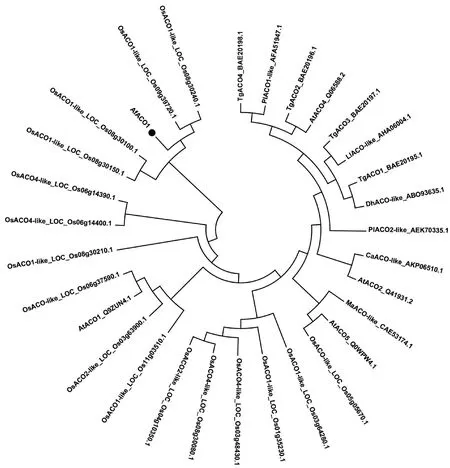
图3 AfACO1分子的进化树构建Fig.3 Phylogenetic analysis of AfACO1 and ACO proteins of other species

红色矩形处为亚铁离子结合位点,蓝色椭圆处为抗坏血酸结合位点 Red rectangles indicate the binding site of Fe2+, and the blue oval indicates the binding site of ascorbic acid

不同颜色的矩形代表不同的基序 The color boxes represent different putative motifs

A. AfACO1在蜻蜓凤梨幼株、成株和抽薹39 d后的成株(39-day-after-flowering(DAF) adult plants)各组织中的相对表达量 Relative expression of AfACO1 in variable tissues of juvenile plants, adult plants before flowering, and 39-day-after-flowering(DAF) adult plants;B. AfACO1在抽薹39 d后的成株营养器官和生殖器官中的相对表达量 Relative expression of AfACO1 in vegetative and reproductive organs of 39 day adult plants
2.4 AfACO1对外源乙烯处理的响应特性
外源乙烯可通过启动内源乙烯合成来促进凤梨科植物开花。为了检测AfACO1是否是内源乙烯合成的关键酶,通过施加不同质量浓度的外源乙烯利后,检测蜻蜓凤梨成株心叶中AfACO1转录本的相对表达量变化。由图7可知,AfACO1的表达在乙烯利处理的4 h内几乎无变化,但是随后显著受乙烯利诱导,表达量持续上升。有意思的是,AfACO1的表达似乎不受外源乙烯利质量浓度的影响。
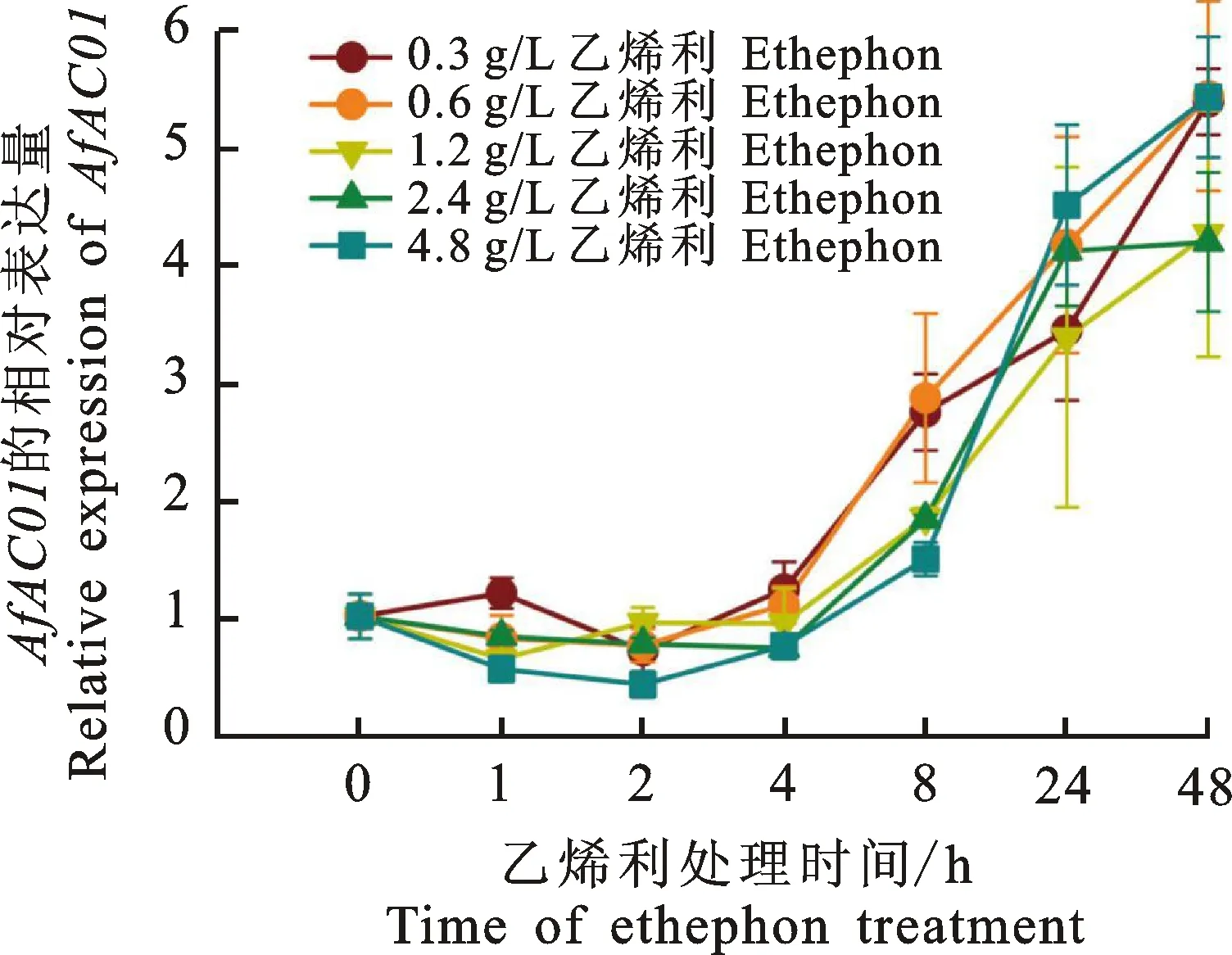
图7 施加不同质量浓度乙烯利后蜻蜓凤梨成株心叶中 AfACO1的相对表达量Fig.7 Relative expression of AfACO1 in central leaves of Aechmea fasciata adult plants treated with exogenous ethephon
3 讨 论
作为一种气态激素,乙烯调控植物生长发育的诸多方面,包括开花[18-19]。乙烯可以通过赤霉素途径增加DELLA蛋白的累积,从而抑制拟南芥开花[18]。与对拟南芥的作用相反,外源乙烯可以促进凤梨科植物开花。到目前为止,已挖掘到部分响应乙烯或乙烯信号通路调控凤梨科植物开花的基因[20-21]。此外,沉默乙烯合成途径中的一个限速酶ACACS2后,菠萝开花显著延迟[22]。
ACO是乙烯合成途径中的最后一个酶,也是除了ACS外的另一个限速酶,对底物有高度的专一性。1985年,调控番茄果实成熟的基因pTOM13被克隆,并最终在1991年被鉴定为乙烯形成酶(Ethylene-forming enzyme,EFE)基因,即ACO,这也是第一个被克隆的ACO基因[23-26]。目前,除番茄外,ACO基因已经在拟南芥、苹果、甜瓜、黄瓜、桃、油棕等多种植物中被克隆[27-32],但尚未见凤梨科植物中ACO基因克隆和功能鉴定的报道。
本研究首次从蜻蜓凤梨中克隆了一个ACO基因,并将其命名为AfACO1。相对而言,AfACO1的基因序列长度较短(图2),且只有一个内含子,结构与拟南芥中的ACOs均不一样(图2)。但是AfACO1的蛋白序列中有高度保守的Fe2+离子结合位点以及抗坏血酸结合位点(图4)。晶体结构解析结果证实,这2个位点是ACO利用抗坏血酸为底物、CO2为激活子、Fe2+为辅因子来合成乙烯的关键结构[33-37]。此外,结构域分析结果发现,AfACO1具有与拟南芥和水稻的ACOs类似的保守基序(图5)。这些结果表明,AfACO1可能是个功能性的ACO,在乙烯合成过程中起重要作用。
ACOs是家族基因,例如,番茄中有6个ACOs[38],黄瓜中发现了 5个ACOs[31, 39],苹果中有3个ACOs[30]。不同物种或同一物种的不同ACOs的时空表达模式不尽相同。番茄的LeACO1主要在花的翼瓣和柱头表达,LeACO2只在花药中表达,LeACO3则是除了萼片外,在其他花组织中均表达。此外,在果实成熟期,LeACO1的表达显著升高;LeACO3的表达则在果实跃变期,而LeACO4则在整个果实成熟期均表达[40]。为了更好地探究AfACO1可能的功能,笔者检测了其在蜻蜓凤梨生长发育各个阶段的各营养器官和生殖器官中的转录本表达量。AfACO1在幼株和开花前的成株大部分器官中的表达模式类似,即在外叶中的表达量相对较高,而在心叶和茎中表达量很低或检测不到其表达(图6-A)。但在抽薹39 d的成株中,AfACO1的表达量在茎中升高了,而在心叶中则显著上升,甚至远远高于各生长阶段外叶中的表达量(图6-A)。这种在花发育时期的营养器官中的高表达模式暗示,AfACO1可能是生殖生长阶段乙烯合成的关键酶。
ACO基因的表达也受乙烯、脱落酸等激素以及非生物胁迫的诱导。例如,脱落酸处理可以诱导番茄LeACO1的表达[41],水杨酸能显著下调桃果实中PpACO1的表达,显著上调PpACO2的表达[28],而生长素能完全抑制乙烯诱导后的水稻OsACO3的表达[42]。自20世纪30年代以来,利用乙烯或乙烯衍生物促进凤梨科植物开花就已经成为生产者普遍采用的措施。研究表明,施加外源乙烯促进内源乙烯的合成,进而促进凤梨科植物开花[14-17]。为了探究AfACO1对外源乙烯处理的响应,笔者使用不同质量浓度的乙烯利对蜻蜓凤梨成株进行灌心处理。由图7可知,在外源乙烯利处理的4 h内,AfACO1的表达几乎没有变化。前期笔者曾发现,乙烯下游的一个调控开花的基因AfAP2-1可以在外源乙烯处理的1 h即迅速下调[20]。这表明,除了AfACO1外,蜻蜓凤梨中可能还存在其他的ACO同源基因可以迅速响应外源乙烯利的处理,促进内源乙烯的合成,进而通过乙烯信号通路调控下游开花相关基因的表达。
从外源乙烯利处理8 h开始,AfACO1的表达逐渐上调,表明AfACO1在乙烯后期的合成中发挥着重要作用。更有趣的是,不同质量浓度的乙烯利处理后,AfACO1的表达模式均很相似,且同一时间点的相对表达量也近乎相同(图7),表明一次性施加20 mL 0.3 g/L的外源乙烯利,已经达到诱导AfACO1表达的阈值,更高质量浓度的乙烯利处理并不能通过提高AfACO1的表达来促进内源乙烯的合成。
尽管乙烯促进凤梨科植物开花显而易见,但分子机制远未阐明。ACO是调控内源乙烯合成的家族基因,因此,克隆更多的蜻蜓凤梨ACO基因,研究它们的时空表达模式以及编码蛋白酶的生物学功能,结合基因工程手段最终探究ACO在乙烯诱导凤梨科植物开花中的作用,将是今后研究的重要方向之一。

