饥饿胁迫对彭泽鲫幼鱼生长、体组成、消化酶活性及抗氧化性的影响
丁立云,陈文静,饶 毅,张桂芳,傅义龙,张爱芳
(江西省水产科学研究所,江西 南昌 330039)
饥饿是水生动物在自然水域生态系统中经常面临的一种生理胁迫现象,也是影响水生动物生存、生长和正常发育的一个重要环境因子。当饥饿胁迫发生时,鱼类会相应调整生理生化代谢及活动行为,降低消耗,节约存储的能量,来适应这种生理胁迫[1]。饥饿可以影响鱼类的生长、存活、繁殖、活动行为和肌体营养成分等,还可以影响鱼类的消化酶活性、血液生化指标、免疫指标和抗氧化酶活性等。严重时可引起水生动物的神经内分泌功能紊乱,导致细胞坏死,诱发各种疾病,最终导致水生动物的大面积死亡,给渔民造成重大的经济损失[2-3]。不同种类鱼体对饥饿胁迫的耐受能力不同,相应的生理生态响应机制也存在一定差别。因此,开展鱼类的饥饿胁迫研究有着重要的理论和应用价值。
彭泽鲫(Carassiusauratusvar.Pengze)隶属鲤形目、鲤科、鲤亚科、鲫属,为鲫鱼的一个品种。彭泽鲫是江西省水产科学研究所和九江市水产科学研究所从野生鲫鱼中,经过7 a 6代的选育而获得的一个优良养殖品种,1989年通过农业部的鉴定和命名。它具有生长速度快、性情温顺、耐低氧、抗病力强、适应性广、不易脱鳞、肉味鲜嫩、营养价值高等优良性状[4],已成为我国重要的鲫鱼养殖品种之一。在人工饲养条件下,有时会出现饲养密度过大、投饲不均、投喂不及时等情况,均会造成彭泽鲫的饥饿现象,尤其是在冬季野外活饵不足的情况下。基于此,本研究探讨了饥饿对彭泽鲫幼鱼生长、体组成、消化酶活性等方面的影响,旨在丰富彭泽鲫生理学的基础指标,为其健康养殖提供理论依据。
1 材料和方法
1.1 供试动物及日粮饲喂
试验用彭泽鲫由江西省水产科学研究所育种室提供,于正式试验前在循环水系统中驯养14 d,投喂鲫鱼商品鱼料,投喂量为鱼体质量的2%~4%,每日投喂2次,饱食投喂。试验设置饥饿时间分别为0(对照组)、14、28 d共3个组,每组设置3个重复,以重复组为单位养殖于9个圆形养殖桶(规格为¢800 mm×650 mm)内,每桶放养健康无病、规格与体质量基本一致的彭泽鲫幼鱼20尾,初始体质量为(14.35±0.59)g。
1.2 饲养管理
饥饿试验开始后,每天吸污1次,以确保水质清洁。除此之外,整个试验期间对水质情况进行严格监测,保持水温(26±1.5)℃,溶解氧浓度不低于7 mg/L,pH值7.53±0.12,氨氮和亚硝酸盐质量浓度不高于0.1 mg/L。光周期为自然周期。
1.3 样品采集与分析
分别在饥饿时间为0、14、28 d时采集样本,每个平行采集5尾,经麻醉剂MS-222麻醉后分别称体质量,随机选取其中3尾进行鱼尾静脉取血,4 ℃静置24 h后离心取血清,然后冰上解剖分离肠道、肝脏等样品。剩余2尾鱼用于全鱼常规营养成分的测定。试验中所有样品于-80 ℃冰箱保存待测。
1.3.1 全鱼营养成分测定 全鱼水分、粗脂肪、粗蛋白和灰分含量分别采用恒温干燥法(105 ℃)、索氏抽提法、凯氏定氮法和灼烧法(550 ℃)进行测定。
1.3.2 消化酶活性测定 用预冷的生理盐水(4 ℃)清洗肠道,剔除脂肪、肠系膜,用滤纸吸干后,准确称取肠道组织质量,按质量(g)∶体积(mL)=1∶9的比例,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,2 500 r/min离心10 min,取上清再用生理盐水进行5倍稀释,然后于4 ℃条件下保存待用。所有消化酶活性均采用南京建成生物工程研究所生产试剂盒进行测定,其中胃蛋白酶活性定义为:每毫克组织蛋白在37 ℃每分钟分解蛋白质生成1 μg氨基酸相当于1个酶活性单位(U);胰蛋白酶活性定义为:在pH值8.0、37 ℃条件下,每毫克蛋白质中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活性单位(U);脂肪酶活性单位定义为:在37 ℃条件下,每克组织蛋白与底物反应1 min,每消耗1 μmol底物为一个酶活性单位(U);淀粉酶活性单位定义为:组织中每毫克蛋白质在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活性单位(U)。
1.3.3 肝脏抗氧化性及糖原含量测定 准确称取肝脏组织,方法同1.3.2,按质量体积比1∶9在冰水浴条件下用机械匀浆机制成10%组织匀浆,2 500 r/min离心10 min,取上清再用生理盐水进行10倍稀释,然后于4 ℃条件下保存待用。肝脏抗氧化酶活性以及丙二醛(MDA)含量均采用南京建成生物工程研究所生产试剂盒进行测定,其中总抗氧化能力(T-AOC)定义为:在37 ℃时,每分钟每毫克组织蛋白,使反应体系的吸光度值每增加0.01时,为1个总抗氧化能力单位;超氧化物歧化酶(SOD)活性定义为:每毫克组织蛋白在1 mL反应液中自氧化速率抑制达50%时所对应的超氧化物歧化酶量为活性个超氧化物歧化酶活性单位(U)。
肝脏糖原(Gly)含量采用南京建成生物工程研究所生产试剂盒进行检测,取肝脏样品用生理盐水漂洗后,滤纸吸干,称质量,按样品质量(mg)∶碱液体积(μL)=1∶3,一起加入试管中,沸水浴煮20 min,流水冷却,然后按试剂盒的操作说明加入一定比例的双蒸水制成糖原检测液,用蒽酮试剂显色。
1.4 数据处理
试验所得数据用SPSS 17.0统计软件进行单因素方差分析,差异达到显著(P<0.05)时,采用Turkey氏法进行组间的多重比较。试验结果以平均值±标准误表示。
2 结果与分析
2.1 饥饿胁迫对彭泽鲫幼鱼生长的影响
由图1可知,与对照组相比,随着饥饿胁迫时间的延长,彭泽鲫幼鱼的体质量逐渐下降。在饥饿胁迫14 d时,饥饿胁迫对彭泽鲫幼鱼体质量影响较小(P>0.05);当饥饿胁迫28 d时,彭泽鲫幼鱼的体质量比对照组降低了18.12%(P<0.05)。
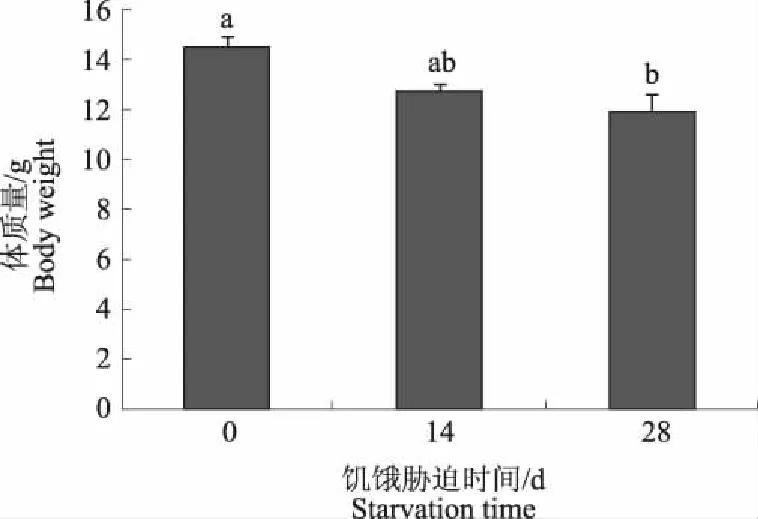
不同小写字母表示差异显著(P<0.05) Different letters in the figure show significant differences图1 饥饿胁迫对彭泽鲫幼鱼体质量的影响Fig.1 Effect of starvation on body weight of Carassius auratus var.Pengze
2.2 饥饿胁迫对彭泽鲫幼鱼全鱼营养成分的影响
由表1可知,彭泽鲫幼鱼全鱼粗脂肪含量随饥饿胁迫时间的延长急剧下降,饥饿胁迫14 d和28 d比对照组分别降低了23.57%和39.16%(P<0.05);粗蛋白含量随饥饿胁迫时间的延长,先急剧下降后缓慢下降,饥饿胁迫14 d和28 d比对照组分别降低了5.64%和9.47%(P<0.05);全鱼水分和灰分含量呈显著增加的趋势,饥饿胁迫28 d时比对照组分别提高了4.77%和28.64%(P<0.05)。

表1 饥饿胁迫对彭泽鲫幼鱼全鱼营养成分的影响 Tab.1 Effect of starvation on nutrition composition of Carassius auratus var.Pengze
注:同列数据肩注不同小写字母表示差异显著(P<0.05),下同。
Notes:Different letters within the same column donate significant difference (P<0.05),the same as following tables.
2.3 饥饿胁迫对彭泽鲫幼鱼消化酶活性的影响
由表2可知,随着饥饿胁迫时间的延长,彭泽鲫幼鱼胃蛋白酶活性显著下降,饥饿胁迫14 d和28 d比对照组分别降低了38.65%和41.83%(P<0.05);胰蛋白酶活性也呈下降的趋势,但各组无显著性差异;脂肪酶活性和淀粉酶活性随饥饿胁迫时间的延长,先平稳后急剧下降,饥饿胁迫28 d时比对照组分别降低了18.84%和58.92%(P<0.05)。

表2 饥饿胁迫对彭泽鲫幼鱼消化酶活性的影响Tab.2 Effects of starvation on digestive enzyme activity of Carassius auratus var.Pengze U/mg
2.4 饥饿胁迫对彭泽鲫幼鱼抗氧化性和糖原含量的影响
由表3可知,随着饥饿胁迫时间的延长,肝脏超氧化物歧化酶活性呈先降低后升高的趋势,饥饿胁迫14 d时,超氧化物歧化酶活性显著低于其余2个组;彭泽鲫幼鱼肝脏总抗氧化能力呈显著下降的趋势,饥饿胁迫14 d和28 d时,总抗氧化能力比对照组分别降低了49.67%和44.08%(P<0.05);丙二醛在整个饥饿胁迫过程无显著性变化;肝脏糖原含量随饥饿胁迫时间的延长,先急剧下降后缓慢升高,饥饿胁迫14 d和28 d时比对照组分别降低了26.90%和18.84%(P<0.05)。

表3 饥饿胁迫对彭泽鲫幼鱼抗氧化性和糖原含量的影响Tab.3 Effects of starvation on antioxidant enzyme activities and glycogen contents of Carassius auratus var.Pengze
3 结论与讨论
3.1 饥饿胁迫对彭泽鲫幼鱼生长和体组成的影响
在自然界中,由于季节的更替、水生态环境的变化以及投喂技术的不当等因素,会造成鱼类食物缺乏,饥饿状态下的鱼类会动用自身储存的营养物质来满足机体代谢和维持生命活动[1]。本研究发现,在饥饿胁迫28 d时,彭泽鲫幼鱼体质量显著下降,与鲈鱼(Lateolabraxjaponicus)[5]、吉富罗非鱼(Oreochromisniloticus)[6]、杂交鳢(Hybridsnakehead)[7]等的相关研究结果一致。生物化学分析是常用的研究水产动物营养状况的有效方法,主要是通过分析鱼体、肌肉和肝脏等一些重要生化成分的数量动态,反映水产动物的代谢状况。鱼类在饥饿胁迫作用下代谢功能会发生变化,并利用鱼体自身贮存的脂肪、蛋白质和糖类等提供的能量[8]。本研究中,彭泽鲫幼鱼全鱼粗脂肪和粗蛋白在饥饿胁迫14 d时显著下降,粗脂肪比对照组降低了23.57%,而粗蛋白比对照组降低了5.64%,粗脂肪的降幅显著大于粗蛋白的降幅,随着饥饿时间的进一步延长,在饥饿胁迫28 d时,全鱼粗脂肪含量继续显著下降,而粗蛋白含量缓慢下降,表明彭泽鲫幼鱼在饥饿过程中可同时消耗体内的脂肪和蛋白质来维持生命活动,以动用体内的脂肪为主,与刀鲚(Coilianasus)[3]、吉富罗非鱼[6]、杂交鳢[7]和大西洋鲑(Salmosalar)[9]的研究结果相似。彭泽鲫在饥饿过程中,全鱼水分和灰分含量呈现升高的趋势,与美洲鲟(Acipensertransmontanus)[10]、真鲷(Pagrosomusmajor)[11]和石斑鱼(Epinephelusspp.)[12]的研究结果相似,全鱼水分和灰分显著增加主要是脂肪和蛋白质含量下降的结果[13]。
3.2 饥饿胁迫对彭泽鲫幼鱼消化酶活性的影响
饵料是引起水生动物消化酶活性变化的重要因素,它不仅影响鱼类体内消化酶的活性、种类及分布,而且还可影响消化酶的分泌[14]。而鱼类在缺乏饵料饥饿的状态下,必需调节自身各种酶的活性来提高体内贮存营养物质的利用效率,饥饿胁迫发生后,随着饥饿时间的延长,体内消化酶活性将呈现不同的变化趋势[15-16]。相关研究表明,奥尼罗非鱼(Oreochromisspp.)幼鱼随着饥饿时间的延长,胃蛋白酶、胰蛋白酶和脂肪酶活性显著下降,而淀粉酶活性无显著性变化[17];褐菖鲉(Sebastiscusmarmoratus)在饥饿期间脂肪酶活性总体呈缓慢下降趋势,蛋白酶、淀粉酶活性则呈先升后降的趋势[18];中华倒刺鲃(SpinibarbussinensisBleeker,1871)幼鱼随着饥饿时间的延长,胰蛋白酶和淀粉酶活性呈下降趋势,脂肪酶活性先降后升[19]。本研究发现,彭泽鲫幼鱼胃蛋白酶活性先急剧下降后缓慢下降,饥饿胁迫14 d时,胃蛋白酶活性显著低于对照组,与饥饿胁迫28 d时无显著差异;脂肪酶活性和淀粉酶活性则是在饥饿胁迫14 d时与对照组无显著差异,到饥饿胁迫28 d时显著下降。结果表明,彭泽鲫幼鱼有优先利用蛋白质的倾向,但也有可能是彭泽鲫在饥饿胁迫14 d时,优先利用蛋白质来维持机体生长,尚不需要消耗大量的能量来维持机体代谢,因此,彭泽鲫在饥饿胁迫14 d时体质量并未明显下降。在饥饿胁迫28 d时,脂肪酶和淀粉酶活性的急剧下降,表明此时彭泽鲫需要动用体内储存的脂肪和糖原来维持自身大量的能量代谢。乐可鑫等[20]研究发现,虎斑乌贼(Sepiapharaonis)幼体饥饿胁迫前后胃蛋白酶和胰蛋白酶活性相对较高,淀粉酶和脂肪酶的活性远远低于胃蛋白酶和胰蛋白酶,原因是虎斑乌贼属于肉食性动物。在本研究中,也观察到彭泽鲫幼鱼在饥饿胁迫前后淀粉酶和脂肪酶的活性远高于胃蛋白酶和胰蛋白酶,这与彭泽鲫属于杂食性动物的情况相符。
3.3 饥饿胁迫对彭泽鲫幼鱼抗氧化性和糖原含量的影响
饥饿胁迫易引起鱼体内过量活性氧的产生,导致体内自由基快速蓄积,使组织氧化受损[21]。本研究中,在饥饿胁迫14 d后,彭泽鲫幼鱼肝脏超氧化物歧化酶和总抗氧化能力均显著下降,与卵形鲳鲹(Trachinotusovatus)幼鱼[22]、罗非鱼[23]和管角螺(HemifusustubaGmelin)[24]相关的研究结果相似,推测可能是在饥饿胁迫初期,鱼类产生了大量的自由基,使得抗氧化性下降[23]。当饥饿胁迫28 d时,超氧化物歧化酶活性显著升高,原因可能是饥饿胁迫激发了鱼体内用于清除氧自由基的防御物质[24]。丙二醛在整个饥饿胁迫过程无显著变化,表明饥饿胁迫28 d时并没有对彭泽鲫幼鱼造成不可逆转的氧化损伤。

