优良梨汁发酵乳酸菌的筛选与发酵性能分析
焦媛媛,杜丽平,孙 文,魏金艳,马立娟,肖冬光
(天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457)
乳酸菌发酵食品的历史由来已久,近几年关于乳酸菌发酵水果或蔬菜饮料的研究逐渐增多,经过乳酸菌发酵不仅提高果蔬本身营养价值,延长保鲜时间、增加保健作用,还可以改善风味[1-4]。乳酸菌发酵产生乳酸及其他有机酸,这赋予了发酵底物丰富的口感和营养功效。挥发性风味物质是影响果蔬饮料质量的重要因素,风味物质主要来源于原料本身和乳酸菌发酵后产生的代谢产物,良好独特的风味使发酵食品更容易被接受[5-7]。Filannino等[8]选用植物乳杆菌接种有机石榴汁,开发出一款风味和健康功效俱佳的发酵石榴汁产品。张亚雄等[9]采用保加利亚乳杆菌和嗜热链球菌混合菌种进行单一果蔬汁及复合果蔬汁发酵。邹玉红等[10]以保加利亚乳酸杆菌和嗜热酸链球菌混菌比例1∶1发酵苹果、胡萝卜混合果汁,并对发酵饮料的生产工艺进行了研究。刘磊等[7]利用保加利亚乳杆菌和嗜热链球菌对龙眼发酵,结果显示乳酸菌发酵可显著增加龙眼果浆的总酸及挥发性风味物质,利于开发风味独特的龙眼乳酸菌饮料新产品。Yoon等[11]采用4 种乳酸菌混合发酵西红柿汁,经过72 h发酵后其pH值下降至4.1,酸度增加了0.65%。
梨含有丰富的糖、有机酸和多种维生素、钙、铁、锰、锌、氨基酸等,具有生津止渴、润燥化痰、润肠通便、降低血压、养阴清热、促进食欲、帮助消化等功效[12-13]。如今国内市场上,用于梨或其他水果发酵的菌种均以引进自国外的一些商业乳酸菌为主,对发酵材料和发酵环境的适用性差,生产的梨汁等水果发酵饮品质量参差不齐。影响发酵质量的因素包括原材料、发酵菌种、发酵条件、产品风味等,因此,选择能适应发酵条件且风味优良的菌种尤为关键[14-15]。本实验对分离自水果发酵液和其他不同来源的10 株乳酸菌进行研究,从中筛选出适应梨汁发酵条件的乳酸菌作为发酵菌株,并通过纯种发酵对发酵过程中活菌数、pH值、有机酸和挥发性成分进行检测,进一步优选出性能优良的乳酸菌作为梨汁的发酵菌株,这不仅为开发新的梨汁发酵产品提供了可能,同时也丰富了水果发酵专用菌种库。
1 材料与方法
1.1 材料、菌株与试剂
新鲜水晶梨 市购;植物乳杆菌(Lactobacillus plantarum)ZG1,分离自酸菜发酵液;植物乳杆菌ZG2,分离自苹果、梨混合发酵液;副干酪乳杆菌(Lactobacillus paracasei)BGG1,分离自苹果、梨混合发酵液;副干酪乳杆菌BGG2,分离自雪莲菌;干酪乳杆菌(Lactobacillus casei)GG2,分离自雪莲菌;干酪乳杆菌GG8,分离自白酒酒糟;戊糖片球菌(Pediococcus pentosaceus)WQ1,分离自梨、香蕉混合发酵液;戊糖片球菌WQ2,分离自木瓜发酵液;魏斯氏菌(Weissella)WS,分离自梨、香蕉混合发酵液;柠檬明串珠球菌(Leuconostoc citreum)NQ,分离自雪莲菌。菌株均由天津科技大学现代酿造实验室保藏。
MRS液体培养基:葡萄糖20 g/L,牛肉膏10 g/L,蛋白胨10 g/L,酵母提取物5 g/L,无水乙酸钠5 g/L,磷酸氢二钾2 g/L,柠檬酸氢二铵2 g/L,硫酸锰0.25 g/L,硫酸镁0.5 g/L,吐温-80 1 mL/L,pH值调整到6.2,115 ℃湿热灭菌20 min。
生理盐水:准确称量1.8 g NaCl固体,溶解于200 mL去离子水。
5 mmol/L硫酸:准确量取0.244 mL浓硫酸,加入1 L去离子水,混匀后通过0.45 μm水膜过滤。
1.2 仪器与设备
挤压式榨汁机 荷兰飞利浦单子有限公司;UV2800紫外分光光度计 上海尤尼柯仪器有限公司;Centrifuge 5430R离心机 德国艾本德有限公司;2XJD-A1270型培养箱 郑州南北仪器设备有限公司;1200高效液相色谱仪、GC7890/MS5975气相色谱-质谱仪美国安捷伦科技有限公司。
1.3 方法
1.3.1 生长曲线测定[16]
将活化好的10 株实验乳酸菌株按2%接种量分别接入灭菌的MRS液体培养基,37 ℃静置培养24 h,从0 h开始每隔2 h取样,以未接种的MRS液体培养基作为空白对照,测定样品在600 nm波长处的OD值,每个样品重复测定3 次,根据时间和OD600nm值绘制各菌株的生长曲线。
1.3.2 耐受性实验
将活化好的10 株实验乳酸菌株按2%接种量分别接种于正常的和不同糖度(15、20 °Bx和25 °Bx)、不同pH值(pH 3.0、pH 3.5和pH 4.0)或不同乳酸质量浓度(4、6、8 g/L和10 g/L)的MRS液体培养基中,置于恒温培养箱中37 ℃静置培养24~36 h后取样,观察菌株生长情况,以未接种的不同糖度、不同pH值或不同乳酸含量的MRS液体培养基作为空白对照,测定样品在600 nm波长处的OD值,每个样品重复测定3 次。将接入正常MRS液体培养基中各菌株的OD600nm值作为标准,比较各菌株在不同条件下的OD600nm值,优选出耐受性较好的菌株[17-18]。
1.3.3 梨汁发酵实验
将购买的新鲜水晶梨经盐水浸泡后清洗,并于无菌条件下进行榨汁,加入冰片糖调节梨汁糖度为20 °Bx后分装于无菌锥形瓶中密封,经巴氏灭菌后4 ℃冷藏[19]。取活化后的乳酸菌液(GG8和ZG2菌浓度分别为4.36×108CFU/mL和5.12×108CFU/mL),6 000 r/min离心10 min,弃上清液,生理盐水重复清洗2 次。按照10%的比例将2 株乳酸菌分别接种于梨汁中,30 ℃条件下发酵144 h,每24 h取样待测[20]。
1.3.4 活菌数、pH值的测定
乳酸菌计数采用平板稀释法[21]。pH值用pH计直接测定。
1.3.5 有机酸的测定
采用紫外高效液相色谱法测定有机酸含量,色谱柱为Aminex HPX-87H(300 mm×7.8 mm);流动相为5 mmol/L H2SO4溶液;流速0.6 mL/min;柱温60 ℃;紫外检测器;波长210 nm;进样量20 μL。每个待测样品重复3 次[22]。
1.3.6 挥发性成分测定
采用顶空固相微萃取结合气相色谱-质谱方法测定与分析样液中挥发性物质。取8 mL发酵液样品置于20 mL顶空瓶中,加入3 g NaCl,60 ℃水浴加热,平衡10 min,50/30 μm DVB/CAR/PDMS萃取头静态吸附50 min,热解吸5 min。气相色谱分离条件为:色谱柱HP-5;载气He;流量1.0 mL/min;分流进样,分流比20∶1;升温程序:初始45 ℃(保留2 min),3.5 ℃/min升至220 ℃(保留2 min)。质谱检测条件:电子电离源,离子源温度230 ℃,电压 70 eV,发射电流34.6 μA;界面温度280 ℃;扫描质量范围30~550 u。每个待测样品重复3 次[13,23]。
1.4 数据分析
生长曲线及活菌数、pH值的结果使用Origin Pro 8.0进行处理与分析。有机酸测定结果依据已有标样的出峰时间和标准曲线进行处理与分析。挥发性成分利用质谱全离子扫描图谱和NIST05标准谱库比对结果进行定性分析,采用气相色谱峰面积归一化法确定各组分的相对含量。
2 结果与分析
2.1 乳酸菌的生长曲线
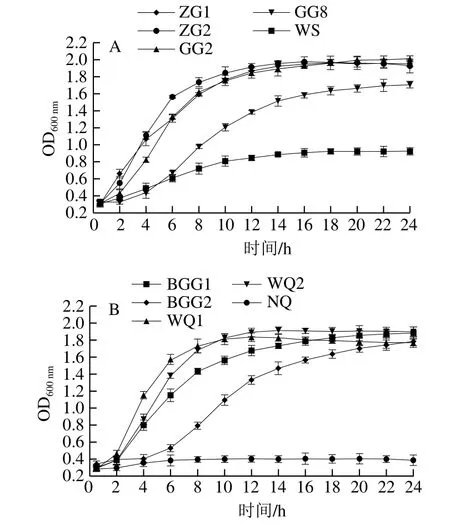
图1 不同乳酸菌的生长曲线Fig.1 Growth curves of different strains of lactic acid bacteria
如图1所示,菌株ZG1、ZG2、GG2生长速度较快,延滞期不明显,很快进入对数期,并在发酵10 h后进入稳定期;菌株GG8、BGG1、BGG2、WQ1和WQ2具有明显的延滞期、对数期和稳定期,在发酵2~4 h后进入对数期;菌株WS生长速度较慢,对数生长期短,且菌体数量较低;菌株NQ生长速度最慢,各生长期均不明显,菌体数量无明显变化。因此,菌株ZG1、ZG2、GG2、GG8、BGG1、BGG2、WQ1和WQ2生长性能良好,可对其耐受性能进一步研究。
2.2 乳酸菌耐受性筛选
梨汁发酵过程中,适当的糖含量可以促进发酵的进行,改善发酵液的口感。其次,乳酸菌在发酵代谢过程中会产生乳酸及其他有机酸,乳酸作为主要代谢产物,在发酵初期含量会迅速增加,导致发酵液pH值迅速下降[17-18],从而抑制乳酸菌生长。因此,较好的耐受特性有助于乳酸菌的发酵。根据菌株耐受性分析结果(表1)可知,10 株乳酸菌的生长情况在不同糖度、不同pH值和不同乳酸含量条件下会不同程度受到影响。菌株ZG1、ZG2、GG2、GG8、WQ2和NQ均具有相对较好的耐糖特性,满足发酵要求;菌株ZG2、GG2和GG8在pH 3.0~4.0条件下生长良好或受抑制程度不明显,说明具有较好的耐酸性;菌株GG8的耐乳酸特性最好,其次为菌株ZG2。综合菌株的耐受性,选择耐受性均较好的菌株GG8和菌株ZG2作为发酵菌株,对其发酵性能进一步研究[24-25]。

表1 不同乳酸菌的耐受性分析Table1 Tolerance of lactic acid bacterial stains to stress conditions
2.3 发酵液中活菌数与pH值变化
将通过筛选得到的干酪乳杆菌GG8和植物乳杆菌ZG2作为发酵菌株,接入梨汁中发酵,对发酵液中活菌数测定,结果见图2。干酪乳杆菌GG8在发酵24 h时活菌数增加,且在120 h内活菌数始终在106CFU/mL以上,之后活菌数迅速下降;植物乳杆菌ZG2在发酵液中活性相对较弱,发酵24 h时活菌数增加,之后开始明显下降,至发酵结束时降到105CFU/mL以下。发酵液中pH值降低不仅能够影响一些不耐酸的微生物生长繁殖,同时也赋予了柔和的酸味[26]。如图3所示,2 株菌在发酵过程中pH值的下降趋势相似,发酵前期pH值迅速下降,这与发酵前期乳酸菌的大量增殖有关;发酵后期,由于代谢产物、pH值等因素抑制,乳酸菌进入衰亡期,活菌数下降,pH值趋于稳定[27]。相较植物乳杆菌ZG2,干酪乳杆菌GG8在梨汁发酵液中生长情况较好,受条件抑制影响较小。
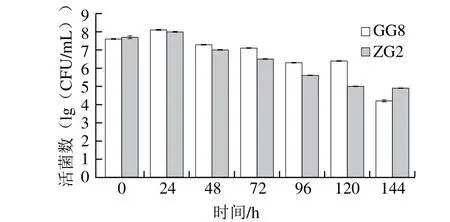
图2 2 株乳酸菌纯种发酵梨汁中活菌数变化Fig.2 Changes in viable count in pear juice fermented by 2 strains of lactic acid bacteria
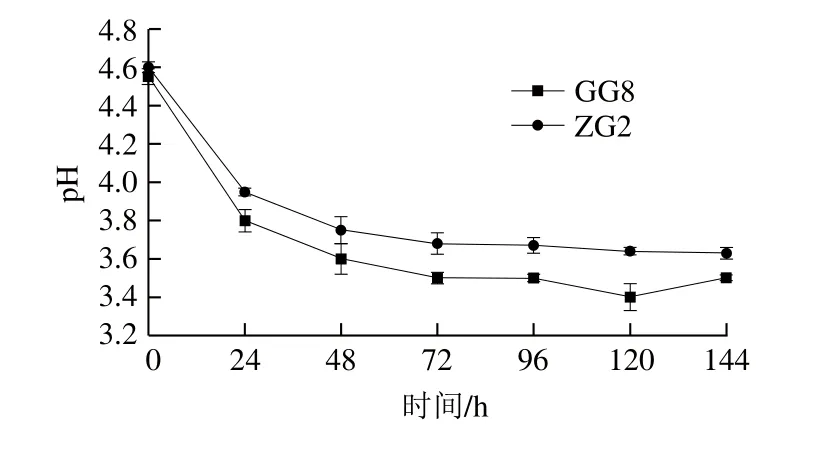
图3 2 株乳酸菌纯种发酵梨汁的pH值变化Fig.3 Changes in pH value in pear juice fermented by 2 strains of lactic acid bacteria
2.4 发酵液中有机酸含量变化
有机酸可以帮助人体完成新陈代谢的过程,修复人体病变器官等[22,28]。由图4可知,梨汁原液中主要含有甲酸和苹果酸,以及微量琥珀酸。2 株乳酸菌发酵144 h后,发酵液中有机酸种类相似,干酪乳杆菌GG8发酵液总酸含量高于植物乳杆菌ZG2。经干酪乳杆菌GG8发酵24 h,甲酸、苹果酸及琥珀酸等均迅速减少,乳酸和柠檬酸增加明显,乙酸少量增加;经植物乳杆菌ZG2发酵24 h,甲酸、苹果酸及琥珀酸等也迅速减少,乳酸含量增加,且高于干酪乳杆菌GG8发酵液,乙酸和柠檬酸含量仅少量增加。因此,植物乳杆菌ZG2产乳酸的能力明显高于干酪乳杆菌GG8,产柠檬酸能力弱于干酪乳杆菌GG8。

图4 干酪乳杆菌GG8(A)和植物乳杆菌ZG2(B)产有机酸情况Fig.4 Organic acid production rates of L. casei GG8 (A) and L. plantarum ZG2 (B)
2.5 发酵液中挥发性风味物质分析
发酵梨汁的风味物质主要来源于原料本身和乳酸菌发酵后产生的代谢产物[29]。根据表2可知,发酵前后共检测到26 种挥发性成分,其中醇类最多,为9 种,醛酮类6 种,酯类和酸类分别为3、2 种。发酵前后,构成梨汁主体风味的物质主要包括2-甲氧基-3-甲基吡嗪、芳樟醇和松油醇。
梨汁原液中主体风味物质有正己醇、2-甲氧基-3-甲基吡嗪、芳樟醇、松油醇、正辛酸、3,5-二甲基苯甲醛、大马士酮和香叶基丙酮等。干酪乳杆菌GG8发酵72 h后,共检测到15种挥发性成分,其中构成主体风味的有正己醇、2-甲氧基-3-甲基吡嗪、芳樟醇、松油醇、正辛酸、3,5-二甲基苯甲醛、橙花醇、大马士酮,以及通过发酵新产生的己酸乙酯和癸酸乙酯,赋予发酵液特殊的酒香;至发酵144 h时,挥发性风味物质部分消失,保留了2-甲氧基-3-甲基吡嗪、芳樟醇、松油醇和3,5-二甲基苯甲醛4种主要成分的同时,新生成了L-(-)-二苯甲酰酒石酸、反式-2,4-癸二烯醛、合金欢醇和棕榈酸乙酯,这使得发酵后期梨汁风味更加复杂、独特。植物乳杆菌ZG2发酵72 h,共检测到17种挥发性成分,主要挥发性风味物质同梨汁原液类似,主要包括正己醇、2-甲氧基-3-甲基吡嗪、芳樟醇、松油醇、正辛酸、3,5-二甲基苯甲醛和香叶基丙酮等,发酵新形成了具有特色风味的己醛、苯乙醇和反式-2,4-癸二烯醛;发酵144 h时,大量挥发性风味物质消失,保留了3种主要的风味物质[30-31]。较植物乳杆菌ZG2发酵梨汁,干酪乳杆菌GG8发酵梨汁含有相对丰富的挥发性风味物质,风味独特。
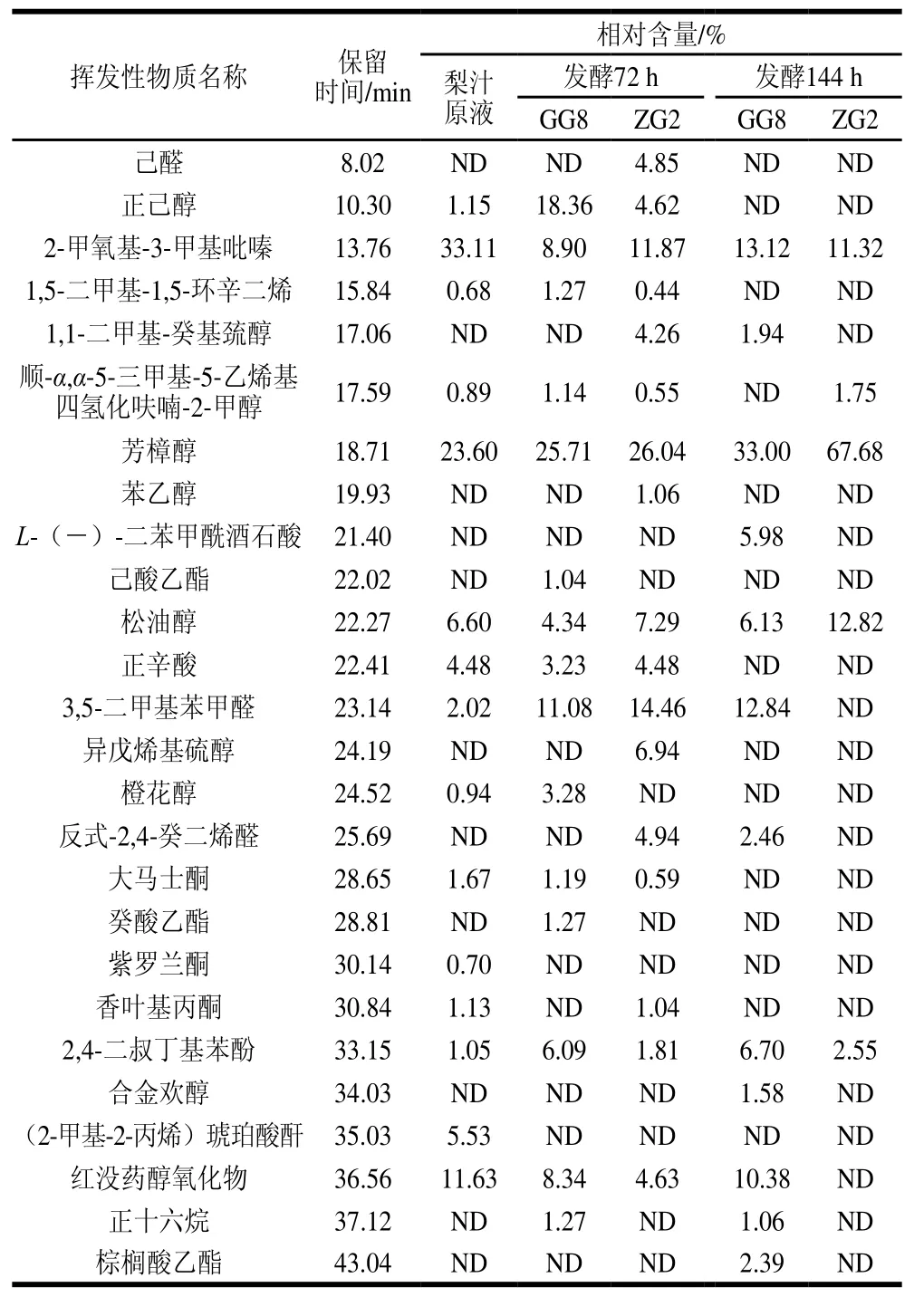
表2 2 种乳酸菌发酵梨汁中、后期的主要挥发性物质相对含量比较Table2 Relative contents of volatile substances in pear juice fermented with lactic acid bacteria during the middle and late stages of fermentation
3 结 论
通过研究10 株分离于水果发酵液及其他不同来源乳酸菌的耐糖、酸及耐乳酸等特性,筛选出2 株适宜梨汁发酵的乳酸菌,分别为干酪乳杆菌GG8和植物乳杆菌ZG2。通过对2 株菌的生长情况、发酵特性及代谢产物研究后发现,干酪乳杆菌GG8起酵快,发酵时间长,不易受环境抑制影响,产酸多,且能够产生较为丰富的挥发性物质;植物乳杆菌ZG2产乳酸能力强。综合考虑菌株的各项性能,选择干酪乳杆菌GG8作为梨汁发酵的优选菌株具有很大潜力和价值,可对其性能及在梨汁发酵工艺中的应用进一步研究验证。

