尖孢镰刀菌LD105产抑菌多糖固态发酵条件优化
郑露华,李 丹,陈 辉,梁小波,韩 鹏
(昆明理工大学 云南省食品安全研究院,云南 昆明 650500)
真菌多糖近年来被发现具有多种特殊的生物活性,例如:增强机体免疫力、抗菌、抗炎、抗氧化、降血糖等作用[1-4],因而逐步成为一个热门的研究话题。真菌多糖一般可以从真菌的子实体、菌丝体、发酵液中分离出来[5],有研究发现[6]从真菌中提取的多糖对多种细菌具有较好的抑菌作用,尤其是对一些革兰氏阴性菌[7]。以往报道中,尖孢镰刀菌的研究主要集中在其对植物致病机理、分子生物学和生物防治方面[8-9],研究发现尖孢镰刀菌水提取物及其多糖具有显著免疫增强作用[10],可促进巨噬细胞增殖,增强巨噬细胞吞噬功能,激活巨噬细胞释放免疫活性因子,可用于免疫功能低下疾病及肿瘤辅助治疗。
近年来细菌病害给种植业和畜牧业的生产带来巨大损失,其中大部分的植物细菌致病菌为革兰氏阴性菌,因此需要一种广谱、低毒、低残留的抗菌剂。本研究以农业麦麸为发酵基质,以尖孢镰刀菌LD105作为发酵菌种,采用单一微量稀释法,以多糖产量和抑菌率为评价指标,通过优化固态发酵工艺技术[11],揭示尖孢镰刀菌抑菌多糖和发酵条件之间的相互关系,为开发尖孢镰刀菌多糖潜在应用价值提供理论基础。
1 材料与方法
1.1 菌株、培养基与试剂
供试菌种:尖孢镰刀菌LD105从云南省昆明市东川区玛卡根际土壤中分离;抑菌实验指示菌:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus a u r e u s)、单核细胞性李斯特菌(L i s t e r i a monocytogenes)、沙门菌(Salmonella typhimurium)、志贺氏菌(Shigella castellani) 上海鲁能科技有限公司;绿色木霉(Trichoderma viride)、水稻纹枯病菌(Rhizoctonia solani)、灰葡萄孢菌(Botrytis cinerea)广东省微生物菌种保藏中心。
玉米粉、大豆粉、米糠、玉米芯、麦麸(作为不同固态基质种类)购自安徽合肥农作物加工厂,过10~20 目筛,粒径为0.85~2 mm,50 ℃烘箱干燥,密封常温保存,备用;马铃薯葡萄糖琼脂(PDA)培养基、营养肉汤 北京奥博星生物技术有限责任公司;固态发酵基础培养基:取10 g麦麸作为发酵基质、含水量60%、葡萄糖2%、KH2PO40.2%、蛋白胨2%、pH值自然。
无水乙醇 天津市风船化学试剂科技有限公司;浓硫酸 锦州古城化学试剂厂;蛋白胨 北京奥博星生物技术有限公司;苯酚、吐温-80、氯化钠、琼脂、葡萄糖、KH2PO4(均为分析纯) 成都科龙化工试剂厂;蔗糖 广东环凯微生物科技有限公司。
1.2 仪器与设备
TS-200电热恒温培养箱 上海天城实验仪器制造有限公司;SW-CJ-2F超净工作台、BXM-30R手提式压力蒸汽灭菌锅 上海博讯实业有限公司医疗设备厂;UV-2450S(E)紫外分光光度计 日本岛津公司;XR1台式高速冷冻离心机 赛默飞世尔科技有限公司;SJIA-10N冷冻干燥机 宁波市鄞州双嘉仪器有限公司;KQ-300B型超声波清洗器 昆山市超声仪器有限公司;96 孔细胞培养板 美国Costar公司。
1.3 方法
1.3.1 菌株的分离与鉴定
尖孢镰刀菌LD105于含50 μg/mL卡那霉素的PDA培养基培养1 周后,显微镜下进行菌落和孢子的形态学观察,同时对其28S rDNA进行扩增并测序,聚合酶链式反应引物为LROR:5’-ACCCGCTGAACTTAAGC-3’和LRO5:5’-TCCTGAGGGAAACTTCG-3’,基因组DNA的提取方法及28S rDNA扩增方法参照文献[12]进行,扩增产物由生工生物工程(上海)股份有限公司代为测序。测序结果经NCBI(美国国立生物技术信息中心)比对并建立系统发育树。
1.3.2 菌株的培养
斜面培养:将尖孢镰刀菌接种于PDA斜面,28 ℃恒温培养4~5 d,备用。
孢子悬浮液配制:用0.1%的吐温-80清洗平板培养基上的真菌孢子,制成约107CFU/mL孢子的悬浮液,备用。
固态发酵工艺流程:固体培养基配制10 g装入250 mL锥形瓶→121 ℃灭菌20 min→冷却至室温→接种孢子悬浮液→翻拌→28 ℃培养4 d。
1.3.3 水溶性抑菌多糖的提取与测定
取麦麸固态发酵产物加入5 倍去离子水,并搅拌均匀,沸水浴浸提1 h,8 000 r/min离心20 min,去除菌丝体,取5 mL上清液加入80%三氯乙酸溶液至终体积7%除蛋白,4 ℃静置,8 000 r/min离心20 min,收集上清液,加入9 倍体积无水乙醇多次进行醇沉,离心得多糖沉淀,将多糖沉淀复溶于1 mL去离子水中,并用去离子水透析(截留分子质量10 kDa)24 h,每8 h换水一次,干燥即得粗多糖样品[13-14],含量测定用苯酚-硫酸法[15]。
1.3.4 抑菌实验
根据Li Zhoukun等[16]的牛津杯法稍有改动:将指示真菌在PDA培养基上30 ℃培养2~4 d直至菌落直径约为2 cm。然后将消毒的牛津杯放在菌落周边培养基上,将所得干燥样品复溶于无菌水中,取200 μL多糖提取物,使用等体积的无菌生理盐水作为对照。将平板在30 ℃培养2~4 d,观察真菌生长的抑制情况。通过菌落直径的变化计算抑菌率。
细菌抑菌实验根据Casaril等[17]单一微量稀释法稍有改动:在96 孔板的每个孔中,加入100 μL含营养肉汤的细菌悬浮液(106CFU/mL),取100 μL上述发酵粗多糖提取液混合,阴性对照不加多糖提取液。在37 ℃孵育12 h后,用酶标仪测定波长600 nm处的吸光度,抑菌率通过比较吸光度测定。多糖对细菌生长的抑制率见下式:
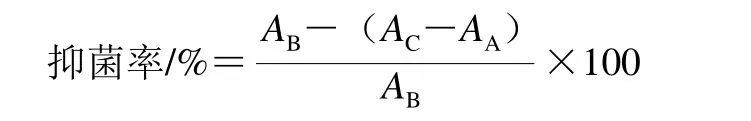
式中:AB为只含细菌悬浮液的吸光度,作为不含多糖的阴性对照;AC为含有细菌悬浮液和粗多糖提取物溶液混合物的吸光度;AA为仅含有粗多糖提取物的吸光度。
1.3.5 尖孢镰刀菌LD105多糖抑菌谱的测定
按照上述方法提取多糖用无菌生理盐水配制成1 mg/mL溶液,过滤除菌,测定其对大肠杆菌、金黄色葡萄球菌、单核细胞性李斯特菌、沙门菌、志贺氏菌、绿色木霉、水稻纹枯病菌和灰葡萄孢菌的抑菌活性,确定其抑菌谱。
1.3.6 尖孢镰刀菌LD105固态发酵条件优化
1.3.6.1 单因素试验
以固态发酵基础培养基为起始培养基,分别考察基质种类(玉米粉、大豆粉、米糠、麦麸、玉米芯);初始含水量(40%~90%);营养条件:碳源(葡萄糖、蔗糖、麦芽糖、可溶性淀粉:添加量1%~5%)、氮源(尿素、酵母膏、氯化铵、硫酸铵:添加量0.5%~2.5%)、无机盐(KH2PO4、MgSO4·7H2O、CaCl2·H2O、FeSO4·7H2O、NaCl、ZnSO4·7H2O:添加量0.1%~0.6%);培养条件:发酵温度(22~30 ℃)、初始pH值(5.5~7.5)、接种量(5%~30%)、发酵时间(2~10 d)对尖孢镰刀菌LD105发酵产抑菌多糖的影响,根据单因素试验结果和实际情况,选出对抑菌多糖影响的显著因素进行响应面试验设计。固态发酵优化过程均以大肠杆菌为指示菌,以多糖产量和抑菌率作为优化指标。
1.3.6.2 响应面试验
根据单因素试验结果选择对抑菌多糖有显著影响的4 个因素:发酵时间、蔗糖添加量、初始含水量、KH2PO4添加量为自变量,以抑菌率和多糖产量为响应值,利用Design-Expert 8.0.5软件进行4因素3水平的响应面试验优化。
1.3.7 尖孢镰刀菌LD105多糖分子质量测定
分子质量测定送由南京德祥同瑞生物科技有限公司采用凝胶排阻色谱法测定,多糖样品采用以上方法处理。测定条件参考文献[18]略有改动,以0.1 mmol/L NaNO3溶液作为流动相,流速0.7 mL/min,柱温45 ℃,上样质量浓度3 mg/mL,麦麸多糖作为对照处理。
1.4 数据处理与分析
所有实验数据取3 次重复实验的平均值,采用Origin 9.1作图,响应面试验设计通过Design-Expert 8.0.5软件进行分析与处理,显著性差异和相关性分析通过SPSS Statistics 17.0进行处理与分析,P<0.05,表示差异显著,P<0.01,表示差异极显著。
2 结果与分析
2.1 尖孢镰刀菌菌株鉴定
由图1a与1b所示,菌株LD105在PDA平板上生长7 d后菌丝由白色慢慢转变为浅紫色,菌丝体致密呈絮状,菌落突起。小型分生孢子着生于单生瓶梗上,顶端聚成球团,单胞,卵形,大型分生孢子无色、多胞、镰刀形、略弯曲、两端细胞稍尖[19]。该菌株通过28S rDNA序列进一步鉴定,序列已存入GenBank数据库(登录号:MG597030),序列分析表明菌株LD105与系统发育树中尖孢镰刀菌属同源性最相近(图1c)。由形态学观察和分子生物学鉴定将菌株LD105归类为尖孢镰刀菌属[20]。

图1 尖孢镰刀菌LD105菌株的菌落形态(a)、孢子形态(b)和28S rDNA序列构建的菌株LD105的系统发育树(c)Fig.1 Colony morphology (a) and spore morphology (b) of strain LD105 and phylogenetic tree of strain LD105 constructed based on 28S rDNA sequence (c)
2.2 尖孢镰刀菌LD105多糖抑菌谱

表1 尖孢镰刀菌LD105多糖抑菌谱Table1 Antibacterial spectrum of the polysaccharide from F. oxysporum LD105
由表1可知,尖孢镰刀菌固态发酵多糖对大多数细菌有抑制作用,而对绿色木霉、水稻纹枯病菌、灰葡萄孢菌等真菌基本无抑制作用。尖孢镰刀菌LD105固态发酵所产多糖对大多数革兰氏阴性菌有较强的抑制作用,其中对大肠杆菌的抑制作用最强。因此实验选用抑菌率最高的大肠杆菌作为指示菌。
2.3 尖孢镰刀菌LD105固态发酵单因素试验结果
2.3.1 基质种类对抑菌多糖的影响
由图2可知,用玉米粉作固态发酵基质,多糖产量最高,为27.0 mg/g,抑菌率为12.7%,以麦麸作为发酵基质产生的抑菌多糖产量为19.0 mg/g,抑菌率为18.5%。实验结果表明,选用玉米粉作为发酵基质产生的多糖产量最高,但抑菌效果不是最高,这主要是由于玉米粉本身含有大量淀粉,而固态发酵产生的抑菌多糖产量相对较少。用麦麸作发酵基质不仅可以提供一部分发酵所需的碳源和氮源,而且麦麸形成固态培养基后,组织状态疏松、透气性良好,有利于菌丝体的生长[21],有利于抑菌多糖的产生。麦麸作为发酵基质相比于其他基质种类对抑菌多糖产量有显著影响(P<0.05),且麦麸价格低廉,因此实验选用麦麸作为固态发酵的基质。

图2 基质种类对抑菌多糖的影响Fig.2 Effect of different solid matrices on polysaccharide yield and antibacterial activity
2.3.2 初始含水量对抑菌多糖的影响
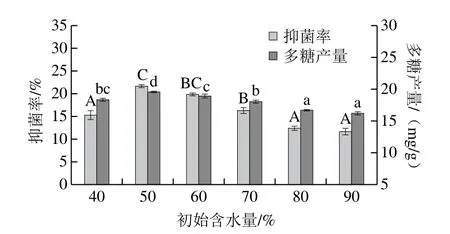
图3 初始含水量对抑菌多糖的影响Fig.3 Effect of initial moisture content on polysaccharide yield and antibacterial activity
含水量在固态发酵中有很重要的作用[22],由图3可知,抑菌率随着初始含水量的增加呈先上升后下降的趋势,当初始含水量为50%时,菌体生长良好,这与Ali等[11]研究结果相似,在此条件下尖孢镰刀菌LD105抑菌多糖产量为19.5 mg/g,抑菌率最高,达到21.6%,相比其他组分的含水量有显著差异(P<0.05),当初始含水量大于50%时,多糖产量和抑菌率均有所下降,且抑菌率下降较为显著,表明初始含水量过高,不利于有效成分抑菌多糖的产生。这可能是因为含水量过高导致底物颗粒聚集,通气不良[23],影响抑菌多糖产生。所以初始含水量选择50%最适宜。
2.3.3 营养条件对抑菌多糖的影响

图4 营养条件对抑菌多糖的影响Fig.4 Effect of nutritional conditions on polysaccharide yield and antibacterial activity
碳源添加量被认为是发酵条件中微生物生长的关键因素[24]。由图4A可知,碳源种类对菌体产多糖的抑菌效果依次为蔗糖>麦芽糖>葡萄糖>淀粉,添加蔗糖为碳源时,多糖产量和抑菌率显著增高(P<0.05)。当蔗糖添加量增加到3%时多糖产量为26.3 mg/g,抑菌率为28.9%(图4B),这与孙秋芳[25]的研究结果相似,以蔗糖为碳源,有利于多糖产量的提高。
由图4C可知,KH2PO4为发酵最佳无机盐种类,添加适量KH2PO4时,有助于抑菌多糖的产生,其最佳添加量为0.3%,在此条件下多糖产量为28.2 mg/g,抑菌率为32.7%(图4D)。以往研究表明KH2PO4的适量添加有助于提高多糖产量,其中的磷元素参与糖代谢及能量代谢过程,钾是许多酶的激活剂,可以促进碳水化合物的代谢,亦可提高细胞质膜的通透性,同时KH2PO4的添加可起到缓冲作用[26]。
2.3.4 发酵条件对抑菌多糖的影响

图5 发酵条件对抑菌多糖的影响Fig.5 Effect of fermentation conditions on polysaccharide yield and antibacterial activity
由图5A可知,尖孢镰刀菌LD105生长的温度范围很广,22~30 ℃均可以生长,由文献[27]可知尖孢镰刀菌的最适生长温度为25 ℃。实验中随着温度的升高,抑菌多糖产量呈现先增后降趋势,这可能与菌丝体的生长有关[28],可以看出,28 ℃是尖孢镰刀菌固态发酵的最佳温度,相比于文献中的最适生长温度高出3 ℃,可能是由于固态发酵基质结构疏松影响传热。当固态发酵温度为28 ℃时,多糖产量和抑菌率达到最高为28.9 mg/g和32.2%,相比于其他发酵温度影响显著(P=0.045<0.05)。
由图5B可知,发酵时间对抑菌多糖有显著影响(P<0.05),抑菌多糖产量和抑菌率随着发酵时间的延长呈先升高后下降的趋势,发酵2 d时多糖产量基本保持不变,抑菌率略有增加,主要是由于起始的多糖主要来源于基质。到发酵4 d时菌体产生的多糖产量达到最高,为29.3 mg/g,抑菌率达33.1%。发酵4 d以后多糖产量和抑菌率呈下降趋势。这可能是由于菌体大量繁殖,消耗了一部分所产生的多糖[29]。所以,发酵时间为4 d为宜。
对单因素试验结果进行显著性分析可知,氮源种类(P=0.1)与氮源添加量(P=0.82)、初始pH值(P=0.1)、接种量(P=0.6)对抑菌多糖影响不显著(P>0.05)。而对于发酵温度来说虽然结果分析显著(P=0.045<0.05),但相比其他显著(P<0.01)的单因素对发酵的影响而言相对较弱,考虑到实际情况最终确定4 个对固态发酵有显著影响的单因素:蔗糖添加量、发酵时间、初始含水量、KH2PO4。
2.4 尖孢镰刀菌LD105固态发酵产抑菌多糖相关性分析
对实验每个单因素的两个评价指标抑菌率和多糖含量进行相关性分析,结果表明除基质种类(R=0.231;P=0.716>0.05)其余单因素的抑菌率与多糖产量均呈正相关(P<0.05),表明抑菌活性来源于产生的多糖。由上述单因素试验结果分析可知,不同基质材料自身多糖含量各不同,提取的多糖存在基质本身含有的多糖,而这部分多糖并没有抑菌活性,导致基质种类作为考察因素时,抑菌率与多糖产量之间不存在相关性。
2.5 尖孢镰刀菌LD105固态发酵响应面试验结果
将单因素试验筛选出的4 个显著性影响因素:蔗糖添加量(A)、发酵时间(B)、初始含水量(C)、KH2PO4(D)添加量为自变量,根据Box-Behnken设计方案进行试验,利用Design-Expert 8.0.5软件进行4因素3水平的响应面试验优化,设定初始接种量10%、发酵温度28 ℃、蛋白胨添加量1.5%、pH 6。各因素的试验设计及结果见表2。
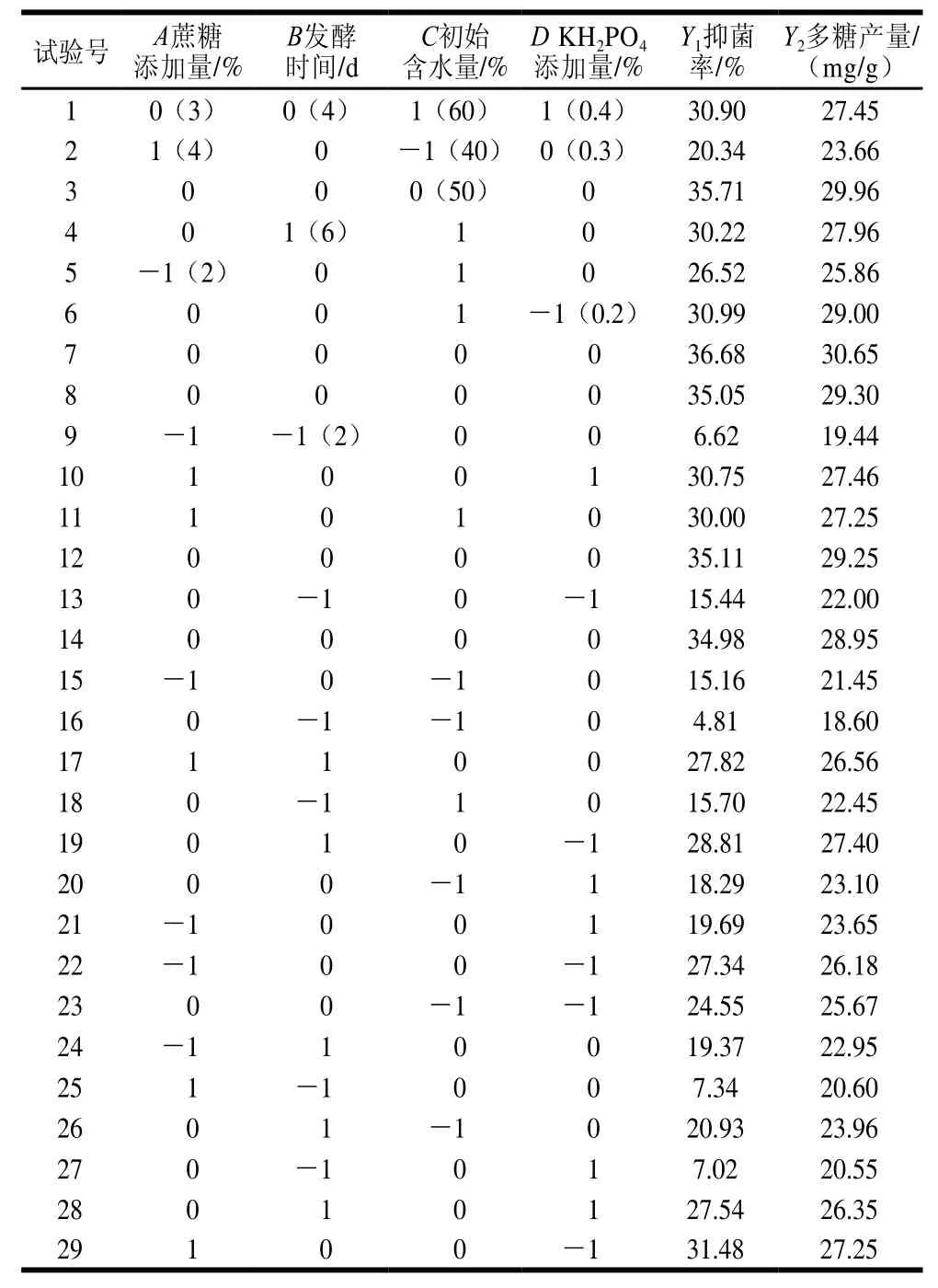
表2 响应面试验设计与结果Table2 Box-Behnken design with response variables
2.5.1 数学模型的建立结果
利用Design-Expert 8.0.6.1软件对表2中的试验结果进行回归分析,数据进行二次多项回归拟合,得到抑菌率(Y1)和多糖产量(Y2)对蔗糖添加量(A)、发酵时间(B)、初始含水量(C)、KH2PO4添加量(D)的二次多项式回归方程:Y1=35.30+2.74A+8.14B+4.77C-2.29D+1.93AB-0.42AC+1.73AD-0.33BC+1.79BD+0.77CD-6.27A2-12.66B2-5.95C2-2.87D2;Y2=29.62+1.10A+2.63B+1.96C-0.74D+0.61AB-0.21AC+0.68AD+0.039BC+0.099BD+0.26CD-2.72A2-4.41B2-2.21C2-1.00D2。

表3 抑菌率回归模型方差分析Table3 Analysis of variance of quadratic regression model for antibacterial activity
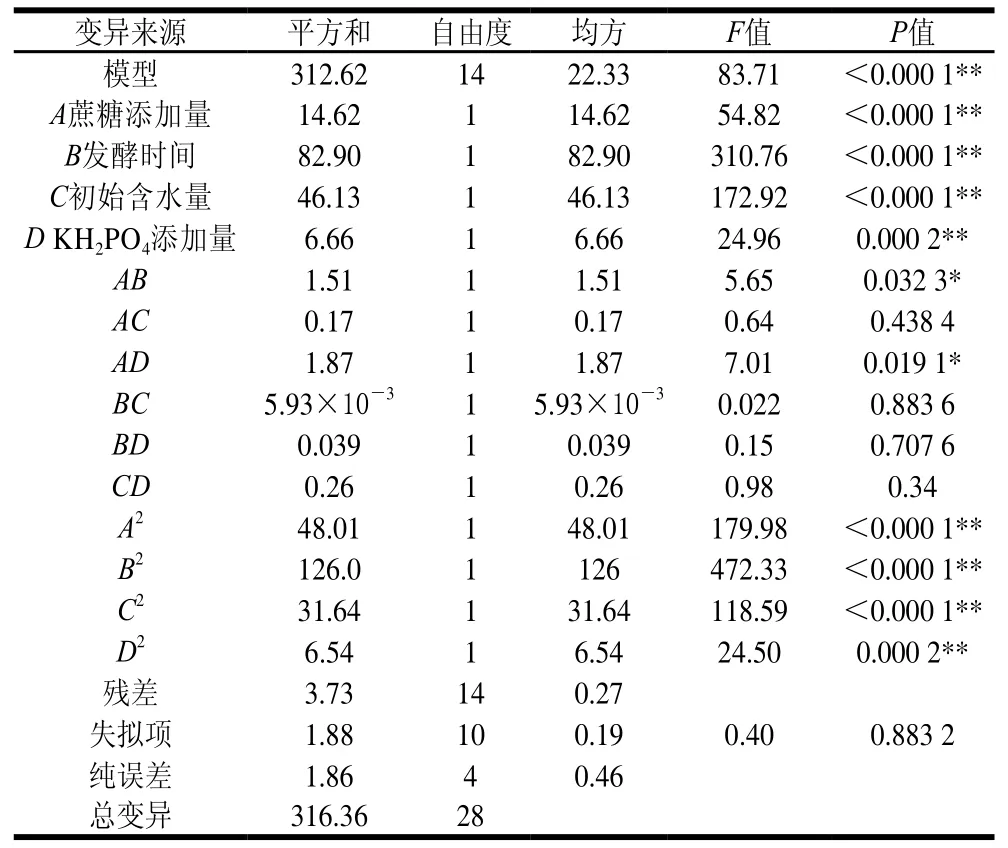
表4 多糖产量回归模型方差分析Table4 Analysis of variance of quadratic regression model for polysaccharide yield
由表3、4可知,该模型回归极显著,抑菌率和多糖产量的F值分别为68.55和83.71,失拟项差异不显著,抑菌率和多糖产量的P值分别为0.13(P>0.05)和0.88(P>0.05),说明该模型选择合适,对优化尖孢镰刀菌固态发酵工艺有实际应用意义。同时,模型可信度分析相关系数R2=0.98和=0.97很接近于1,说明该模型相关度很好[30],可以很好地反映试验真实值,操作可信。综上所述模型拟合程度良好,试验误差小,能够反映响应值的变化,可以准确地分析预测尖孢镰刀菌LD105多糖产量和抑菌率。
由回归模型系数显著性检验结果可知:两模型的一次项A、B、C、D影响极显著(P<0.01),二次项A2、B2、C2、D2影响极显著(P<0.01),交互项AB、AD影响显著(P<0.05),表明蔗糖添加量和KH2PO4添加量以及发酵时间和KH2PO4添加量对抑菌率和多糖产量均有交互影响的作用。在抑菌率方面,KH2PO4添加量和发酵时间之间(BD)也存在显著交互影响的作用。
2.5.2 尖孢镰刀菌LD105响应面分析
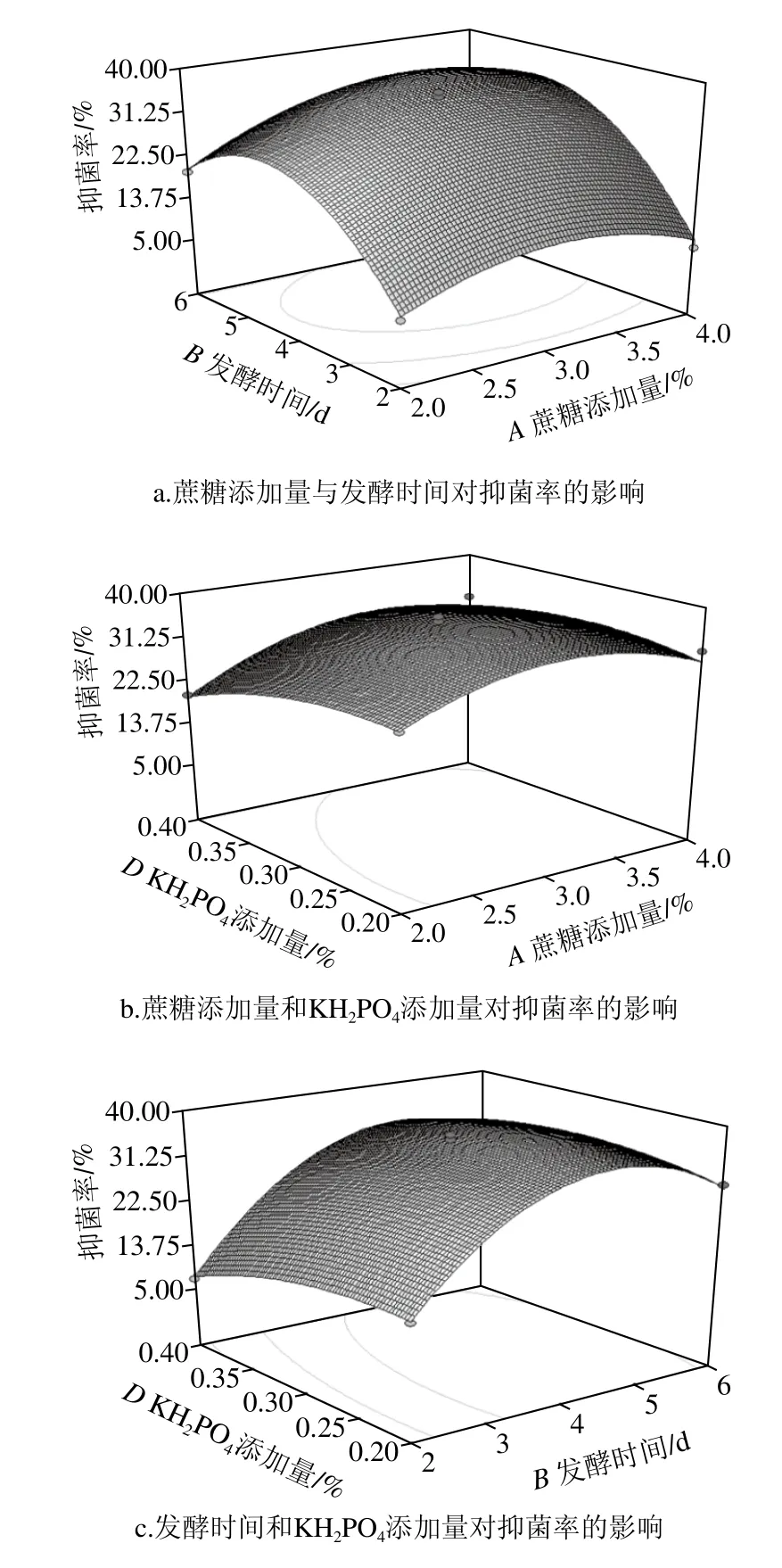
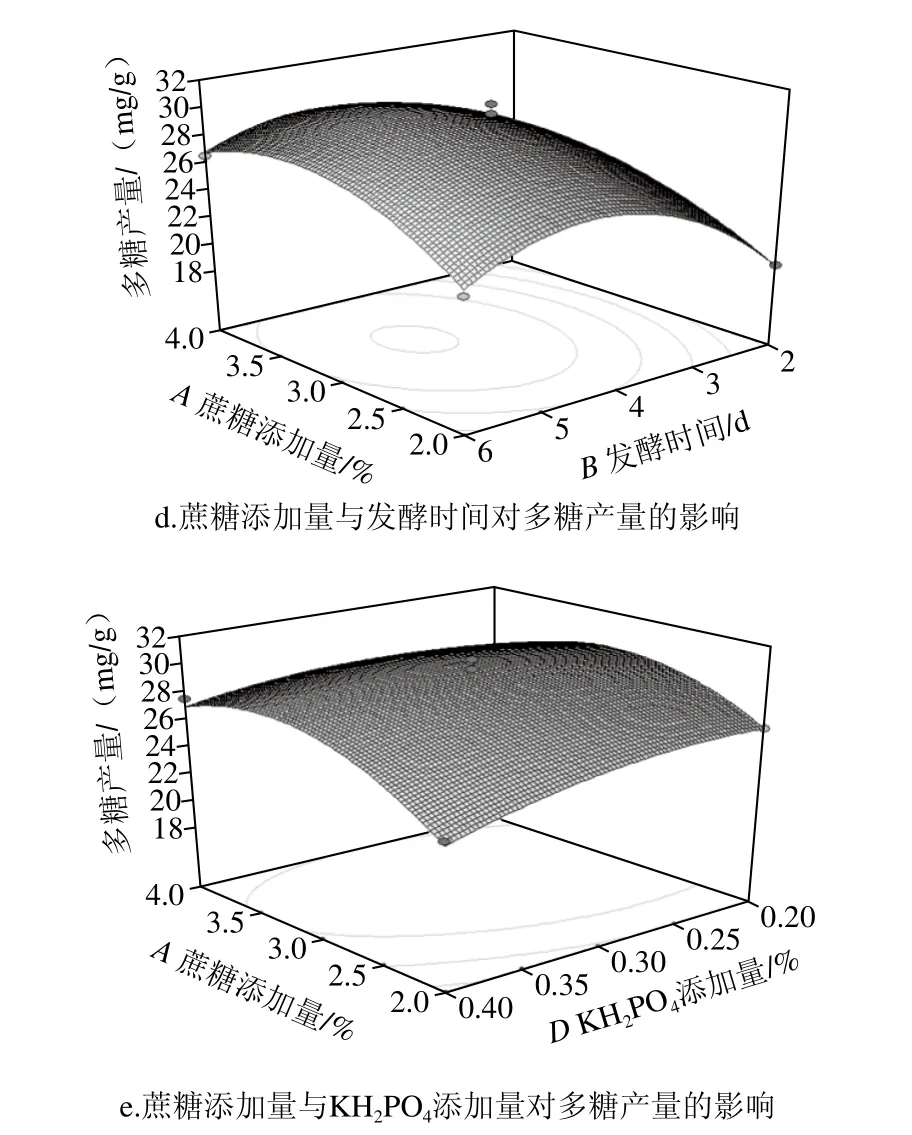
图6 各因素交互作用对多糖产量和抑菌率影响的响应面图Fig.6 Response surface plots showing the interactive effects among various factors on response variables
由图6a和6c可知,在KH2PO4添加量不变的条件下,随着发酵时间的逐渐延长,抑菌率呈现迅速上升、达到峰值平缓下降的趋势。由图6a和6b可知,在发酵时间不变的条件下,随着蔗糖添加量的逐渐增加,抑菌效果变化明显。当蔗糖添加量3%、发酵时间4 d、KH2PO4添加量0.3%时,多糖产量和抑菌率均达到峰值。由图6c、d可知,在KH2PO4添加量不变的条件下,随着发酵时间的延长,抑菌性呈现先上升后下降的趋势,而多糖产量并没有显著变化,这有可能是抑菌多糖与无功能多糖之间比例有所变化,但总量并没有显著变化。
根据响应面软件分析结果可知最优工艺条件:发酵时间5 d、蔗糖添加量3.2%、初始含水量53.8%、KH2PO4添加量0.28%、蛋白胨添加量1.5%、初始pH 6、接种量10%、发酵温度28 ℃,在该优化条件下,抑菌率和多糖产量的理论值分别为38.0%和30.5 mg/g。
为验证该模型对抑菌率预测的准确性,并考虑到实际操作的方便性,将得到的最佳工艺条件定为发酵时间5 d、蔗糖添加量3%、初始含水量54%、KH2PO4添加量0.3%、蛋白胨添加量1.5%、初始pH 6、接种量10%、发酵温度28 ℃,在此条件下进行3 次重复实验,结果表明,抑菌率和多糖产量平均值为37.6%和30.2 mg/g,与预测值接近,说明模型准确有效。尖孢镰刀菌在最佳发酵条件下生长状态良好,发酵过程稳定。
2.6 尖孢镰刀菌LD105多糖分子质量测定结果
尖孢镰刀菌固态发酵多糖重均分子质量为154 kDa,数均分子质量为29 kDa,分散系数为5.4,结果出现2 个峰值,小峰相比较主峰峰面积来说,占2%的比例,含量较少。未发酵的麦麸多糖主峰明显,含量高,多糖重均分子质量为14 kDa,数均分子质量为14 kDa,分散系数为2.8,可知麦麸多糖峰值分布相对尖锐。由实验结果可知,固态发酵的尖孢镰刀菌多糖相比麦麸多糖重均分子质量不同,尖孢镰刀菌固态发酵多糖分子质量更大,推测可能是尖孢镰刀菌利用固态基质产生了大分子质量的多糖。
3 结 论
本实验以一株产抑菌多糖的尖孢镰刀菌LD105为发酵菌种,其固态发酵多糖对革兰氏阴性菌有较好的抑菌效果,尤其是对大肠杆菌抑菌效果最好。该多糖的抑菌特性使其在新型绿色农药和饲料添加剂方面有着良好的应用前景。本实验采用双评价指标,通过单因素试验和响应面设计进一步优化尖孢镰刀菌LD105产抑菌多糖的能力,优化结果明显,抑菌率和多糖产量显著增加(P<0.05)。通过本实验可知,与以往先提升产量后测活性的方法相比,以功能活性为检测目标筛选产功能性多糖的菌株将更直接有效,目的性也更强,为将来筛选产功能性化合物的菌株,以及提高目标产物的产量提供一种科学有效的实验方法。

