一株黄曲霉毒素B1降解菌的筛选及鉴定
王明清,张初署,于丽娜,顾 博,丁 昱,毕 洁,孙 杰,迟晓元,张建成,龚魁杰,杨庆利
(1.山东省花生研究所,山东青岛266100;2.西海岸现代农业示范区管委会,山东青岛266000;3.山东省农业科学院作物研究所,山东济南250000;4.青岛农业大学食品科学与工程学院,山东青岛266109)
黄曲霉毒素(aflatoxin,AFT)是黄曲霉和寄生曲霉等真菌产生的一类次级代谢产物[1-2]。从分子结构上分析,该类毒素是由二呋喃环和香豆素组成的结构类似物[3]。黄曲霉毒素具有极强的致畸、致癌、致突变性,广泛污染花生、玉米、棉籽、稻谷等农产品,其毒性是氰化钾的10倍,砒霜的68倍,对人、禽和兽类的健康造成极大威胁[4-6]。根据紫外线照射下发出的荧光颜色区分,已报道黄曲霉毒素主要分为B类和G类,B类包括B1和B2,G类包括G1和G2;此外,还包括一些衍生物,如黄曲霉毒素M1、M2等,其中黄曲霉毒素B1(AFB1)污染最广,并且毒性最强,危害最大[7-8]。因此,寻找能有效脱除农产品中AFB1的方法对污染粮食再利用,以及保障人和动物健康具有重要的意义。
目前常用的脱除AFB1方法主要是物理法和化学法。物理法包括有挑拣、漂洗、高温加热、辐射法、溶剂萃取等方法[9-10],这些方法或者耗费大量人力物力,脱除效率不高,或者会破坏农产品的营养成分。化学法是利用一些氧化剂、氢氧化钠等化学试剂与毒素反应造成毒素降低[11-12],但有很大的局限性,很多试剂对操作人员的皮肤、眼睛、呼吸道造成伤害,并且化学试剂残留不易去除,影响农产品和食品的质量安全。近些年来,生物降解AFB1引起了研究人员的越来越多的关注,原因是生物脱毒法既避免了理化方法破坏农产品和食品的营养的弊端,又具有降解条件温和、特异性强和脱毒效率高等优点[13]。现在已发现有些细菌和真菌能降解AFB1,细菌类的降解菌如分支杆菌、嗜麦芽窄食单胞菌、恶臭假单胞菌、铜绿假单胞菌、枯草芽孢杆菌等[14-16],真菌类的降解菌如假蜜环菌、黑曲霉、黑芝等[13,17]。目前对微生物降解AFB1的大部分研究还处于菌株筛选阶段,筛选能高效降解AFB1的菌株是开展生物降解的重要基础。
本研究通过初筛和复筛从土壤中分离了一株高效降解AFB1的菌株A6;通过细菌形态学观察、生理生化特征以及16SrRNA基因分析鉴定菌株A6;进一步分离菌株的上清液、菌悬液和胞内液,通过分析各组分降解AFB1的效率,初步确定起降解作用的活性物质的所在组分。本研究为进一步研究其降解机理和应用生物脱毒提供支持。
1 材料与方法
1.1 材料与仪器
土壤样品 采自山东省青岛市黄岛区;AFB1标品 Fermentek公司;香豆素 上海融禾医药科技发展有限公司;色谱级甲醇 Merck公司;细菌基因组DNA提取试剂盒和DNA凝胶回收试剂盒 天根公司;黄曲霉毒素免疫亲和柱 华安麦科公司;Super GelRed荧光染色试剂 US Everbright Inc;p MD19-T载体 大连宝生物公司。
初筛培养基为香豆素液体筛选培养基[11](g/L):0.25 g KH2PO4,0.25 g MgSO4·7H2O,0.5 g KNO3,0.5 g(NH4)2SO4,0.005 g CaCl2,0.003 g FeCl3·6H2O,1.0 g香豆素,pH7.0,121℃高压灭菌15 min。香豆素固体筛选培养基:在液体培养基的基础上加入15 g/L琼脂。复筛培养基(g/L):10 g蛋白胨,3 g牛肉膏,10 g NaCl,1 g KH2PO4,1 g 葡萄糖,pH7.0,121 ℃ 高压灭菌15 min。LB液体培养基(g/L):10 g胰蛋白胨,5 g酵母提取物,10 g NaCl,pH7.0,121 ℃ 高压灭菌15 min。LB固体培养基:LB液体培养基中加入15 g/L琼脂。
IS-RDV1恒温振荡器 美国精骐公司;5430R高速离心机 德国Eppendorf公司;S1000TM Thermal Cycler PCR仪和凝胶成像仪 美国BIO-RAD公司;p H计 赛多利斯公司;GI36T高压蒸气灭菌器 致微(厦门)仪器有限公司;1260型高效液相色谱仪 Agilent公司。
1.2 实验方法
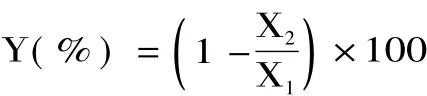
X1代表空白对照样品AFB1的峰面积,X2代表发酵菌液处理样品中残留AFB1的峰面积,Y代表AFB1降解率。
1.2.4 菌株A6降解特性研究 参考文献[11]和[20]的方法,全部在无菌环境下操作。5 mL的菌株A6发酵液,4℃条件下8000 r/min离心10 min,分离得到上清液和菌体。菌体用无菌蒸馏水洗涤、离心,重复3次后加入无菌蒸馏水补齐至5 mL,制备成A6菌悬液。按上述方法制备5 mL菌悬液,然后在冰上超声(超声破碎2 s,停4 s)破碎20 min后离心,收集的液体经0.22μm滤膜过滤制备A6的胞内液。取
1.2.1 降解AFB1菌株的初筛 采集的土壤样品以无菌水稀释10倍,稀释液按1/100接种量接种到初筛培养基,以香豆素为唯一碳源和能源[18],进行AFB1降解菌株的初筛,200 r/min 37℃振荡培养2~3周。观察菌株的生长情况,当培养基出现浑浊后在初筛的固体培养基涂布,在37℃培养箱中培养。观察细菌生长情况,根据菌落形态、颜色等挑取单菌落,在LB固体培养基上多次划线纯化培养。纯化的菌株培养后,加入15%甘油,-80℃冰箱保存。
1.2.2 降解AFB1菌株的复筛 初筛菌株接种于复筛培养基,37℃培养48 h。避光条件下,980μL发酵菌液加入20μL 5 mg/kg的AFB1标准品,使发酵液中AFB1终浓度为100μg/kg,无菌复筛培养基作为空白对照,37℃避光孵育72 h[19],采用高效液相色谱(HPLC)检测AFB1的含量,获AFB1降解率最高的一株菌。
1.2.3 AFB1含量的检测 参考文献[16]的测定方法。收集1.2.2中的样品,8 000 r/min离心20 min,上清液经0.22μm滤膜过滤后过免疫亲和柱,先用超纯水洗两遍,然后用色谱级甲醇洗脱,收集洗脱液。采用HPLC检测溶液中AFB1的含量,HPLC检测条件为:Agilent 1260高效液相色谱仪,C-18色谱柱(4.6 mm×15 cm ×5 μm),进样量为20μL,流动相为甲醇∶水 =1∶1(V/V),流速 0.8 mL/min,荧光检测器激发波长为360 nm,发射波长为440 nm。利用以下公式计算菌株对AFB1的降解率:A6上清液、菌悬液、胞内液各 980μL,分别加入20μL 5 mg/kg的 AFB1标准品,使 AFB1终浓度为100μg/kg,在37℃孵育72 h后,检测各组分AFB1降解率。
1.2.5 菌株鉴定
1.2.5.1 表型分析 菌株A6在LB固体培养基平板上37℃培养24 h后观察菌落形态、色泽。
1.2.5.2 生理生化性质分析 观察菌株A6革兰氏染色反应[21],将菌株A6接种在LB固体平板,放置在不同温度培养,研究其温度耐受性[22];将菌株A6接种在LB液体培养基中,调整其中NaCl的浓度,研究其盐度耐受性[22]。唯一碳源利用试验:将1.1中初筛培养基的香豆素替换为某一底物碳源,115℃灭菌20 min,将菌株A6在唯一碳源平板上划线,37℃培养15 d,观察是否生长,碳源包括葡萄糖、蔗糖、乳糖、麦芽糖、阿拉伯糖、吐温-20和吐温-80等碳源。氧化酶试验[23]:用1%四甲基对苯二胺二盐酸盐溶液浸湿滤纸,挑取新鲜的菌株A6点在滤纸上,在10 s内呈现紫色的为阳性。过氧化氢酶试验[23]:将30%过氧化氢滴在新鲜的A6菌落上,如果立即出现气泡为阳性,30 s后仍未产生气泡为阴性。
1.2.5.3 细菌16S rRNA基因序列测定 菌株A6接种到LB液体培养基,37℃振荡培养24 h后,采用细菌基因组提取试剂盒提取细菌基因组DNA。采用的细菌16S rRNA基因通用引物为:P1:5'-AGAGTTT GATCCTGGCTCAG-3',P2:5'- GGTTACCTTGTTACG ACTT- 3'[24]。PCR 的 反应 体系 25 μL:Taq buffer 2.5 μL,dNTPs 2 μL,Taq聚合酶0.1 μL,引物P1和 P2各1 μL,A6菌株基因组模板 0.5 μL,ddH2O 17.9 μL。PCR扩增程序:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸90 s,30个循环;72℃延伸5 min。反应结束后,5μL PCR产物上样于1%琼脂糖凝胶,90 V电压电泳25 min后经凝胶成像系统检测结果,PCR产物经过切胶、纯化等操作送到到上海生工生物有限公司测序。测序得到的序列提交到NCBI进行BLAST分析,将目标序列与搜索到的同源序列经ClustalW分析后,再用MEGA6软件构建系统进化树。
1.3 数据处理
各实验重复3次,取平均值作为结果,显著性采用SPASS 17.0软件分析。
2 结果与分析
2.1 菌株筛选
以香豆素为唯一碳源进行初筛,然后以加入AFB1的培养基进行复筛,筛选到多株能降解AFB1的菌株,其中菌株 S1、S4、A6、L2、L5 的 AFB1的降解率超过50%(图1),分析结果表明菌株A6的降解效率显著高于其它四株菌,该菌在37℃孵育72 h能降解90.6%的AFB1。后面实验围绕着菌株A6进行研究,分析该菌株的降解特征并对其进行鉴定。
2.2 菌株A6降解特性
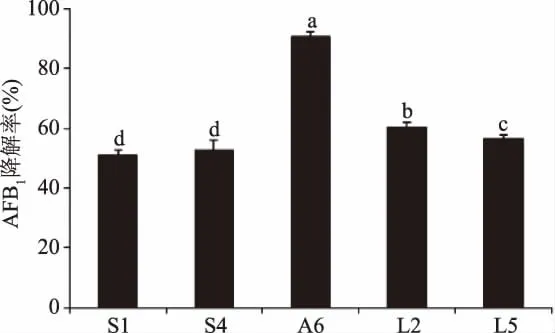
图1 各菌株降解AFB1的能力Fig.1 Degradation of AFB1 in each strain注:不同字母代表具有显著性差异p<0.05;图2同。
图2 为菌株A6各组分降解AFB1特性。比较菌株A6的上清液、菌悬液、胞内液降解AFB1的能力,发现上清液降解能力最强,达到90.6%,菌悬液和胞内液显著降低(p<0.05),分别为19.6%和12.8%。由此判断,菌株A6降解AFB1不是依赖细菌胞体的吸附作用,而是细菌代谢产生并分泌至胞外的活性物质主导的生物降解作用。

图2 菌株A6各组分降解AFB1能力Fig.2 Degradation of AFB1 in each component of strain A6
2.3 菌种鉴定
2.3.1 菌株A6形态学特征 由图3菌株A6的菌落形态可以看出,菌株A6在LB培养基上单菌落呈现圆形凸起,颜色为乳白色,具有皱褶,直径为5~8 mm,并且具有粘稠的特征。

图3 菌株A6的菌落形态Fig.3 The colony morphology of strain A6
2.3.2 菌株A6生理生化特征 菌株A6的革兰氏染色呈阳性,能利用葡萄糖、蔗糖、阿拉伯糖、乳糖、麦芽糖、淀粉、甘露糖等碳源,不能利用吐温-20、吐温-80、柠檬酸盐、半乳糖、蜜二糖等碳源,具有氧化酶和过氧化酶活性,能耐受10%的盐度,能在10~45℃范围内生长(表1),该生理生化特征与 Bacillus velezensis CR-502T相似[25]。根据菌株 A6 的生化反应特征及形态学特征[25],初步判断菌株A6属于芽孢杆菌属。
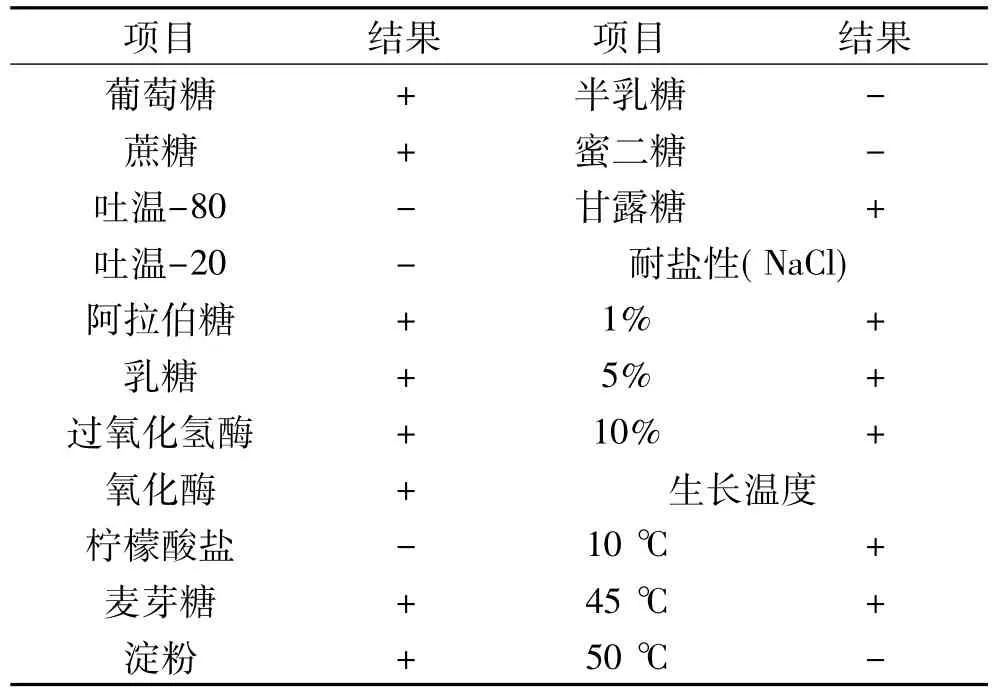
表1 菌株A6的生理生化特征Table 1 Physiological and biochemical characteristics of stain A6
2.3.3 菌株A6的16SrRNA基因鉴定 以16SrRNA基因特异性引物进行PCR扩增,在1000~2000 bp之间获得一条特异性的扩增条带,且条带清晰亮度好(图4)。该条带经切胶、纯化等操作,测序得到16S rRNA基因长度为1431 bp,该序列已提交GeneBank,登录号为MH156042。与已经公布的序列比对分析,发现菌株A6与芽孢杆菌属的菌株处于同一大的分支(图5),其中与贝莱斯芽孢杆菌CR-502T(Bacillus velezensis)聚类在一起,进化距离最近,相似度为99.64%。结合形态、生理生化和16S rRNA基因分析结果鉴定菌株A6为贝莱斯芽孢杆菌(Bacillus velezensis),命名为 Bacillus velezensis A6。
3 讨论
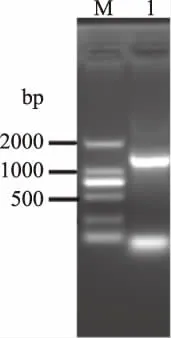
图4 菌A6的16SrRNA基因PCR产物琼脂糖凝胶电泳分析Fig.4 Electrophoresis profile of 16SrRNA gene from srain A6 by PCR注:M是DL2000 DNA Marker,1是菌株A6的16SrRNA基因。
有关AFB1降解菌的筛选已有较多报道,研究发现有些乳酸菌、酵母菌等微生物脱除AFB1的机理是吸附作用,这些微生物的菌体吸附 AFB1形成菌体-毒素复合物[26],该菌体-毒素复合物可以减少生物体对AFB1的吸收和代谢作用,然而这种毒素的吸附与释放是可逆的,当生物体内环境发生变化后可能会再次释放到机体中,因而这种吸附作用没有实现黄曲霉毒素去除的目的[27]。本研究从土壤中分离的A6菌株能有效去除AFB1,进一步研究分析了菌株A6的上清液、菌悬液、胞内液降解AFB1能力,发现细菌分泌胞外的活性物质能高效降解AFB1,排除了细菌菌体对AFB1的吸附作用。孙玲玉等[20]发现一株泰山枯草芽孢杆菌,该菌的上清液、菌悬液和胞内液能分别降解81.2%、16.1%、2.3%的AFB1。关心等[11]以香豆素为唯一培养基,从鸡粪中分离出一株蔬菜芽孢杆菌F6,该菌的上清液、菌悬液和胞内液能分别降解83%、22.8%、17.4%的AFB1。雷元培等[28]分离发现的枯草芽孢杆菌060的上清液能降解73%的AFB1,而菌悬液和胞内液对AFB1的降解率仅为10%左右,表明该菌对AFB1降解的活性物质是一种胞外分泌物,主要存在于上清液中。本研究筛选到的贝莱斯芽孢杆菌A6的上清液、菌悬液和胞内液能分别降解90.6%、19.6%、12.8%的AFB1,降解特征与已报道的泰山枯草芽孢杆菌、蔬菜芽孢杆菌F6、枯草芽孢杆菌060相似。在今后分离纯化贝莱斯芽孢杆菌A6降解AFB1的胞外活性物质时,排除了细胞菌体和胞内产物对生物工程下游处理带来的不便和复杂程序。
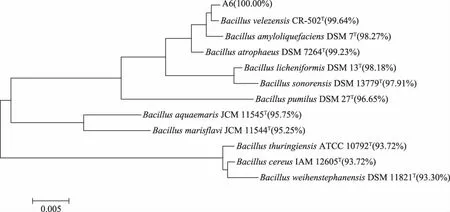
图5 菌株A6的系统发育树Fig.5 Phylogenetic tree of strain A6注:菌株后面括弧是该菌与菌株A6的16SrRNA基因的相似度。
4 结论
本研究从青岛土壤中筛选出的菌株A6能高效降解AFB1,进一步研究发现起降解的活性物质主要位于细菌胞外液。根据细菌生物形态学观察、生理生化特征以及16S rRNA基因分析鉴定菌株A6为贝莱斯芽孢杆菌,命名为Bacillus velezensis A6。这些研究结果为进一步深入研究该菌的降解机理及应用于AFB1脱毒奠定了基础。

