枝瑚菌多糖的结构及其免疫调节活性
董明明,丁 祥,2,宋 波,蒋 琳,刘 影,侯怡铃,*
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充637009;2.西华师范大学环境科学与工程学院,四川南充637009)
枝瑚菌(Ramaria flaccida(Fr.)Quél.)是一种常见的真菌科类。子实体小,分枝多且稠密,柄短,通常从柄基部分枝,菌肉柔软,担子细长呈棍棒状[1]。主要分布于安徽、西藏、贵州、云南、四川等地,多生于阔叶林或针叶林地上,一般成丛生生长,产量较高,但其子实体现多为野生采摘,未见有人工栽培的报道。有研究表明,该菌液体发酵菌丝体与子实体的化学组成极为相似,且菌丝产量可达到9.45 g/L[2-4]。此外,据报道,该科各属含有很多别具风味的食用菌,部分枝瑚菌对于艾氏癌(EC)和小白鼠肉瘤(S-180)有很强抑制作用,是我国野生食用真菌资源中极为宝贵的组成部分,所以该类真菌具有较大研究价值[5]。
食用菌多糖是食用菌子实体或菌丝中存在的一类活性多糖,是食药用真菌中能够起到保健和医疗的重要成份[6]。研究表明,食用菌多糖具有抗肿瘤、抗病毒、抗氧化、抗衰老、调节免疫机能、提高心肌保护、降血脂等生物活性,并且对人体毒副作用相对较小,受到越来越多人的关注[7-11]。
目前,对于枝瑚菌的研究主要在其成分含量测定以及抗氧化上,对枝瑚菌多糖的免疫调节活性方面还没有报道[12]。本文采用热水浸提法、Sevage法和乙醇醇沉得到粗多糖,再经DEAE-52纤维素层析法纯化枝瑚菌多糖。在提取分离到纯化的枝瑚菌多糖基础上,采用傅里叶变换红外光谱仪(FT-IR),体外细胞培养法对其结构和免疫调节活性两个方面进行了研究。通过此研究有助于开发利用枝瑚菌多糖资源,并且为进一步研究其免疫调节机制以及药用价值方面提供理论参考。
1 材料与方法
1.1 材料与仪器
枝瑚菌子实体(Ramaria flaccida(Fr.)Quél) 四川省阿坝藏族羌族自治州小金县,在西华师范大学丁祥教授鉴定后,放于烘箱中(65℃)烘干过夜,待其子实体样本完全干燥后,4℃保存于西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室;DEAE-52纤维素柱 生兴生物技术(南京)有限公司;透析袋 Sephadex G-200(Mw≥7 kDa) Biosharp公司;NaOH、NaCl和苯酚 生工科技(四川)有限公司;无水乙醇、浓硫酸、浓盐酸 上纬精细化工(上海)有限公司,以上试剂均为分析纯;小鼠巨噬细胞(RAW264.7)、T淋巴细胞、B淋巴细胞 金凯生物技术(成都)有限公司;Roswell Park Memorial Institute-1640培养基、双抗、胎牛血清 Thermo Fisher Scientific公司(美国);脂多糖(LPS) Sigma公司(美国);细胞计数试剂盒(CCK-8试剂盒) 博升生物科技(上海)有限公司;中性红试剂 生工生物工程(上海)股份有限公司;一氧化氮检测试剂盒 碧云天生物技术公司;小鼠TNF α、IL-2、IL-6、IL-10 ELISA 免疫试剂盒 博士德生物工程(武汉)有限公司。
TU-1901/1900系列傅立叶红外光谱仪 北京晶品赛思科技有限公司;BPN-80CH(UV)CO2细胞培养箱 上海一恒科学仪器有限公司;SE-CJ-1F型-超净工作台 苏州安泰空气技术有限公司;318Mc型-酶标仪 上海三科仪器有限公司。
1.2 实验方法
1.2.1 枝瑚菌多糖的分离提取 精确称取枝瑚菌子实体500 g,将其剪成小段放于烘箱中,65℃烘干过夜,第2 d取出子实体用粉碎机粉碎,将子实体粉末和蒸馏水以1∶30(g/mL)的比例在95℃的恒温水浴锅中水浴搅拌3 h,后将混合液10000 r/min离心15 min,收集上清液并且用旋转蒸发仪旋转浓缩至200 mL[13-14]。然后用 Sevage 法除去浓缩液中的蛋白质,然后加入三倍体积的无水乙醇并搅拌,出现絮状沉淀物,收集沉淀并放入烘箱(65℃)干燥处理,得到枝瑚菌粗多糖[15]。将粗多糖加蒸馏水溶解,最终溶解的体积为200 mL。取3 mL加入到DEAE-52纤维素柱中,以5 mL/min的流速通过,然后用150 mL蒸馏水过柱,收集洗脱液[16]。用硫酸-苯酚法测定洗脱液多糖[17]。将洗脱液浓缩至5 mL,用透析袋透析,持续3 d,早晚换蒸馏水,除去小分子化合物,冻干[18]。得到纯化的枝瑚菌多糖,命名为RF-S。
1.2.2 傅里叶变换红外光谱仪(FT-IR)测定RF-S的结构 取2 mg RF-S与200 mg干燥的KBr研磨混匀后压片,用 FT-IR 在 4000~400 cm-1区间内扫描[19]。
1.2.3 RF-S对巨噬细胞、B淋巴细胞和T淋巴细胞的增殖作用 采用细胞计数试剂盒(CCK-8法)测定RF-S对巨噬细胞、B淋巴细胞和T淋巴细胞的增殖影响[20-21]。将 PBS 缓冲液(NaCl 8 g+KCl 0.2 g+Na2HPO41.44 g+KH2PO40.24 g+H20 1000 mL)(p H=7)加入96孔板四周,其余每孔分别加入100μL的1×105CFU/mL浓度的细胞悬浮液,置于37℃、5%CO2的培养箱中培养24 h。空白对照组的每孔分别加入培养液(RPMI-1640培养基90%+胎牛血清10%+双抗1%);阳性对照组的每孔分别加入100μL脂多糖(LPS)溶液,终浓度为5μg/mL;RF-S药物组的每孔分别加入100μL RF-S溶液(质量终浓度为 0.625、1.25、2.5、5 μg/mL),继续培养 24 h。然后每孔加入5μL CCK-8溶液孵育3 h,测定450 nm下吸光值,记录结果,并拍照。其增值率(%)=[OD(实验组)-OD(空白对照组)]/OD(空白对照组)×100。注:实验组即为阳性对照组和四个RF-S药物组。
1.2.4 RF-S对巨噬细胞吞噬中性红能力的影响 用中性红法检测RF-S对巨噬细胞吞噬能力的影响[22-23]。将 PBS缓冲液加入 96孔板四周,其余每孔分别加入100μL的1×105CFU/mL浓度的细胞悬浮液,置于37℃、5%CO2的培养箱中培养24 h。空白对照组:每孔分别加入100μL培养液;阳性对照组:每孔分别加入100μL LPS溶液,终浓度为5μg/mL;RF-S药物组:每孔分别加入100μL RF-S溶液(质量终浓度为0.625、1.25、2.5、5 μg/mL),继续培养24 h 吸出上清液丢弃,再每孔分别加入100μL 0.075%中性红溶液,吞噬1~2 h后,吸出中性红溶液。用PBS洗3次,最后每孔分别加入100μL的细胞裂解液(乙醇∶乙酸 =1∶1,v∶v)裂解 2 h,用酶标仪检测波长 540 nm处的OD值。
1.2.5 RF-S对巨噬细胞吞噬荧光微球能力的影响 与中性红的吞噬实验类似,加药继续培养后,吸出上清液,再每孔加入100μL预处理过的荧光微球(微球浓度为1 ×107/mL),吞噬1~2 h,吸出上清[24]。PBS洗3次,再加入100μL/孔细胞裂解液(乙醇∶乙酸 =1∶1,v∶v)裂解2 h,用酶标仪检测波长505 nm 处的OD值。
1.2.6 RF-S对巨噬细胞释放NO能力的影响 将PBS缓冲液加入96孔板四周,其余每孔分别加入100μL的浓度为1×105CFU/mL的巨噬细胞稀释液,37℃培养24 h。空白对照和实验组各依次分别加入:100μL细胞培养液、终浓度为5μg/mL的LPS溶液(阳性对照)以及不同浓度的RF-S(终浓度为1.25、2.5、5 μg/mL),5%CO2,37 ℃ 继续培养 24 h。收集上清液,按照一氧化氮检测试剂盒说明书操作,酶标仪检测波长540 nm处的OD值,用亚硝酸钠标准曲线计算培养上清液中 NO 含量(μmol/mL)[25-26]。
1.2.7 RF-S 对巨噬细胞的释放 IL-2、IL-6、IL-10和TNFα能力的影响 将PBS缓冲液加入96孔板四周,其余每孔分别加入100μL的浓度为1×105CFU/mL的巨噬细胞稀释液,37℃培养24 h。空白对照和实验组各依次分别加入:100μL细胞培养液、终浓度为5μg/mL的LPS溶液(阳性对照)以及终浓度为5 μg/mL 的RF-S,5%CO2,37 ℃继续培养24 h。收集药物组(LPS、RF-S)和空白对照组的上清液,按照ELISA免疫试剂盒中说明书进行操作,用酶标仪测量波长 450 nm 处的 OD 值[27-28]。
1.3 数据处理
所有数据均采用平均值±标准差表示,采用SPSS 18.0软件进行数据处理及分析,用t-test检验差异的显著性,与对照组对比,差异显著用*表示(p<0.05),差异极显著用**表示(p<0.01),差异不显著(p>0.05)。
2 结果与分析
2.1 FTIR测定RF-S结构
徐红霞等[29]所研究的野生枝瑚菌多糖主要由甘露糖和葡萄糖两种单糖组成,但对枝瑚菌多糖中单糖的成环形式等精细结构未作报道。本实验采用傅里叶红外光技术(FT-IR)测定RF-S结构,在如图1所示RF-S的红外光谱中,3427.72 cm-1为糖类分子内或分子间氢键O-H的伸缩振动峰,说明存在分子间和分子内氢键;2929.28 cm-1的吸收峰是C-H的伸缩振动引起的;在1637.22 cm-1为C=O,C=C振动峰;1401.89和1334.61 cm-1处的吸收峰,表明存在C-H的弯曲振动;1259.84 cm-1处的吸收峰是环上碳-氧(C-O)吸收峰。在 1200~1000 cm-1范围内,1102.39、1079.46 和1045.50 cm-1为C-O-H 伸缩振动和吡喃环中醚键C-O-C伸缩振动。在884.99 cm-1的吸收峰是该多糖吡喃环的β-型异头C-H变角振动引起的。619.36 cm-1被认为是由C-H摇摆振动峰引起的。由此可初步证明此物质为多糖结构,特征峰明显,无其他结构特征峰,应为多糖纯品,且其多糖中的单糖是以吡喃糖苷的形式存在[30]。
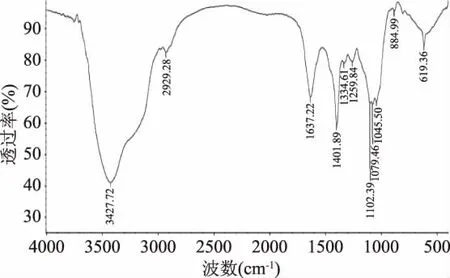
图1 RF-S的红外光谱图Fig.1 Infrared spectrum of RF-S
2.2 RF-S对T淋巴细胞的增殖作用
多糖抗肿瘤性与多糖的抗氧化性和能提高机体免疫能力密切相关[31]。李华等[32]研究已表明,RF-S具有良好的抗氧化性。本实验运用细胞学技术,从体外水平,以巨噬细胞和淋巴细胞为靶细胞研究了RF-S的免疫调节活性。T淋巴细胞增殖效果如图2所示,在0.625~5μg/mL浓度下,其增殖率与药物的浓度剂量呈正相关关系。当多糖浓度在0.625μg/mL时,T淋巴细胞增殖率达20.32%(与空白对照组相比,差异极显著(p<0.01)),当浓度为 1.25、2.5μg/mL时,增殖率分别为54.91%、57.01%(与空白对照组相比,差异极显著(p<0.01)),超过了5μg/mL LPS的增殖效果。当RF-S浓度为5μg/mL时,T淋巴细胞增殖率达到了62.66%(与空白对照组相比,差异极显著(p<0.01))。T淋巴细胞的增殖形态如图3所示,随着RF-S浓度逐渐增加,细胞分裂加快,细胞数增多。
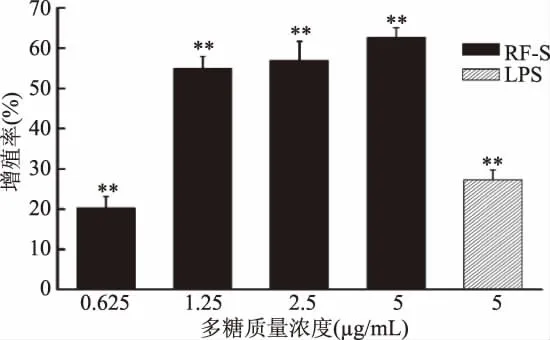
图2 RF-S对T淋巴细胞的增殖作用Fig.2 The effect of RF-S on the proliferation of T lymphocytes注:**表示与空白对照组相比,差异极显著(p<0.01);*表示与空白对照组相比,差异显著(p<0.05),图4、图6、图 8~图 11 同。

图3 RF-S对T淋巴细胞增殖形态的影响Fig.3 The cell morphology effect of RF-Son the proliferation of T cell注:(a)为空白对照组,(b)为LPS组(5μg/mL);(c)~(f)为RF-S实验组,质量浓度分别为0.625、1.25、2.5、5 μg/mL。图5~图7 同。
2.3 RF-S对B淋巴细胞的增殖作用
B淋巴细胞增殖效果如图4所示,与空白对照组相比,RF-S药物组与LPS组能极显著地促进B淋巴细胞增殖(p<0.01),并呈一定的剂量关系。当RF-S浓度在5μg/mL时,其增殖率达到最大,为67.05%(与空白对照组相比,差异极显著(p<0.01))。图5显示,与空白对照组相比,RF-S药物组的B淋巴细胞成团明显增大,数量明显增加,当浓度在5μg/mL时,细胞成团最大,数量最多。
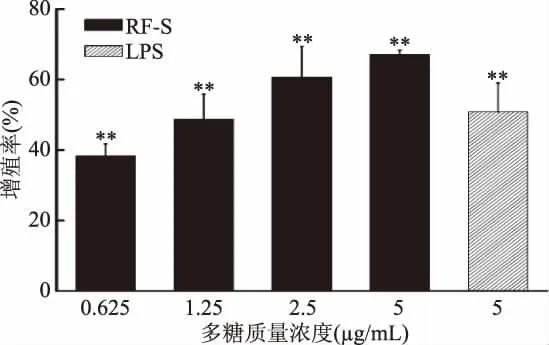
图4 RF-S对B淋巴细胞的增殖作用Fig.4 The effect of RF-S on the proliferation of B lymphocytes

图5 RF-S对B淋巴细胞增殖形态的影响Fig.5 The cell morphology effect of RF-Son the proliferation of B cell
2.4 RF-S对巨噬细胞的增殖作用
巨噬细胞增殖效果如图6所示,当加药(RF-S和LPS)刺激时,巨噬细胞的增值率极显著高于未加药的空白对照组(p<0.01),而且巨噬细胞数量的增加与RF-S的浓度呈剂量依赖关系。但RF-S在浓度为0.625~2.5μg/mL时,增殖效果仍然不及LPS对巨噬细胞的增殖影响强。在5μg/mL的RF-S组中,巨噬细胞的增殖率明显高于5μg/mL的LPS组。由图7可看出,在药物刺激下,巨噬细胞数量增加十分明显。

图6 RF-S对巨噬细胞的增殖作用Fig.6 The effect of RF-S on the proliferation of macrophage
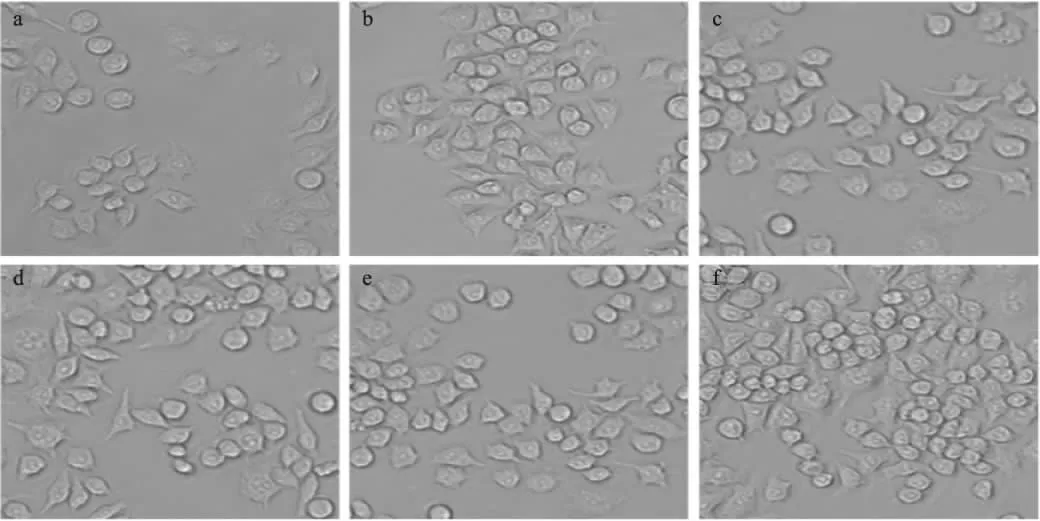
图7 RF-S对巨噬细胞增殖形态的影响Fig.7 The cell morphology effect of RF-Son the proliferation of macrophages
2.5 RF-S对巨噬细胞吞噬中性红能力的影响
巨噬细胞吞噬中性红能力的结果如图8所示,在RF-S浓度为1.25μg/mL时,巨噬细胞吞噬中性红的能力略有提高但未达显著水平(p>0.05);在LPS(5 μg/mL)以及RF-S(2.5、5 μg/mL)刺激下,巨噬细胞吞噬中性红的能力极显著提高(p<0.01),当RF-S在5μg/mL时,药物组的 OD值最大,略高于LPS组5μg/mL刺激下的OD值,在所有组中对中性红的吞噬能力最强。
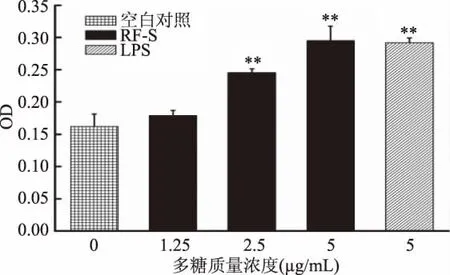
图8 RF-S对巨噬细胞吞噬中性红能力的影响Fig.8 Effect of RF-Son the ability of macrophages to swallow neutral red
2.6 RF-S对巨噬细胞吞噬荧光微球能力的影响
巨噬细胞吞噬荧光微球能力的结果如图9所示,RF-S能够以1.25~5μg/mL剂量的浓度提高巨噬细胞吞噬荧光微球的能力(p<0.01)。巨噬细胞吞噬荧光微球的能力与RF-S的浓度呈正相关。当RF-S在5μg/mL时,药物组的OD值最大,表明此时巨噬细胞的吞噬能力最强。
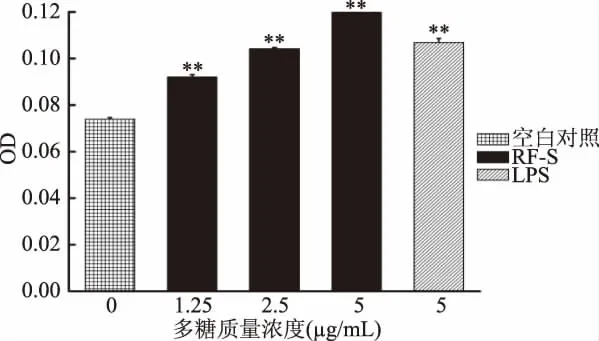
图9 RF-S对巨噬细胞吞噬荧光微球能力的影响Fig.9 Effect of RF-Son the ability of macrophages to phagocytize fluorescent microspheres
2.7 RF-S对巨噬细胞释放NO能力的影响
巨噬细胞释放NO能力的结果如图10所示,当浓度在1.25~2.5μg/mL范围之间时,RF-S能刺激巨噬细胞产生NO,但未达显著水平(p>0.05)。而在浓度为5μg/mL时,RF-S可以非常显著地刺激巨噬细胞产生NO(p<0.01),在三个RF-S药物试验组中,NO释放量最高;但与LPS 5μg/mL试验组比较,NO释放量仍很低。
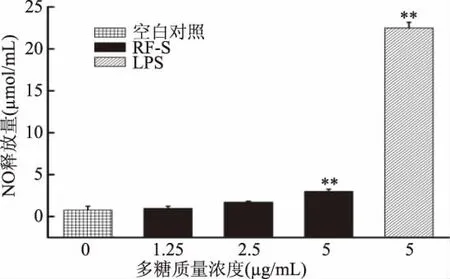
图10 RF-S对巨噬细胞释放NO能力的影响Fig.10 The effect of RF-Son the ability of macrophages to release NO
2.8 RF-S 对巨噬细胞释放 IL-2、IL-6、IL-10 和TNFα能力的影响
巨噬细胞释放 IL-2、IL-6、IL-10和 TNF α 能力见图11,RF-S药物组与LPS组均能促进巨噬细胞分泌IL-2、IL-6、IL-10 和 TNF α。且5 μg/mL 的 RF-S刺激巨噬细胞分泌IL-2、IL-10和TNFα与空白对照组相比,具有极显著的增强效果(p<0.01),对刺激巨噬细胞分泌IL-6有显著增强效果(p<0.05)。
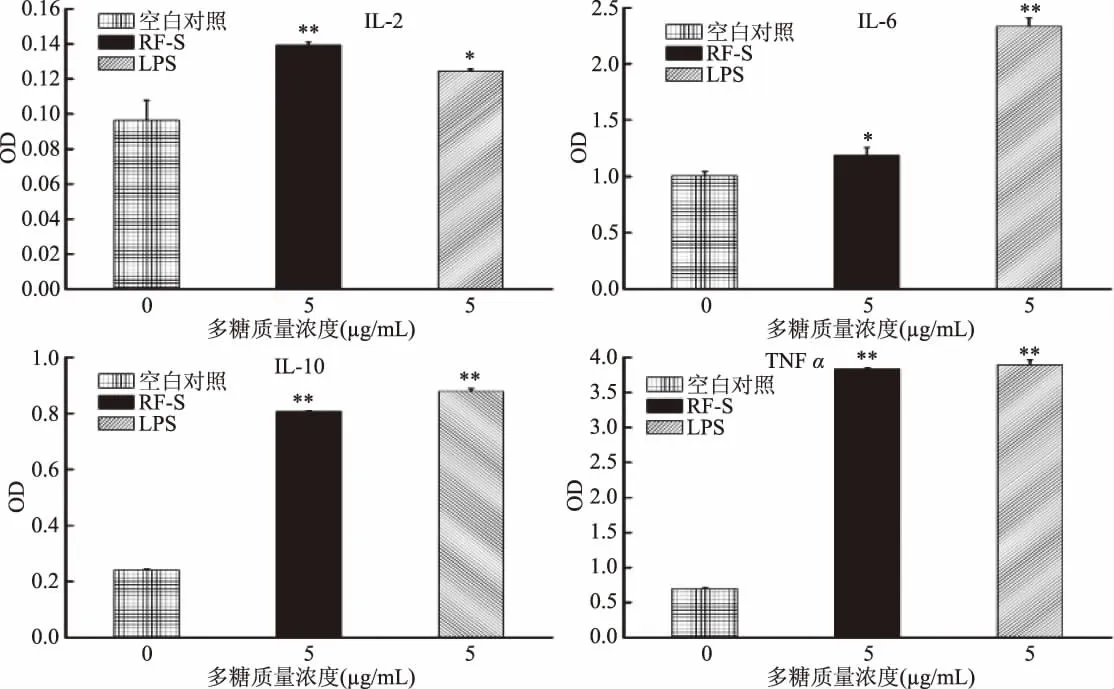
图11 RF-S对巨噬细胞释放 IL-2、IL-6、IL-10和 TNF α 能力的影响Fig.11 The effect of RF-Son the ability of macrophages to release IL-2,IL-6,IL-10 and TNF α
3 结论
本论文采用傅里叶红外光技术(FT-IR)测定RF-S结构,红外光谱显示其有明显的多糖结构吸收峰,判断该化合物为糖类化合物,且在884.99 cm-1处存在吸收峰,说明其多糖中的单糖是以吡喃糖苷的形式存在。
在此基础上本文进一步对RF-S的免疫调节活性进行了研究,结果表明,RF-S能极显著地促进巨噬细胞、T淋巴细胞和B淋巴细胞的增殖(p<0.01),并呈一定的剂量关系。在RF-S浓度为5μg/mL时,巨噬细胞、T淋巴细胞和B淋巴细胞的增殖率分别为123%、62.66%和 67.05%;并且 T淋巴细胞随着RF-S浓度增加,细胞分裂加快,细胞数增多;B淋巴细胞成团明显增大,数量明显增加。其次,RF-S能够极显著提高巨噬细胞的吞噬能力(p<0.01),当RF-S浓度在5μg/mL时,巨噬细胞的吞噬能力最强。此外,RF-S能极显著刺激巨噬细胞分泌IL-2、IL-10、TNFα和释放NO(p<0.01),显著刺激巨噬细胞分泌 IL-6(p<0.05)。
综上所述,在体外实验中发现,RF-S发挥抗肿瘤作用与调节巨噬细胞和淋巴细胞免疫功能有关。本论文对枝瑚菌多糖结构和免疫调节活性研究的理论研究具有指导意义,对枝瑚菌资源的高值化利用和相关产品开发具有很大价值,但其涉及的有关信号转导通路与其分子机制还需进一步验证。

