甜樱桃采后腐烂病原菌的分离与鉴定
王 楚,张 倩,李 阳,牛 宇,杨 埔,牛 伟,张丽珍,*
(1.山西大学生命科学学院,山西太原 030006;2.山西省农业科学院,农业资源与经济研究所,山西太原 030006;3.山西省农业科学院,山西太原 030031)
甜樱桃(PrunusaviumL.)又名大樱桃、车厘子、西洋樱桃,为蔷薇科(Rosaceae)樱桃属(Cerasus)植物,原产欧洲和西亚,19世纪70年代从欧洲传入中国[1-2]。甜樱桃是中国增长最快的栽培和消费水果之一[3-5]。山西因地处黄土高原东部,土层深厚、光照充足,气候独特、昼夜温差大,生产的樱桃甜度大、口感好,正逐渐发展成为甜樱桃的中晚熟品种的主产地。甜樱桃果实有非常高的营养价值,生物活性成分也极其丰富,包括维生素C、花青素、槲皮素、黄烷-3-醇、黄烷醇和羟基肉桂酸盐等[6],具有较强的抗氧化能力,在预防疾病和维持人体健康方面起着非常重要的作用[7-8]。
新鲜的甜樱桃果实皮薄、柔软多汁、营养丰富,加上采收时气温较高,空气湿度大,为各类病原微生物的生长提供了有利的温度和湿度条件[9]。空气湿度较高容易导致樱桃发生裂果的现象,形成微创口,更容易感染病原菌,采后不耐贮运,据报道每年因微生物侵染引起甜樱桃采后损失高达50%以上[10]。目前国内外对甜樱桃真菌性病害研究尚少,且对病害的防治策略尚不明确。
为明确引起山西地区甜樱桃采后腐烂的病原菌种类,本研究针对产自山西省樱桃种植地的甜樱桃果实在低温贮藏过程中的病原微生物,对其进行分离纯化,在形态学基础上,结合基因序列进行分析,从分子水平上将菌株鉴定到属种,以期为甜樱桃采后贮藏保鲜提供一定的科学依据和理论基础。
1 材料与方法
1.1 材料与仪器
红玛瑙甜樱桃 山西省农科院樱桃种植基地;Tris饱和酚、氯仿 生工生物工程(上海)股份有限公司;异丙醇 国药集团化学试剂有限公司;70%乙醇 天津市化学试剂三厂;Master Mix酶、核酸染色剂 全式金生物技术有限公司;硫酸镁 天津市恒兴化学试剂制造有限公司;蔗糖、硫酸亚铁 天津市风船化学试剂科技有限公司;硝酸钠 天津市光复科技发展有限公司;氯化钾、磷酸氢二钾 天津市天新精细化工开发中心;琼脂粉、PDA粉 北京索莱宝科技有限公司;蛋白胨 北京奥博星生物技术有限责任公司;保鲜盒 台州黄岩捷旺模具有限公司。
BXM-30R不锈钢立式压力蒸汽灭菌、BSP-150生化培养箱 上海博迅实业有限公司;FK-A 组织捣碎机 常州国宇仪器制造有限公司;G50研磨仪 佛山市顺德区冠宇达有限公司;BCM-1000A超净工作台 苏净安泰;OLYMPUSDP73正置荧光显微镜 东京都涉谷区幡之谷生产;Neofuge13台式高速离心机、T960 PCR扩增仪 力康生物医疗科技控股集团;DYCP-31DN电泳仪 北京市六一仪器厂;Ge1DocXR+凝胶成像系统 美国Bio-Rad公司。
1.2 实验方法
1.2.1 甜樱桃的预处理 选择颜色大小一致、无病虫害、无机械损伤的樱桃果实在(0±0.5) ℃预冷24 h后,装入15 cm×10 cm×6 cm的经紫外灯照射过30 min的保鲜盒中封闭保存,每盒300.0 g样品,共30盒样品,贮藏于0 ℃冷库中,贮存30 d左右,取有明显病症的果实分离病原菌。
1.2.2 病原菌的分离纯化 收集在0 ℃冷库中的樱桃病果,用组织分离法进行分离。用75%酒精表面消毒5 s后,用无菌水清洗3次,用灭过菌的镊子撕去樱桃表皮,取其中的病果组织接种于PDA培养基平板中,将平板置于28 ℃生化培养箱中培养,待菌落长出后采用平板划线法分离,后于28 ℃生化培养箱中培养3 d,将获得的菌落纯化多次直至获得单一菌落。将纯化的菌株置于4 ℃冰箱保存备用。
1.2.3 病原菌致病性检测 根据柯赫氏法则[11-13],将分离纯化得到的病原菌回接到健康的樱桃果实上。选取60颗健康樱桃果实并将其在2%的次氯酸钠溶液中浸泡30 s,无菌水漂洗3次,自然风干。用经高压蒸汽灭菌的针在果实赤道部刺3 mm深的伤口,取10 μL浓度为105CFU·mL-1菌悬液接种于刺伤部位,接种后将其置于密封的塑料盒中,并在28 ℃生化培养箱中培养3~5 d,重复3次。每隔24 h观察病斑发展速度与发病程度,选取明显发病果实再次进行病原菌的分离鉴定,判断与所接菌株的菌落形态是否一致,若一致则为采后病原菌。
1.2.4 病原菌的形态学分析
1.2.4.1 病原菌的菌落形态分析 将分离纯化后所得的一定数量病原菌分别接种到PDA培养基中,置于28 ℃生化培养箱培养3~5 d进行形态学观察。
1.2.4.2 病原菌的显微形态分析 将灭过菌的盖玻片以45 ℃角插入察氏培养基内,将菌种用接种环接在盖玻片与培养基相接的沿线上,将平板置于28 ℃生化培养箱中培养,病原真菌YTA培养5~7 d,病原真菌YTB培养10~14 d。用镊子将盖玻片取出,将长势好的一面盖在已滴有1滴乳酸酚棉蓝染液的载玻片上,擦去盖玻片上菌种长势较差的一面,在显微镜下对病原菌菌丝体和分生孢子进行形态观察、拍照[14]。
1.2.5 病原菌分子生物学鉴定 用无菌解剖刀刮取0.1~0.2 g病原真菌YTA和YTB菌丝于1.5 mL离心管中,加入少量的聚乙烯吡咯烷酮(PVP),石英砂和预热的CTAB抽提液用G50研磨仪研磨至匀浆,采用改良的CTAB法[15]提取病原真菌基因组DNA,置于-20 ℃冰箱保存备用。应用真菌核糖体基因转录间隔区通用引物ITS4(5′-TCCTCCGCTTATTGA TATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAA CAAGG-3′),以分离得到的病原菌基因组DNA为模板进行PCR扩增;引物均由金唯智(苏州)有限公司合成。50 μL PCR反应体系:94 ℃变性4 min,94 ℃ 50 s,55 ℃ 1 min,72 ℃ 1 min,共35个循环,72 ℃延伸10 min。扩增产物经0.8%琼脂糖凝胶电泳,在全能成像系统上观察并记录结果。PCR产物送往金唯智(苏州)有限公司测序。
1.2.6 系统发育树的构建 将测序所得的基因序列拼接后,提交到NCBI的GenBank数据库,应用BLAST进行同源序列比对,下载相近的参比序列并利用MEGA6.0软件以NJ邻接法构建系统发育树,分析病原菌与同属其它菌株的亲缘关系,以确定其分类地位。
2 结果与分析
2.1 病害症状及致病性
将从甜樱桃果实发病部位分离出的2株病原菌,编号为YTA和YTB,回接于健康樱桃的刺伤部位进行致病性实验。实验结果表明接种YTA时,接种第4 d时果实出现明显病症,发病率为100%;YTB在第4 d时果实出现病症,发病率为100%;回接后出现的症状与自然条件下发病症状一致(图1)。回接YTA后出现绿色病斑,病斑凹陷,呈现水样状;回接YTB后出现白色病斑,之后果柄处长出白色菌丝,整个果实呈现黑褐色,后期全果腐烂。从甜樱桃发病部位重新分离病原菌,得到的病原菌与所接病原菌形态一致。由此证明YTA和YTB病原菌均是造成山西省甜樱桃采后腐烂的病原菌。

图1 病原菌回接樱桃Fig.1 Sweet cherry fruits inoculated with the pathogens注:图中左侧为病果样品,右侧为病原菌回接结果
2.2 病原菌的形态学分析
2.2.1 菌落形态学分析 将2株病原菌分别接种到PDA培养基中,置于28 ℃生化培养箱培养3~5 d进行形态学观察。YTA菌丝初期为白色,培养3 d左右开始变为灰绿色,菌落相对平坦,质地绒毛状或絮状,在菌落边缘形成一圈浓密白色绒毛,菌落中间呈灰绿色,6~7 d可长满直径为9 cm的PDA培养基,菌落在培养皿背面近于黄色,易于观察(见图2a);YTB菌落疏松、干燥、不透明、不易挑取、质地呈绒毛状、菌丝稀疏其形态类似针状向外辐射,初期为白色后逐渐变为深灰色,产孢量少,培养皿背面呈黑褐色(见图2b)。
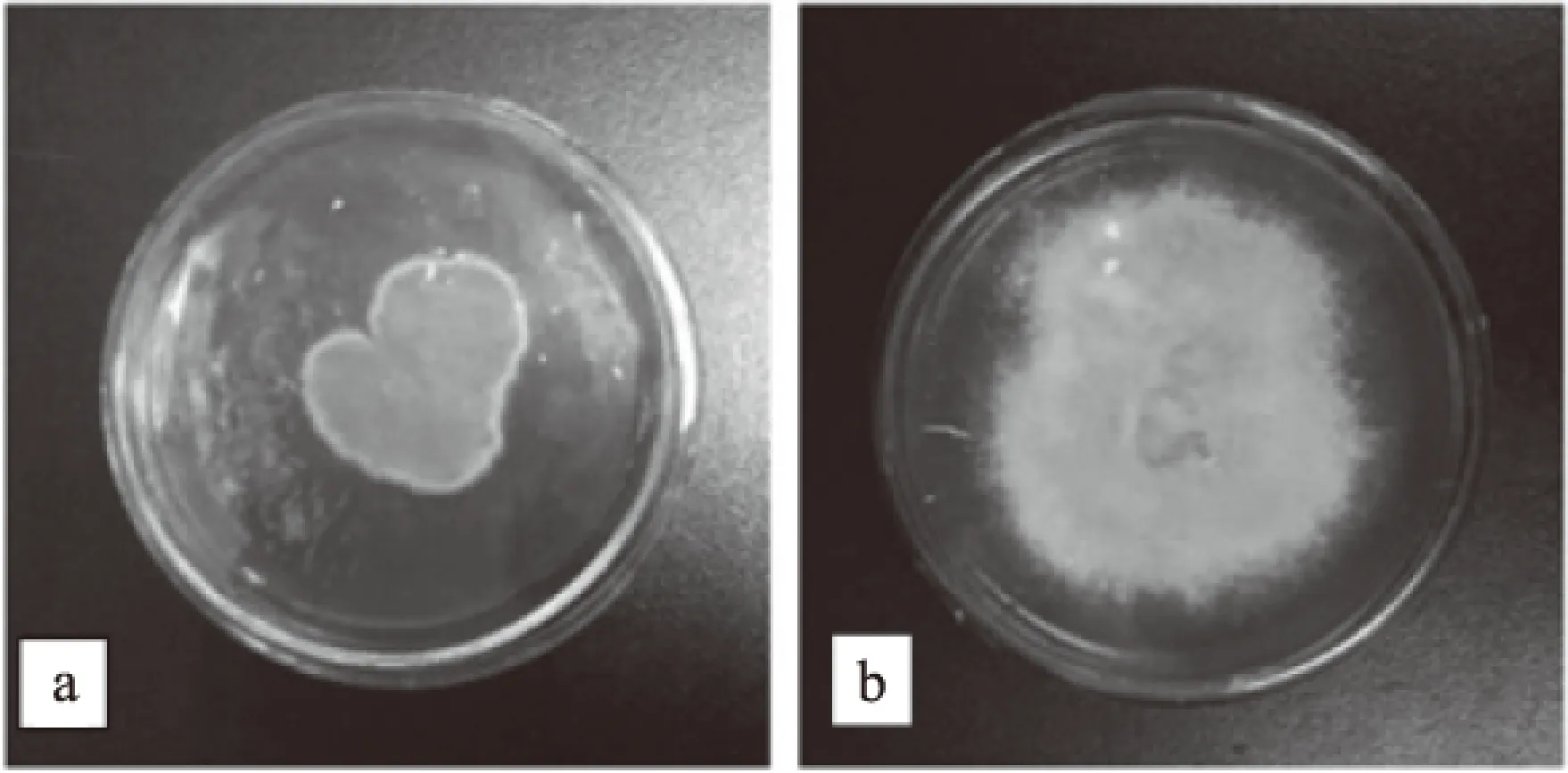
图2 2株病原菌的菌落形态Fig.2 Colony morphology of the two strains pathogens 注:a:YTA;b:YTB。
2.2.2 显微形态分析 将2株病原菌在显微镜下进行显微观察。YTA的分生孢子呈椭圆形,大小均匀(见图3a);在分生孢子梗端连续成串生长,分生孢子链呈圆柱状,分生孢子梗通常单轮生,偶有双轮生或三轮生,无隔膜,幼龄时分生孢子梗呈瓶状(见图3b);成熟时分生孢子梗呈笤帚状,分生孢子大量产生易脱落(见图3c)。YTB的分生孢子呈卵圆形,大小不均一,分生孢子呈灰绿色(见图3d);顶端形成膨大的顶囊(见图3e);菌丝体疏松,成网状,菌丝粗糙有隔膜,分生孢子梗不明显,分生孢子顶生或侧生(见图3f)。
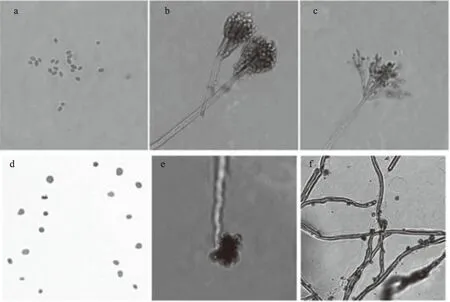
图3 2株病原菌的显微形态(40×)Fig.3 Microscopic morphology of the two strains pathogens(40×)注:a:YTA分生孢子,b:YTA幼龄时分生孢子梗,c:YTA成熟时分生孢子梗;d:YTB分生孢子,e:YTB膨大的顶囊,f:YTB菌丝和分生孢子。
2.3 基因序列分析结果
应用ITS通用引物进行PCR扩增,YTA和YTB菌株分别获得了长度为500 bp左右的清晰条带,电泳结果见图4。将纯化的PCR产物直接测序,分别获得了551和490 bp的序列。
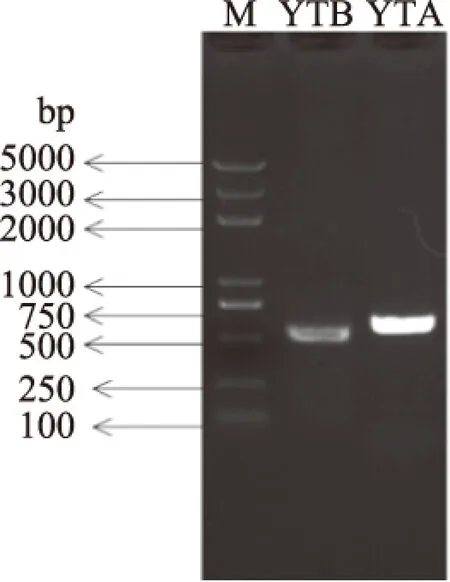
图4 PCR扩增产物凝胶电泳结果Fig.4 Electrophoresis analysis of PCR amplified products注:M:Marker。
2.4 系统发育分析
对2株病原菌进行分子生物学鉴定,将PCR扩增后的产物进行测序,将测序所得的基因序列提交到NCBI的GenBank,应用BLAST进行同源序列比对。病原真菌YTA的ITS序列与GenBank中Penicilliumoxalicum和Penicilliumsimplicissimum有较高的同源性。从GenBank数据库中选取代表青霉属不同种的ITS序列,以爪哇正青霉Eupenicilliumjavanicum(KF313084)作为外群构建系统发育树,结果显示:菌株YTA与亲缘关系较近的草酸青霉(PenicilliumoxalicumDQ123663)聚于同一支(图5)。结合形态学特征,最终将病原真菌YTA鉴定为草酸青霉(Penicilliumoxalicum)。
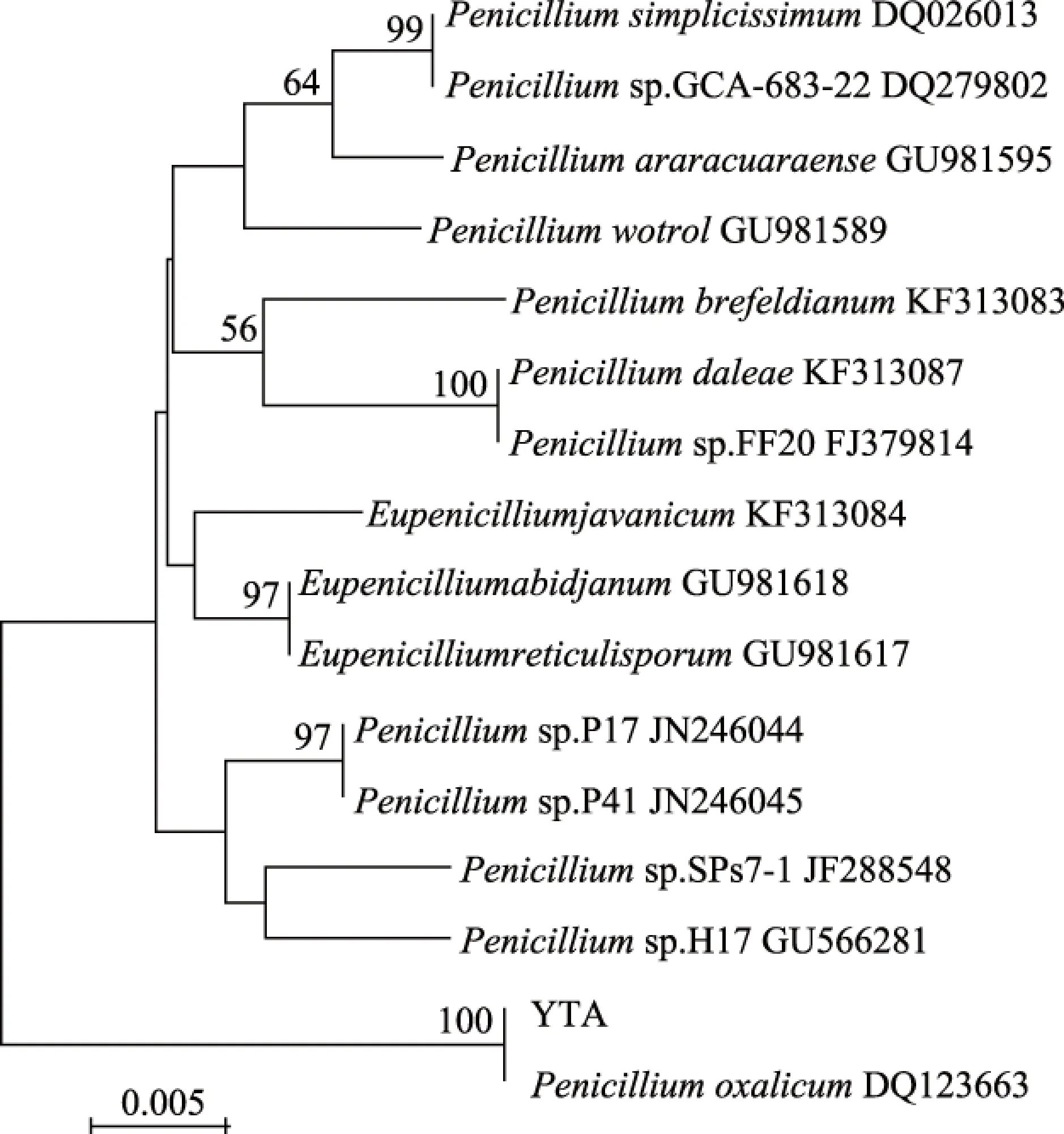
图5 YTA菌株基于rDNA-ITS序列的系统发育树Fig.5 Phylogenetic tree based on the rDNA-ITS sequences of YTA pathogen
病原真菌YTB的ITS序列与GenBank中Botrytiscinerea和Botrytisfabiopsis有比较高的同源性。从GenBank数据库中选取代表葡萄孢属不同种的ITS序列,以果生链核盘菌Moniliniafructicola(EF207421),桃褐腐病菌Monilinialaxa(EF153016)和核盘菌Sclerotiniasclerotiorum(KF878372.1)作为外群构建系统发育树,结果显示:菌株YTB与亲缘关系较近的葡萄孢属(Botrytissp.LeekBC-18FJ169673)聚于同一支(图6)。结合其形态学培养特征,将病原真菌YTB鉴定为葡萄孢属(Botrytissp.)。
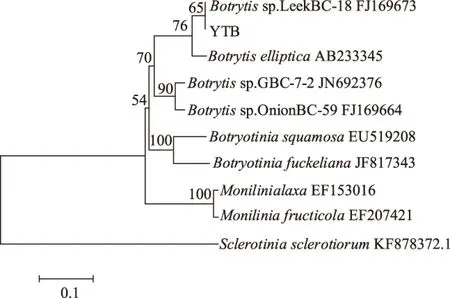
图6 YTB菌株基于rDNA-ITS序列的系统发育树Fig.6 Phylogenetic tree based on the rDNA-ITS sequences of YTB pathogen
3 讨论与结论
目前已报道引起甜樱桃果实采后腐烂的病原微生物主要有青霉属(Penicillium)、链核盘菌属(Monilinia)、链格孢属(Alternaria)、炭疽菌属(Colletotrichum)、葡萄孢属(Botrytis)、曲霉属(Aspergillus)、根霉属(Rhizopus)、枝孢霉属(Cladosporium)、镰刀菌属(Fusarium)、地丝菌属(Geotrichum)、盘长孢属(Gloeosporium)、毛霉属(Mucor)、成团泛菌(Pantoeaagglomerans)等[16-18]。本研究对山西晋中地区低温贮藏过程中甜樱桃的病原菌进行分离纯化与回接,获得了2株真菌YTA和YTB。对2株病原菌YTA和YTB进行分子生物学鉴定,结合其形态学特征,分别鉴定为草酸青霉(Penicilliumoxalicum)、葡萄孢属(Botrytissp.)。
张先富等[19]将草酸青霉作为一种拮抗菌来抑制连作土壤中尖孢镰孢菌生长。本实验中对病原菌YTA进行分离鉴定后进一步进行甜樱桃果实体外致腐性实验,接种病原菌YTA的樱桃果实均发病,且发病症状与低温贮藏过程中症状一致,从发病部位重新分离病原菌,得到的病原菌与所接病原菌形态一致,由此证明草酸青霉(Penicilliumoxalicum)是引起山西省甜樱桃采后腐烂的一种病原真菌。
葡萄孢菌(Botrytiscinerea)是采后甜樱桃果实灰霉病原菌[20-22]。病原菌进行分离鉴定后进一步进行甜樱桃果实体外致腐性实验,结果表明葡萄孢属(Botrytissp.)同样是引起山西省甜樱桃采后腐烂的病原菌。
本次实验与以往研究的引起甜樱桃采后腐烂的病原微生物种类有所差异,究其原因可能是不同病原菌侵入不同品种樱桃组织的途径不同,以及地理环境、生长条件和气候条件等方面的差异,而导致在贮藏过程中引起樱桃腐烂的病原微生物种类存在一定的差异[14]。通过对山西省低温贮藏过程中甜樱桃病原菌的研究,明确了引起甜樱桃采后病原菌的种类,为进一步加强新鲜樱桃运输、贮藏过程中微生物病害防治及今后抑制甜樱桃的腐烂奠定了理论基础。

