茶多酚/直链淀粉复合物的制备及表征
刘华玲,史苗苗,2,周亚萍,闫溢哲,2,胡瑞佳,刘延奇,2,*
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002 2.食品生产与安全河南省协同创新中心,河南郑州 450002)
茶多酚是茶叶中多酚类化合物的总称,是具有多种生物功能的生物活性物质[1]。茶多酚具有抗氧化性、抗癌和抗菌等有益性能,因此,茶多酚作为食品、营养和药品成分引起了广泛的关注[2]。然而,由于茶多酚分子中的羟基非常活泼,对光、热和碱敏感,在制造、储存和消费过程中极易发生氧化、聚合、缩合等反应,失去其抗氧化活性及其他生物学功能,限制了茶多酚在工业中的应用。为解决这一问题,提出利用直链淀粉对茶多酚进行包埋,从而改变茶多酚对光、热、酸碱的敏感度,使茶多酚保持其原有的化学特性和生物活性[3]。
淀粉主要由直链淀粉和支链淀粉组成,直链淀粉主要是由α-1,4糖苷键连接而成的聚合物,在配体的存在下,如二甲基亚砜(DMSO)、碘、溴化钾、氢氧化钾(KOH)、芳香化合物、脂质、脂肪酸和线性醇等[4],直链淀粉发生构象变化,形成具有亲水性表面和疏水性内螺旋孔道左手单螺旋结构的直链淀粉复合物[5]。近几年,淀粉复合物受到越来越多的关注。Seo等[4]研究了直链淀粉-C18脂肪酸复合物的制备与表征。Putseys等[5]研究直链淀粉-脂质复合物的制备。Luo等[6]研究了脱支淀粉-脂酰胆碱复合物的制备与表征。直链淀粉包埋多种分子形成复合物已研究了数十年,近几年才有了直链淀粉作为生物活性物质载体的系统性研究。
本文使用直链淀粉为实验材料,构建茶多酚/直链淀粉复合物。研究了反应时间、茶多酚添加量和结晶温度三个反应参数对复合物的茶多酚包埋效果及相对结晶度的影响。并对结晶结构最佳的茶多酚/直链淀粉复合物进行扫描电子显微镜(SEM)、X-射线衍射(XRD)、红外光谱(IR)分析,进一步研究复合物的结晶结构和表观特征,以期为茶多酚/直链淀粉复合物的开发应用提供理论基础。
1 材料与方法
1.1 材料与仪器
马铃薯淀粉 固原长城淀粉有限公司;茶多酚 上海源叶生物科技有限公司;无水乙醇、正辛醇、盐酸均为分析纯。
SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;LG10-2.4A型高速离心机 北京医用离心机厂;PhilipsXL-3型扫描电子显微镜(SEM) 日本日立公司;BrukerTENSOR27型红外光谱仪(FT-IR)、BrukerD8型X-射线衍射仪(XRD) 德国布鲁克公司。
1.2 实验方法
1.2.1 B型微晶淀粉的制备 参照文献[7],取一定量的马铃薯淀粉,用2.2 mol/L的盐酸配成质量分数为30%的淀粉悬浮液,35 ℃下恒温盐酸酸解3 d,抽滤,用去离子水洗涤4次,再用无水乙醇洗涤3次,收集固体,室温晾干备用。将酸解得到的马铃薯淀粉配成质量分数10%的悬浮液,加热煮沸使其充分糊化,自然冷却到室温,室温下以4000 r/min离心10 min,除去不溶物,上层清液在-18 ℃下冷冻12 h。将冷冻样品在室温下缓慢解冻,当残余有少量冰晶时,及时抽滤,并用冷水洗涤,收集滤饼在室温下晾干即为B型微晶淀粉。
1.2.2 直链淀粉的制备 短直链淀粉-正辛醇复合物的制备参照参考文献[8]。B型微晶淀粉1.0 g溶解于去离子水中配成5%(w/v)的淀粉溶液,置于三口瓶中加热至沸腾。将100 μL的正辛醇溶解在10 mL的无水乙醇中,加入热的淀粉溶液中。混合均匀后,加热回流10 min,随后在结晶温度为60 ℃下将溶液冷至室温,静置结晶完成后,室温下以4000 r/min离心10 min,分离后冷冻干燥,即得V型短直链淀粉-正辛醇复合物。使用无水乙醇以10∶1的量对直链淀粉-正辛醇复合物进行洗涤,室温下4500 r/min离心10 min,重复洗涤离心3次后,除去部分正辛醇,在-50 ℃下冷冻干燥,即得直链淀粉。
1.2.3 茶多酚/直链淀粉复合物的制备 直链淀粉1.0 g溶解于50 mL去离子水中配成2%(w/v)的淀粉悬浮液,加入一定量的茶多酚,混匀后置于恒温水浴锅中在一定温度下搅拌一定时间后,室温下4500 r/min离心10 min,所得沉淀在-50 ℃下冷冻干燥,即得茶多酚/直链淀粉复合物。
1.2.4 不同因子对茶多酚/直链淀粉复合物的影响
1.2.4.1 不同淀粉/茶多酚配比对复合物的影响 固定反应时间为2 h,反应温度为30 ℃,淀粉/茶多酚配比分别为:10∶1、10∶2、10∶3、10∶4、10∶5,探究淀粉/茶多酚配比对复合物制备的影响,每组试验重复3次。
1.2.4.2 反应温度对复合物的影响 固定反应时间为2 h,淀粉/茶多酚配比为10∶3,反应温度分别为:20、30、40、50、60、70 ℃,探究反应温度对复合物制备的影响,每组试验重复3次。
1.2.4.3 反应时间对复合物的影响 固定反应温度为30 ℃,淀粉/茶多酚配比为10∶3,反应时间分别为:0.5、1、2、3、4 h,探究反应时间对复合物制备的影响,每组试验重复3次。
1.2.5 复合物中茶多酚包埋率的测定 通过酒石酸亚铁分光光度法[9]测定茶多酚的包埋率。茶多酚的包埋率是指复合物中的茶多酚的量与加入茶多酚的总量的百分比。它是衡量茶多酚包埋效果的指标,反应有多少茶多酚被直链淀粉所包埋。
以茶多酚为标准,其浓度在0~1 mg/mL质量浓度范围内,符合比尔定律,线性良好。此标准曲线的回归方程为:Y=0.1916X+0.1526(决定系数R2为0.9954,回归效果显著)通过分光光度计测定茶多酚的包埋率。将反应所得的上清液稀释至适当的浓度后,通过分光光度法测定上清液中的茶多酚含量,无水乙醇作空白,吸光度归零,按照酒石酸亚铁法在540 nm下测定上清液中茶多酚的吸光度,测得的吸光度值代入标准曲线,得到茶多酚的包埋率。
其计算公式如下:
式中,m1:复合物的质量;c1:茶多酚的总浓度;c2:分光光度计测得的茶多酚的浓度;V:溶剂的体积;m2:茶多酚的质量;m3:茶多酚与直链淀粉的总质量。
1.2.6 X-射线法分析(XRD) 取样品粉末置于长方形铝片的孔中(孔大小为15 mm×20 mm,厚为115 mm),随后压紧,用BurkerD8型X射线衍射仪测定,所用波长为0.1542 nm的单色Cu-Kα射线。测试条件为:管压3 kV,管流20 mA,扫描速度4 °/min,扫描区域5~60 °,采样步宽0.04°,扫描方式为连续,重复次数为1。相对结晶度的计算,由Komiya和Nara等[10]所利用的XRD谱图计算相对结晶度的方法。
1.2.7 扫描电子显微镜(SEM) 观察样品之前,样品利用喷涂仪对其进行镀金处理,在操作电压为20 kV时,使用扫描电子显微镜(SEM)观测样品的微观形貌。
1.2.8 红外光谱(IR) 称取约2 mg样品研细,加入150 mg干燥KBr,混合均匀并研细、压片,压片厚约0.5 mm,随后将该薄片进行红外扫描。测试条件:扫描波数范围4000~400 cm-1,分辨率4 cm-1,采用DTGS检测器,以空气为空白,扫描3次后取平均值得到样品的红外光谱图。
1.3 数据处理方法
利用Origin 6.1软件进行数据处理,得到复合物中茶多酚包埋效果图、X-射线衍射图谱以及红外光谱,重复三次,茶多酚包埋效果的误差输入最大误差值。
2 结果与分析
2.1 不同因素对茶多酚包埋率的影响
2.1.1 淀粉/茶多酚配比对茶多酚包埋效果的影响 淀粉/茶多酚配比对茶多酚包埋效果的影响如图1所示。随着茶多酚添加量的增加,茶多酚的包埋率也随之增加。淀粉/茶多酚配比从10∶1变化至10∶3时,茶多酚的包埋率从14.02%迅速增加到38.72%。当茶多酚的添加量进一步增加时,茶多酚的包埋率下降。因此,直链淀粉与茶多酚的质量比为10∶3。
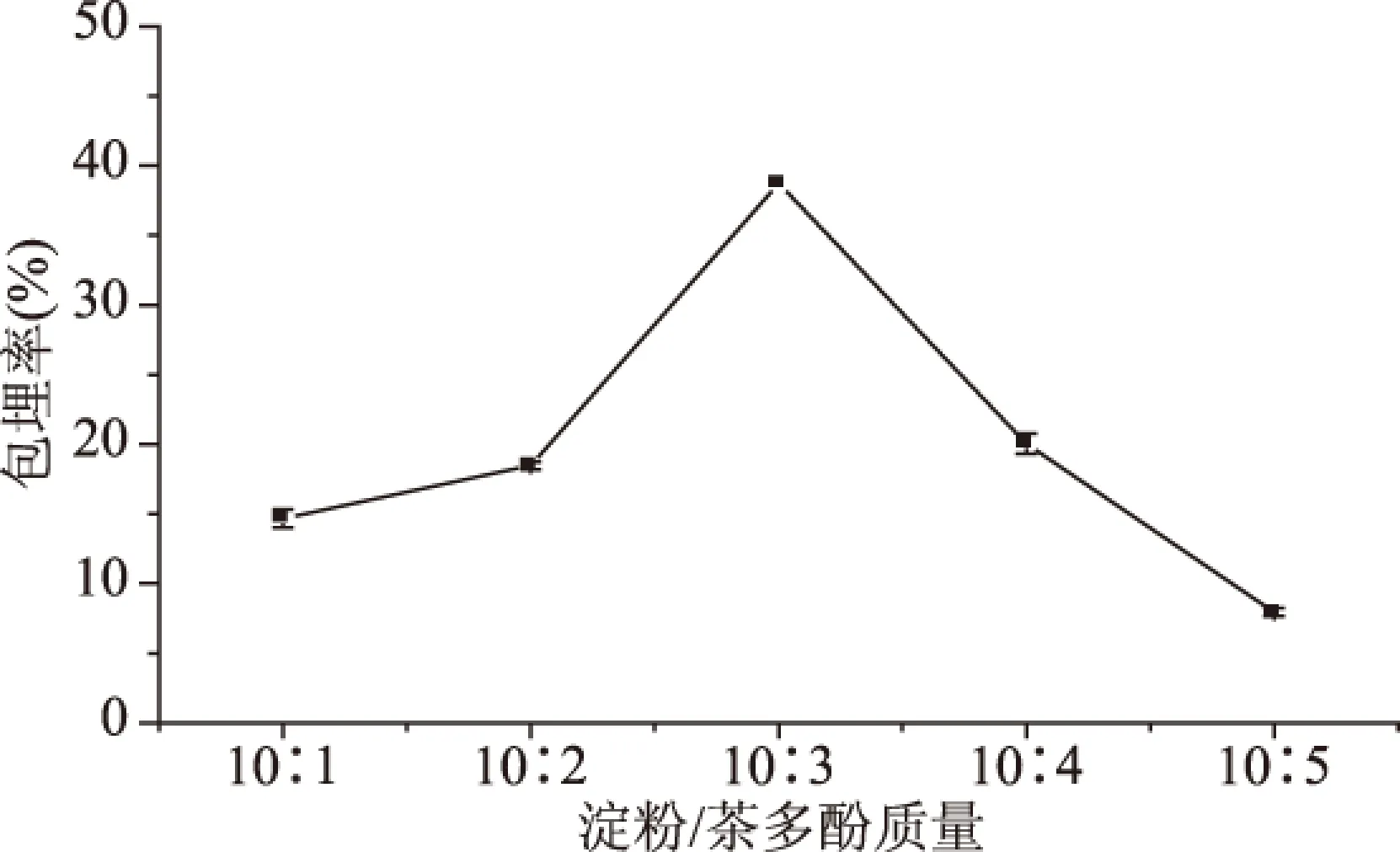
图1 淀粉/茶多酚配比对茶多酚包埋率的影响Fig.1 Effect of proportion of starch and tea polyphenols on tea polyphenols embedding rate
2.1.2 反应温度对茶多酚包埋效果的影响 反应温度对茶多酚包埋效果的影响如图2所示。随着反应温度从20 ℃升高30 ℃,茶多酚的包埋率从34.66%增加到38.72%。当反应温度从30 ℃升高到50 ℃时,茶多酚的包埋率降低。反应温度超过50 ℃时,茶多酚的包埋率下降。因此,直链淀粉与茶多酚的最佳反应温度为30 ℃。

图2 反应温度对茶多酚包埋率的影响Fig.2 Effect of reaction temperature on tea polyphenols embedding rate
2.1.3 反应时间对茶多酚包埋效果的影响 如图3所示,当反应时间从0.5 h增加到1 h时,茶多酚的包埋率从29.39%提高到52.13%。当反应时间低于1 h时,反应时间对直链淀粉包埋茶多酚的包埋率较低,可能原因是低于1 h时,直链淀粉与茶多酚的反应不充分,造成茶多酚的包埋效果不好。然而,当反应时间超过1 h时,直链淀粉与茶多酚充分接触,直链淀粉包埋茶多酚的效率降低,反应时间超过3 h,茶多酚包埋率有增高的趋势。可能是在水溶液中,直链淀粉与茶多酚的包埋是一个动态过程,直链淀粉不断地包埋与释放茶多酚。在反应开始时,茶多酚通过疏水作用进入直链淀粉的疏水腔,当反应时间太长时,部分茶多酚从疏水腔中释放出来。

图3 反应时间对茶多酚包埋率的影响Fig.3 Effect of reaction time on tea polyphenols embedding rate
2.2 不同因素对复合物相对结晶度的影响
2.2.1 淀粉/茶多酚配比对复合物相对结晶度的影响 图4为不同茶多酚配比时,所得复合物的XRD图。从图4中可以看出,5种复合物衍射曲线均在5.90 °、17.16 °、22.47 °和24.03 °左右出现了衍射峰,说明茶多酚与V型淀粉复合形成了B型复合物[7]将图4所得各衍射曲线进行处理,得出各衍射峰强度、面积和结晶度列于表1。

图4 不同淀粉/茶多酚配比时所得复合物的XRD图Fig.4 XRD pattern of the complexes at different proportion of starch and tea polyphenols

表1 不同淀粉/茶多酚配比时所得复合物结晶度和相关衍射数据Table 1 Crystallinity and related diffraction data of complexes at different proportion of starch and tea polyphenols
从表1可以看出,当淀粉/茶多酚配比为10∶1时,此时结晶度最大,为51.92%。茶多酚添加量太多,多余的茶多酚会阻碍茶多酚和淀粉发生复合,因此此时的结晶度明显下降。这表明,加入配体量的多少直接影响着复合物的结晶程度。
2.2.2 反应温度对复合物相对结晶度的影响 从图5中可以看出,5种复合物衍射曲线均在5.90 °、17.16 °、22.37 °和24.03 °左右出现了衍射峰,为B型淀粉的特征衍射峰,表明在上述温度下V型淀粉与茶多酚能形成B型复合物。将图5所得各衍射曲线进行处理,得出各衍射峰强度、面积和结晶度列于表2。

表2 不同反应温度下所得复合物结晶度和相关衍射数据Table 2 Crystallinity and related diffraction data of complexes at different reaction temperature

图5 不同反应温度下所得复合物的XRD图Fig.5 XRD patterns of the complexes at different reaction temperature
从表2可以看出,当反应温度为50 ℃时,此时结晶度最大,为51.33%。随着反应温度的升高,淀粉复合物的结晶温度在50 ℃达到最高。结晶度在30~40 ℃变化不大,但超过50 ℃后明显下降。茶多酚与直链淀粉通过疏水作用形成复合物是吸热过程,反应温度升高有利于复合物的形成[5]。较高的温度也使直链淀粉与茶多酚分子活动增强,使直链淀粉与均匀分散的茶多酚充分结合形成更多的复合物。然而,温度过高易使直链淀粉的螺旋结构破坏,进而影响复合物的形成[11]。
2.2.3 反应时间对复合物相对结晶度的影响 从图6中可以看出,5种复合物衍射曲线均在5.90 °、17.16 °、22.47 °和24.03 °左右出现了衍射峰,说明茶多酚与V型淀粉复合形成了B型复合物。将图6所得各衍射曲线进行处理,得出各衍射峰强度、面积和结晶度列于表3。
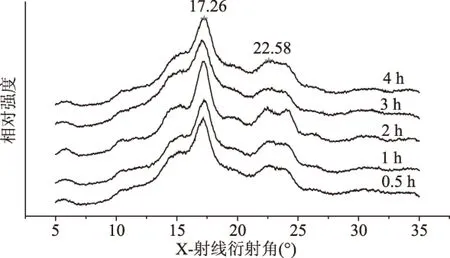
图6 不同反应时间下所得复合物的XRD图Fig.6 XRD patterns of the complexes at different reaction time
由表3可知,随着反应时间的增加,淀粉复合物的结晶度逐渐增加,当反应时间为1 h时,达到最大值。继续增加反应时间,淀粉复合物的结晶度下降,可能是由于搅拌时间过长造成直链淀粉螺旋结构的破坏,与配体结合后为形成较好的晶型。经计算分析,反应时间为1 h时得到的B-型微晶淀粉结晶较好,其结晶度为50.24%。
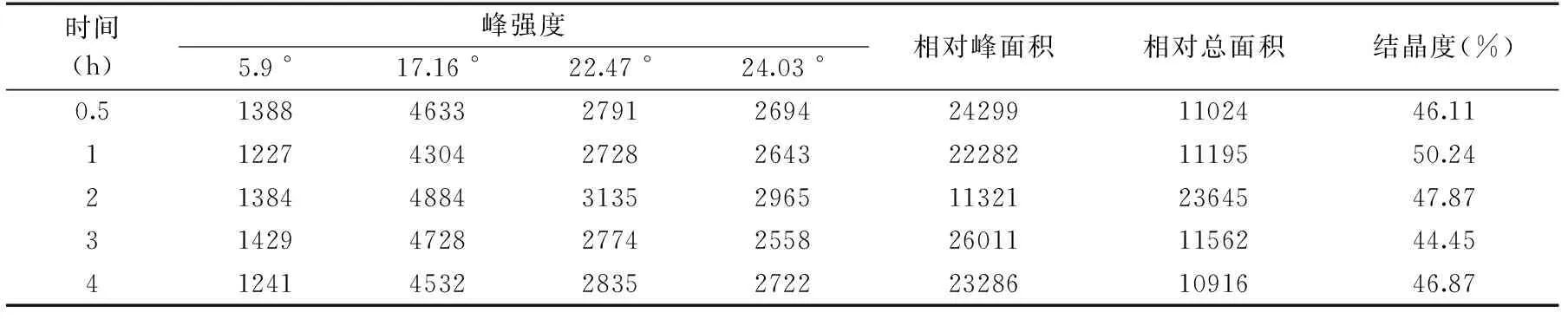
表3 不同反应时间下所得复合物结晶度和相关衍射数据Table 3 Crystallinity and related diffraction data of complexes at different reaction time
2.3 最佳茶多酚包埋效果所得V型复合物的结构表征
上述XRD相对结晶度的计算发现,当直链淀粉与茶多酚配比为10∶1,反应温度为50 ℃,反应时间为1 h时,所得复合物的结晶结构最好,结晶度最高,达到61.51%,根据以上条件制得晶型较好的茶多酚/直链淀粉复合物,采用XRD、SEM和IR对其结构性能进行表征。
2.3.1 X射线衍射仪分析(XRD) 图7是茶多酚、B型马铃薯淀粉、直链淀粉-正辛醇复合物和茶多酚/直链淀粉复合物的X射线衍射图,从图7可以看出茶多酚无明显特征衍射峰,B型马铃薯淀粉在6.06 °、17.51 °、22.59 °、24.40 °处出现特征衍射峰,V型直链淀粉-正辛醇复合物在7.48 °、12.95 °、19.79 °处出现特征衍射峰,这与Liu等[7]、闫溢哲等[8]的结果一致。以水为溶剂制备所得的茶多酚/直链淀粉复合物在5.9 °、17.16 °、22.47 °、24.03 °处出现特征衍射峰,为B型结晶结构,此时的结晶度为61.51%。

图7 X-射线衍射图Fig.7 X-ray diffraction pattern注:a.茶多酚;b.B型淀粉微晶;c.直链淀粉-正辛醇复合物;d.茶多酚/直链淀粉复合物。
2.3.2 扫描电镜分析(SEM) 图8是B型马铃薯淀粉、直链淀粉-正辛醇复合物和茶多酚/直链淀粉复合物的扫描电子显微镜照片。图8a显示,B型马铃薯淀粉微晶颗粒大小较为均匀,球晶颗粒形状比较圆滑,呈圆形,颗粒之间有轻微的黏连。这与淀粉晶体在溶液中冻结以及冰块之间的互相挤压有一定的关系[9]。图8b显示,直链淀粉-正辛醇复合物呈红细胞状结构,直径约为5 μm,表面相对光滑,但是部分晶体中心部分有裂缝。这与淀粉链在晶体表面沉积以及部分淀粉表面结晶不完整有一定的关系[10]。图8c是茶多酚/直链淀粉复合物的扫描电子显微镜照片。从图8中可以看出,复合物呈现无规则颗粒状,表面较为粗糙,部分晶体之间有较多的黏连,这是因为直链淀粉在水溶剂中稳定性较差造成的[11]。

图8 复合物电子扫描显微镜Fig.8 Scanning electron microscope of complexes注:a.B型淀粉微晶(3000×);b.直链淀粉-正辛醇复合物(2000×);c.茶多酚/直链淀粉复合物(1000×)。
2.3.3 红外波谱分析(IR) FT-IR光谱已经广泛应用于分析复合物的形成。图9是茶多酚、B型马铃薯淀粉、直链淀粉-正辛醇复合物和茶多酚/直链淀粉复合物的淀粉红外光谱图。从图中可以看出,B型马铃薯淀粉在3410 cm-1处出现一个宽而强的峰,即淀粉的-OH基的振动吸收峰。直链淀粉-正辛醇复合物在3400 cm-1处出现吸收峰,与B型马铃薯淀粉相比,此峰向低波数方向移动,淀粉的-OH和正辛醇中的-OH基发生缔合、叠加造成的[12]。茶多酚/直链淀粉复合物在3410 cm-1处出现吸收峰,可能是复合物中不含正辛醇,从而不能对淀粉的-OH产生影响。2930 cm-1处出现峰为亚甲基的特征峰,直链淀粉-正辛醇复合物的峰强度和尖锐程度均强于茶多酚/直链淀粉复合物与B型淀粉,这是正辛醇上的亚甲基与淀粉的亚甲基叠加所致。在IR光谱中,由于直链淀粉-正辛醇复合物中淀粉和正辛醇发生叠加,其特征吸收峰的峰强度比茶多酚/直链淀粉复合物与B型淀粉特征吸收峰的峰强度大[13]。
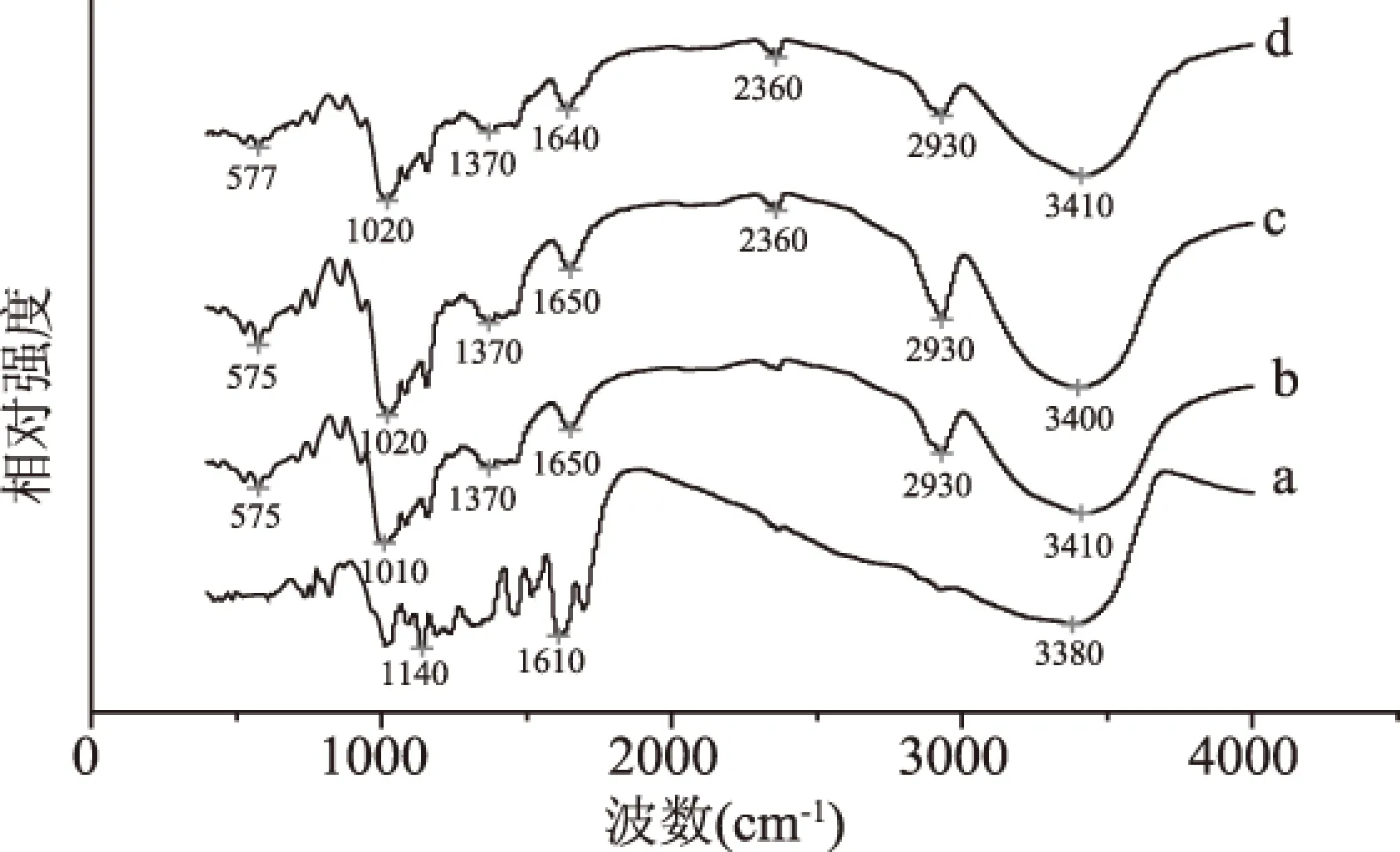
图9 FT-IR 图谱Fig.9 Fourier transform infrared spectroscopy pattern注:a.茶多酚;b.B型淀粉微晶;c.直链淀粉-正辛醇复合物;d.茶多酚/直链淀粉复合物。
3 结论
以直链淀粉为原料,茶多酚为配体,采用控温搅拌方法制备茶多酚/直链淀粉复合物,并对影响茶多酚包埋率的因素进行研究。制备茶多酚/直链淀粉复合物的最佳条件如下:反应时间1 h,直链淀粉与茶多酚比例10∶3,反应温度30 ℃。并对茶多酚包埋率较好的复合物通过XRD、FT-IR和SEM进行结构表征,XRD测试结果显示,茶多酚/直链淀粉复合物在5.9 °、17.16 °、22.47 °和24.03 °处出现特征衍射峰,表明淀粉与茶多酚配体发生络合作用形成了明显的B型结晶,结晶度可达61.51%。茶多酚/直链淀粉复合物制备简单、反应时间短、成本低,因此,其在食品、药品等方面有广阔的应用前景。

