响应面法优化酸提小米多糖工艺与模型诊断
诸爱士,沈林芬,赵军子
(浙江科技学院 生物与化学工程学院,杭州 310023)
小米,又名粟,是一年生草本谷类植物的种子——谷子脱皮后得到的产品,因其颗粒直径大小约为1~2 mm,故名。小米具有很高的营养价值,它不仅可作为食粮供食用,又可酿酒,还可入药,具有清热、清渴,滋阴,补脾肾和肠胃,利小便、治水泻等功效。小米含有丰富的蛋白质、维生素、膳食纤维、脂肪、钙和多酚[1],研究发现,小米还含有多糖[2-3]。多糖是由多个单糖(可相同也可不同)经糖苷键聚合而成的碳水化合物,以天然大分子的形式广泛存在于高等植物、真菌、动物等体内。近年来,多糖已成为研究的热门,见之报道的有关多糖的中文文献就超过十万篇。有研究用不同的方法提取多糖的,如用热水提取茯苓多糖[4],用95%的乙醇提取玉屏风总多糖[5],用碱溶液提取黑木耳多糖[6],用酸溶液提取海带多糖[7]126,用CO2超临界萃取绵马贯众多糖[8],用纤维素酶辅助提取锦葵多糖[9],用微波辅助从肉桂皮中提取多糖[10],用超声波辅助从佛手瓜中提取多糖[11]171;也有用多重手段协同辅助提取的,如超声协同酶辅助提取芦蒿多糖[12],超声辅助酸液提取薏苡仁多糖[13],超声辅助碱液提取沁洲黄小米多糖[14],表面活性剂协同酶解提取荔枝核多糖[15],等等。还有研究多糖功效的,如黑木耳多糖具有降血脂的功能[6],贯叶连翘多糖具有抗氧化和抗菌作用[16],茶籽多糖具有清除羟自由基、DPPH自由基、超氧阴离子自由基、亚硝酸盐的效果及还原能力[17],马齿苋多糖具有抗肿瘤的功效以及能提高免疫力[18],苦丁茶多糖具有降血糖的功效[19],山芝麻多糖能抑制α-葡萄糖苷酶的活性[20],乌贼生殖腺多糖有吸湿保湿的性能[21],黑木耳多糖能使大豆蛋白的乳化活性和乳化稳定性有明显改善[22],兰坪被毛孢粗多糖有延缓衰老的功效[23],等等。小米多糖的热水提取[2]和碱液提取[3,14]已见报道,但用酸溶液提取小米多糖尚未见报道。酸能使多糖的糖苷键断裂而获得更多的单糖和低聚糖[7]126,同时用酸溶液提取多糖可使其收率和纯度得到提高,且所得多糖的生物活性较高[24]54,但对酸的摩尔浓度有一定要求。为此,研究了小米多糖的酸溶液提取,先单因素考察了酸摩尔浓度(盐酸水溶液,mol/L)、液固质量比(去离子水与小米质量比)、提取时间(h)及提取温度(℃)等对多糖收率(mg/g)的影响;进一步采用4因素3水平的Box-Behnken设计响应面法优化了提取工艺条件,使多糖的收率更高,并对建立的模型进行了分析评价。
1 材料与方法
1.1 材料、试剂及仪器
试验材料:小米,购于杭州物美超市,产地辽宁省朝阳市。
试验药剂:葡萄糖(分析纯,天津市致远化学试剂有限公司),硫酸(分析纯,上海凌峰化学试剂有限公司),苯酚(分析纯,南京化学试剂股份有限公司),盐酸(工业品,江苏常熟市恒宏氟化工科技有限公司)。
试验仪器:DHG9053型智能鼓风干燥箱(浙江杭州蓝天仪器有限公司),FA2004B型电子分析天平(上海圣科仪器设备有限公司),DKS14型电热恒温水浴锅(浙江嘉兴市中新医疗仪器有限公司),800电动离心机(上海梅香仪器有限公司),WFJ型可见分光光度计(尤尼柯(上海)仪器有限公司)。
1.2 试验方法
1.2.1 小米的预处理
在干燥箱中于50 ℃干燥恒重,称重分包待用。
1.2.2 小米多糖提取
取5.0 g干燥的小米装入500 mL三口烧瓶,按需要考察的液固质量比(10.0、15.0、20.0、25.0、30.0)加入待考察摩尔浓度(2.0、2.2、2.4、2.6、2.8 mol/L)的盐酸水溶液,将烧瓶固定在设定好需要考察的提取温度(50.0、60.0、70.0、80.0、90.0 ℃)的恒温水浴锅中提取至需要考察的时间(0.5、1.0、1.5、2.0、2.5 h),提取过程结束后迅速取出烧瓶,倒出混合料液,用少量水清洗烧瓶,合并后测量其总体积,取适量提取液装入离心管放入离心机,在2 000 r/min下离心10 min,移取上层清液,按下述多糖质量浓度测量方法测定提取液中的多糖质量浓度,并计算出多糖收率。
1.2.3 多糖质量浓度测量及收率计算
多糖的质量浓度按文献[2,7]所述的硫酸-苯酚法,通过测定溶液吸光度再经换算而得到。小米多糖的提取收率按式(1)进行计算:
(1)
式(1)中:Y为小米多糖提取收率,mg/g;X为提取液中多糖的质量浓度,mg/mL;V为提取液总体积,mL;M为每次提取试验小米投料量,g。
1.2.4 试验设计
单因素考察:整颗小米投料,料液不搅拌,提取1次,分别对酸摩尔浓度、液固质量比、提取时间、提取温度等4个因素进行考察,观察其对小米多糖收率的影响。
响应面优化设计:依据单因素考察结果,以上述4个因素为自变量,以收率为响应值,采用Box-Behnken设计进行4因素3水平试验,完整的试验设计由29个试验点(包括中心点的5个重复试验)组成,试验随机进行,得到的试验数据用二次非线性多项式进行拟合,并且得到回归系数。二次非线性多项式模型见式(2):
(2)
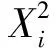
1.2.5 统计及分析方法
试验设计中的自变量和对应获得的响应值采用Design-Expert 8.0.6.1程序进行非线性多项回归和分析。多项式模型的回归质量采用方程的决定系数R2评价,回归系数的显著性采用F检验和p值判断。当p<0.05时,差异显著。
2 结果与讨论

图1 酸摩尔浓度对多糖收率的影响Fig.1 Effects of molar concentration of acid on extraction yield of polysaccharides
2.1 单因素考察
2.1.1 酸摩尔浓度对收率的影响

图2 液固质量比对多糖收率的影响Fig.2 Effects of liquid-solid mass ratio on extraction yield of polysaccharides
酸能促进消除高聚物分子细胞壁间的物理和化学作用,有利于破壁,从而在相同的提取时间内使更多的多糖从细胞中扩散到提取液中,使多糖收率提高;但提取液的酸摩尔浓度过高会发生多糖的酸催化水解,这反而会减小多糖收率。在液固质量比20.0、提取时间1.0 h和提取温度60.0 ℃的条件下,考察了提取液酸摩尔浓度分别为2.0、2.2、2.4、2.6、2.8 mol/L时对多糖收率的影响,结果见图1。由图1可看出,酸摩尔浓度从2.0 mol/L增大到2.4 mol/L,多糖收率大幅度增加,但继续升高提取液的酸摩尔浓度,所得多糖收率反而有明显的下降。收率最大值出现在酸摩尔浓度2.4 mol/L时,以下试验酸摩尔浓度采用2.4 mol/L。
2.1.2 液固质量比对收率的影响
不同的液固质量比可明显影响多糖收率(图2),这是提取过程中的传质推动力(溶质在提取液与物料间的质量分数之差)及分子扩散传递阻力(溶液黏度等)随液固质量比变化所致。增加液固质量比可降低溶液中多糖的质量分数,减小黏度,从而增大推动力,提高传质速度,相同时间内增加多糖收率。但当液固质量比增大到一定程度后,该效果就不再明显,反而过高的液固质量比会增加提取后的操作成本,也会因后续操作时间的延长导致多糖损失而使收率有所降低。在酸摩尔浓度2.4 mol/L、提取时间1.0 h和提取温度60.0 ℃的条件下,考察了液固质量比分别为10.0、15.0、20.0、25.0、30.0时对多糖收率的影响(图2)。由图2可看出,当液固质量比从10.0增加到20.0时,多糖收率明显提高,但继续升高液固质量比,多糖收率却明显减少。收率最大值出现在液固质量比20.0时,因此,以下试验液固质量比采用20.0。

图3 提取时间对多糖收率的影响Fig.3 Effects of extraction time on extraction yield of polysaccharides
2.1.3 提取时间对收率的影响
提取液渗入小米细胞内,细胞的破壁及多糖分子借助提取液从物料内传递到提取液中需要一定的时间,因此提取时间也是影响多糖收率的一个因素。时间不足,则多糖还没有尽可能多地被提取,使收率不高;但时间过长,又会使已经提取到液相中的多糖在酸性环境下受温度的影响发生降解,从而导致多糖收率降低。在酸摩尔浓度2.4 mol/L、液固质量比20.0和提取温度60.0 ℃的条件下,考察了提取时间分别为0.5、1.0、1.5、2.0、2.5 h时对多糖收率的影响,结果见图3。由图3可知,当提取时间从0.5 h延长到1.0 h,多糖收率明显提高,但继续延长提取时间,多糖收率反而减少。收率最大值出现在提取时间1.0 h时,因此以下试验提取时间采用1.0 h。
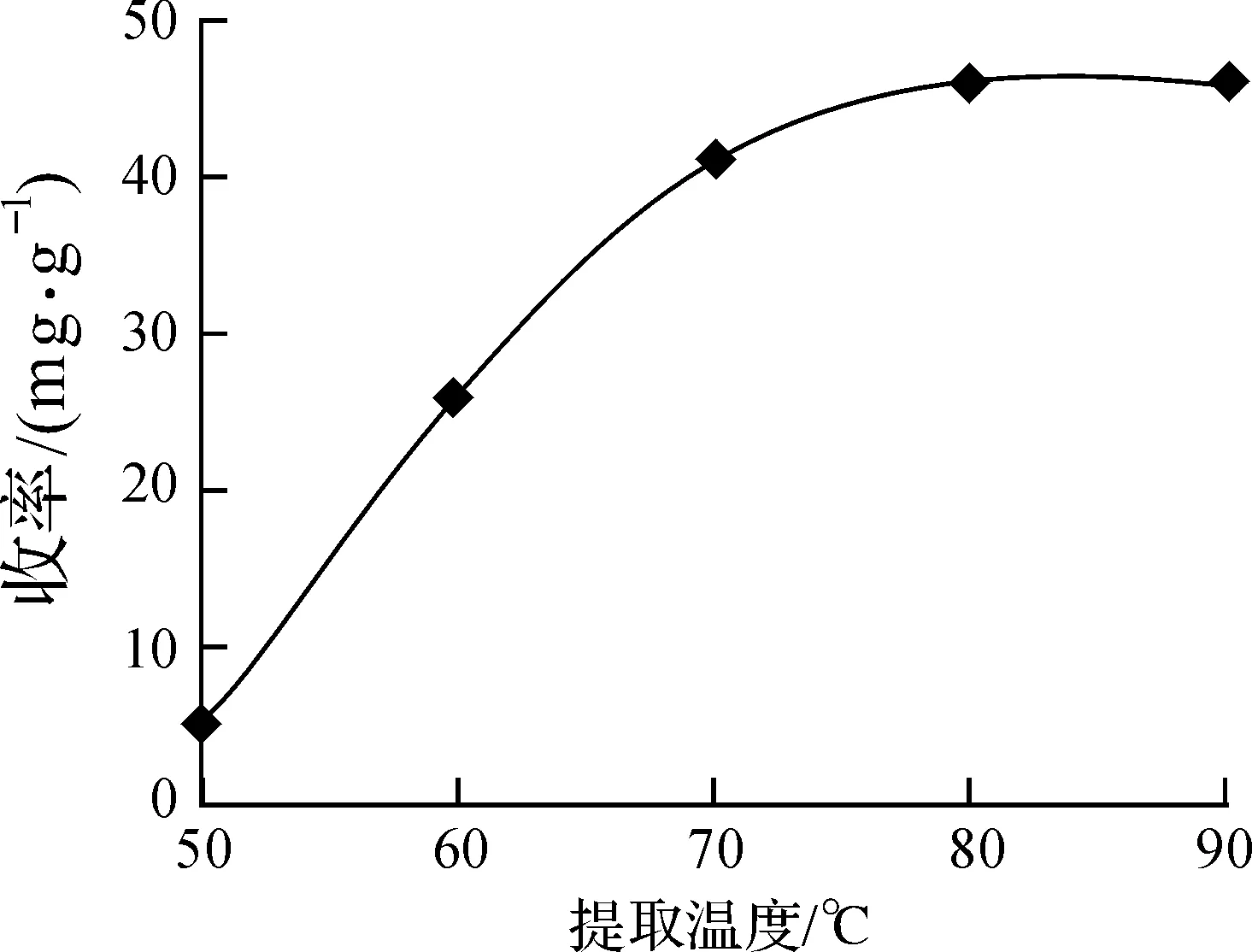
图4 提取温度对多糖收率的影响Fig.4 Effects of extraction temperature on extraction yield of polysaccharides
2.1.4 提取温度对收率的影响
温度的高低会影响到溶液的黏度和分子扩散系数的大小。温度高则溶液黏度降低和分子扩散系数增大,能加快传递速度,有利于传质,相同时间内使多糖收率增加;温度低则溶液黏度高,使得传质阻力大,传递速度小,同时分子扩散系数小,也不利于传质,多糖收率就低;但过高的温度会使提取到液体中的多糖分解,导致收率减少。在酸摩尔浓度2.4 mol/L、液固质量比20.0和提取时间1.0 h的条件下,考察了提取温度分别为50.0、60.0、70.0、80.0、90.0 ℃时对多糖收率的影响,结果见图4。由图4可知,提取温度从50.0 ℃升高到70.0 ℃,多糖收率有显著的提升,但继续升高温度,多糖收率有增加但增速不明显。考虑到能耗及多糖在高温下的降解,提取温度以80.0 ℃为宜。
2.2 响应面法优化提取工艺
2.2.1 试验设计与结果
单因素试验结果表明,提取的合适条件是酸摩尔浓度2.4 mol/L、液固质量比20.0、提取时间1.0 h和提取温度80.0 ℃,多糖收率达到了45.74 mg/g,比热水提取小米多糖有明显增加,且能减少提取时间[2]。但单因素试验条件的选择是点,而最佳的条件不一定正好落在所选择的点上。因此,以单因素试验考察的4个因素为自变量,以所得的各因素最佳水平为中心,以多糖收率为响应值Y(mg/g),采用4因素3水平的Box-Behnken试验设计响应面法,对提取条件和收率作进一步的优化。试验设计和所得结果列于表1。
2.2.2 模型拟合
由Design-Expert 8.0.6.1软件对表1数据进行处理,得到了小米多糖收率与各因素实际值间关系的四元二次多项式数学表达式:

(3)

表1 试验设计和提取结果Table 1 Experimental design and extraction yield
2.2.3 模型方差分析与诊断
模型的方差分析结果见表2。
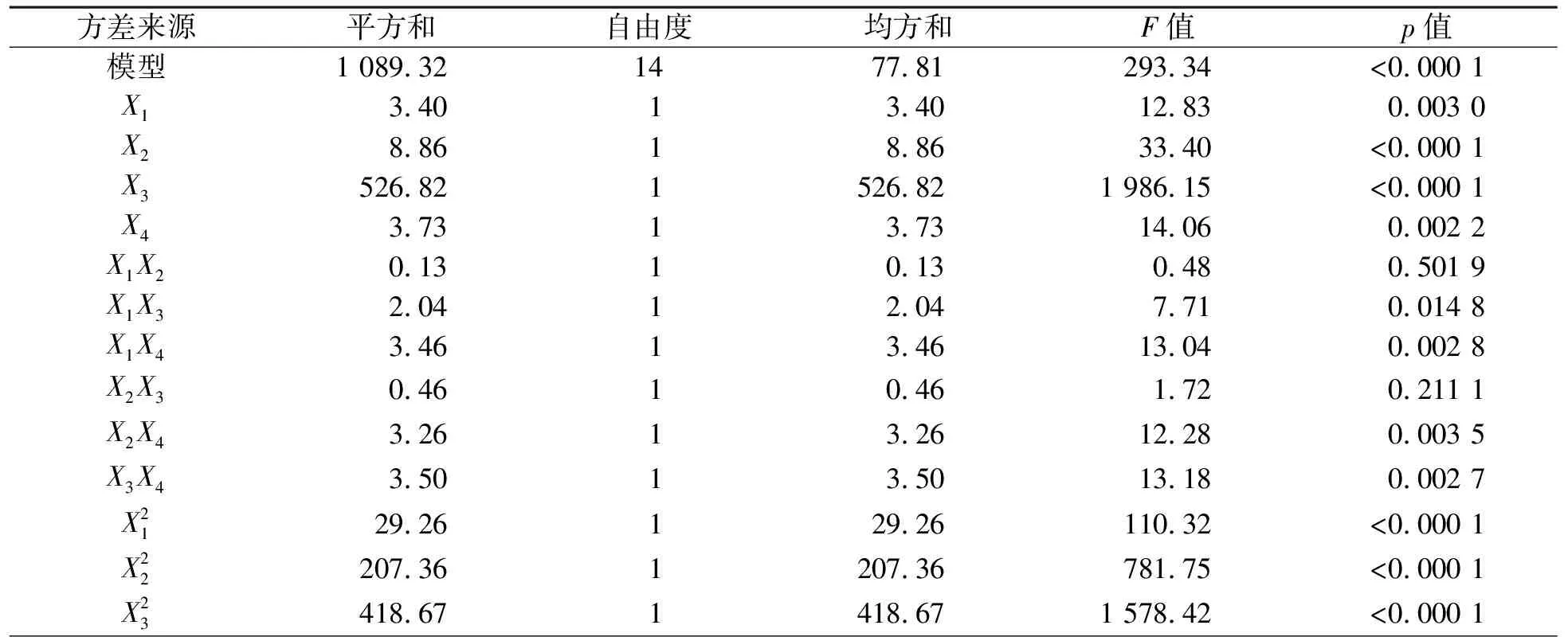
表2 回归模型方差分析Table 2 Analysis of variance for regression equation

表2(续)
由表2可知,模型具有F=293.34、p<0.000 1、R2=0.996 6与Adj.R2=0.993 2等这些数值,这说明获得的二次非线性多项式数学模型与试验数据间的拟合度较高,该模型能有效地描述多糖收率与各因素间的关系。失拟项p>0.05,不显著。从F值可以看出4个因素均对收率有非常显著的影响,其强弱排序是提取时间>液固质量比>提取温度>酸摩尔浓度;因素间的4项交互项与各因素的平方项均有非常显著的影响,这说明响应值与因素间不是简单的一次关系;这些与单因素考察所得结果基本上一致。同时可从软件中导出模型的诊断图(图5)。

图5 模型充分性诊断Fig.5 Diagnostic plots for model adequacy
由图5(a)可知预测值与试验实际值的对应关系,所有的点非常接近45°线,说明预测值非常接近试验值,该模型成功地表达了过程变量与响应值之间的相关性。图5(b)显示了内部学生化残差的正态分布概率,当点的分布相当接近一条直线时,说明方差没有丝毫的偏差。图5(c)显示了内部学生化残差与运行号的点分布毫无规律,并均在范围内。图5(d)显示所有的杠杆值均小于1,说明在模型中没有异常值或有意想不到的错误。图5(e)显示的是不同试验点回归系数的差异,且均在范围内,结果显示在所有的对任何一个回归系数的观测中没有不恰当的影响。图5(f)中的考克斯距离值均在确定的范围内,故没有强有力的证据证明在试验数据中有影响的观测值。因此,在模型的分析诊断中没有发现有明显的问题,并且表明所开发的模型具有较高的准确性[25]。
2.2.4 优化值与响应面
运行Design-Expert 8.0.6.1程序,可得到多糖收率有最大值的提取条件组合是:酸摩尔浓度2.4 mol/L、液固质量比20.3、提取时间1.2 h、提取温度80.2 ℃,预测收率为47.13 mg/g。将其中两个因素固定于中心值,另外两个因素间关系的3D图可以从软件中导出,见图6。

图6 不同因素组合对多糖收率的影响Fig.6 Effects of different combined conditions on polysaccharides yield
图6中,若立面上因素的边线平坦则该因素对多糖收率的影响弱,边线陡则影响强[11]175;等高线图形接近圆形则交互影响小,接近椭圆形则交互影响强[26]。通过对图6中的6个图形比较可以发现,各因素对响应值的影响强弱顺序是:提取时间>液固质量比>提取温度>酸摩尔浓度;各因素组合的等高线图形均呈现出椭圆形,说明因素两两之间有交互影响。
2.2.5 验证试验
在酸摩尔浓度2.4 mol/L、液固质量比20.3、提取时间1.2 h、提取温度80.2 ℃条件下提取多糖,平行试验3次,获得多糖的平均实际收率为46.26 mg/g(n=3,RSD=5.8‰),与模型预测值47.13 mg/g基本上一致,这表明拟合得到的二次非线性多项式数学模型能用来准确预测小米多糖提取收率。
3 结 语
综上所述,本文研究了在酸性环境下从小米中提取多糖的特性,单因素对多糖提取收率的影响趋势与文献[24]56报道的结果一致;采用响应面法对提取工艺进行优化使多糖的收率最大化,并用统计方法来识别和量化变量对多糖收率的影响。确定最优提取条件如下:酸摩尔浓度2.4 mol/L、液固质量比20.3、提取时间1.2 h与提取温度80.2 ℃。在最优条件下,模型预测的多糖最高收率可达到47.13 mg/g,试验实际的收率为46.26 mg/g,两者吻合;响应面图和方差分析表明,各因素对响应值(多糖收率)有非常显著的影响;模型的方差分析和诊断表明所得模型与试验结果的拟合高度一致。

