穿山龙总皂苷对臭氧诱导的小鼠气道高反应性和IL-17A表达的影响*
王爱利,王悦,郭佳,刘磊,李晶晶,邓林红△
(1.常州大学 生物医学工程与健康科学研究院暨常州市呼吸医学工程重点实验室,常州 213164;2.常州大学 制药与生命科学学院/护理学院,常州 213164)
1 引 言
气道高反应性(airway hyperresponsiveness,AHR)是哮喘的重要病理生理学特征[1]。目前β2受体激动剂是降低AHR的最有效药物,但停药后常会引起AHR复发,且部分哮喘患者会产生抗药性而使治疗失效,故有必要寻求其它能有效缓解AHR的替代药物。穿山龙总皂苷为植物穿山龙薯蓣根茎的提取物,已知其具有调节免疫、改善心血管功能、镇咳、祛痰、平喘等多种药理作用[2]。近期有研究报道穿山龙总皂苷可抑制哮喘模型动物的气道炎症反应[3]。例如,在哮喘患者的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、血清、痰液及肺组织中发现炎症因子白介素-17A(interleukin-17A,IL-17A)均升高,其水平与哮喘严重程度相关[4];哮喘患者高表达的IL-17A可作用于上皮下的成纤维细胞和平滑肌细胞使之增殖,诱导气道重塑,加重AHR[5];而穿山龙总皂苷则能通过抑制IL-17A的作用抑制炎症反应[6]。但目前对其是否可缓解AHR未见有研究。因此,本研究采用臭氧(ozone, O3)应激小鼠,以分别建立急性、亚急性AHR模型,进而观察穿山龙总皂苷对小鼠AHR模型中气道阻力的影响以及IL-17A的相关变化,初步探讨穿山龙总皂苷通过降低IL-17A水平而抑制AHR的作用机制,为寻找治疗AHR的中草药提供新的思路。
2 材料和方法
2.1 试剂与动物
2.1.1实验动物 选取SPF级雄性Balb/c小鼠30只,6~8周龄,体重20±2 g,由常州卡文斯动物有限公司提供,动物合格证号: No. SCXK-(JS)-2016-0010。
2.1.2实验试剂及仪器 穿山龙总皂苷(南京普怡生物);戊巴比妥钠(德国Merck);小鼠IL-17A ELISA试剂盒(武汉Proteintech);蛋白定量试剂盒(上海BIO-RAD);穿山龙总皂苷及醋酸泼尼松以含0.01% 吐温80为溶媒的0.9% NaCl(生理盐水)做溶剂当日配制。小动物肺功能检测仪(加拿大SCIREQ);臭氧发生器(北京力天);酶标仪(美国TECAN)。
2.2 O3诱导急性、亚急性AHR小鼠模型
2.2.1急性AHR小鼠模型 小鼠随机分成6组:正常对照组、O3应激组、穿山龙总皂苷治疗组与醋酸泼尼松治疗组,其中穿山龙总皂苷治疗组分为高、中、低剂量3组,高、中、低剂量按小鼠体重计算分别对应为80、40、20 mg/kg,醋酸泼尼松治疗组为阳性对照,剂量按小鼠体重计算为10 mg/kg。除正常组外,各组均接受臭氧应激。方法为将小鼠放置在透明塑料箱内,利用空气泵产生空气,臭氧发生器产生臭氧,臭氧与新鲜空气在真空泵作用下混合,并通过插入透明塑料箱内的臭氧浓度监测仪实时监测箱内臭氧浓度,根据臭氧浓度监测仪显示的臭氧浓度调节空气流量阀门使箱内臭氧浓度维持在1.9~2.1 ppm范围内,以下均标记为2 ppm[7],急性AHR模型为臭氧应激组小鼠当天口鼻吸入2 ppm的臭氧一次性3 h。
2.2.2亚急性AHR小鼠模型 动物分组与实验方法同上,但臭氧应激组小鼠每天上午定时口鼻吸入2 ppm 臭氧3 h,每隔1天1次,共3次。
2.2.3动物给药 臭氧应激24 h后,治疗组分别雾化吸入穿山龙总皂苷80、40、20 mg/kg剂量,阳性对照组雾化吸入醋酸泼尼松混悬液10 mg/kg,空白对照组雾化吸入生理盐水[6]。各组均给药30 min,雾化频率为每隔半小时1次共3 次。所有实验组均在末次激发后24 h,进行气道阻力及气道炎症检测。
2.3 小鼠气道阻力检测
小鼠用戊巴比妥钠(60 mg/kg)经腹腔注射、气管切开后,连接FlexiVent小动物肺功能仪检测气道阻力(Rrs),待呼吸平稳后,向雾化器内加入50 μL生理盐水(基线)及1.56、3.125、6.25、12.5、25、50、100 mg/mL浓度梯度的乙酰甲胆碱(Methacholine, Mch),每个浓度测定3 min记录12次Rrs峰值并取其平均值计算肺阻力[8]。
2.4 肺泡灌洗液(bronchoalveolar lavage fluid, BALF)细胞总数及分类计数
通过留置针向小鼠肺内注入0.5 mL 4℃预冷的生理盐水,重复此操作3次,回收率达到80 %,于12 000 g,4℃离心10 min,收集上清液存于-80℃备用。细胞沉淀用100 μL生理盐水重悬,取10 μL计细胞总数,将剩余的细胞悬液涂片、行瑞氏-吉姆萨染色,在光镜下计算细胞总数及分类计数。
2.5 BALF中IL-17A的检测
用生理盐水分3次通过插入的留置针灌入支气管肺泡内,然后回收,离心,收集上清液用于检测炎症因子IL-17A的水平,操作步骤按照小鼠的IL-17A ELISA试剂盒说明书进行,采用酶标仪450 nm 波长下检测OD 值。
2.6 肺组织匀浆液中总蛋白及IL-17A的检测
小鼠被麻醉开胸取出肺组织,制备10%肺组织匀浆液。于12 000 g,4℃下离心20 min,上清液中总蛋白浓度用双茴香宁酸(bicinchonininc acid,BCA)法蛋白浓度定量试剂盒测定,按ELISA试剂盒说明书测定IL-17A水平。根据组织匀浆总蛋白浓度计算出每100 mg肺组织炎症因子浓度,炎症因子浓度(pg/100 mg肺组织)=实测值(pg/mL)/肺组织重量×100 mg/总蛋白浓度(mg/mL),炎症因子的表达方法均为ELISA实测结果与100 mg肺组织匀浆总蛋白的比值[9]。
2.7 统计分析
实验数据采用平均值±标准差(±SD)表示,用GraphPad Prism 6软件进行统计学分析,两组以上比较应用单因素方差分析,组间差异采用t检验,p<0.05有统计学意义。
3 结果
3.1 臭氧诱导小鼠急性、亚急性AHR模型的建立及表征
3.1.1臭氧诱导AHR模型小鼠气道阻力变化 由图1可见,急性、亚急性模型臭氧组小鼠气道阻力值均随着Mch剂量的增加而呈现上升趋势,当Mch刺激浓度增加到12.5 mg/mL后,与正常对照组相比,急性、亚急性臭氧组气道阻力值均显著性增加(**p<0.01)。

图1臭氧诱导AHR模型随乙酰甲胆碱刺激的变化(急性(A)、亚急性(B);n=5, **p<0.01; *p<0.05vs正常组)
Fig1Changeofairwayresistanceinozone-inducedAHRmodelmiceinresponsetomethacholine(Mch)stimulation(acute(A)、subacute(B) ;n=5, **p<0.01; *p<0.05vscontrol)
3.1.2臭氧诱导AHR模型小鼠BALF细胞总数及分类计数的变化 由图2可见,臭氧组小鼠气道炎症较对照组明显增加,正常小鼠BALF中主要表现为淋巴细胞和巨噬细胞增多,而中性粒细胞含量甚少,与对照组相比,急性、亚急性模型臭氧组小鼠BALF中细胞总数、巨噬细胞数及嗜中性粒细胞数均明显升高(**p<0.01),以上结果表明本研究成功建立了急性、亚急性AHR模型。

图2臭氧诱导AHR模型小鼠肺泡灌洗液中细胞总数及分类计数(急性(A)、亚急性(B);Eos:嗜酸性细胞;Neu:中性粒细胞;Lym:淋巴细胞;Mac:巨噬细胞;n=5, **p<0.01; *p<0.05vs正常组)
Fig2MeannumbersoftotalcellsanddifferentialcellsrecoveredfromBALFinozone-inducedAHRmodelmice(acute(A)、subacute(B);Eos:Eosinophils;Neu:Neutrophils;Lym:Lymphocytes;Mac:Macrophages;n=5, **p<0.01; *p<0.05vscontrol)
3.2 穿山龙总皂苷对AHR模型小鼠气道阻力的影响
图3 A、B显示穿山龙总皂苷对臭氧诱导的急性、亚急性AHR模型小鼠气道阻力的影响结果,可见随着Mch激发浓度的增加,各组气道阻力值均逐渐增加,但与生理盐水组相比,雾化吸入浓度梯度的穿山龙总皂苷药物后气道阻力值均有所降低,高浓度的穿山龙总皂苷降低气道阻力的效果更加明显。

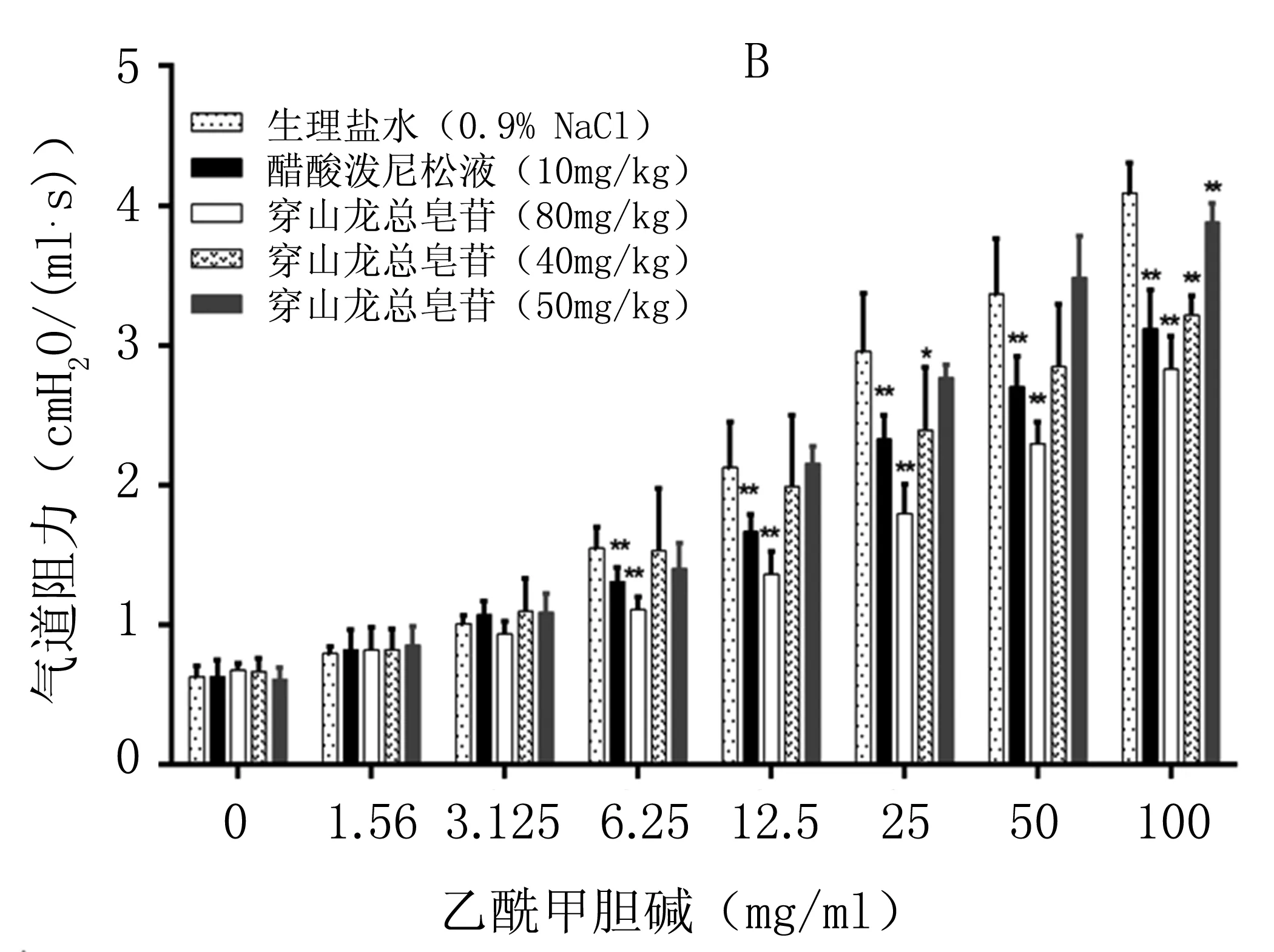
图3穿山龙总皂苷对臭氧诱导AHR模型小鼠气道阻力的影响(急性(A)、亚急性(B);n=5, **p<0.01; *p<0.05vs生理盐水)
Fig3EffectofCDNonairwayresistanceofozone-inducedAHRmodlemice.(acute(A)、subacute(B);n=5, **p<0.01; *p<0.05vs生理盐水)
3.3 穿山龙总皂苷对AHR模型小鼠BALF中IL-17A的影响
图4 A、B显示穿山龙总皂苷对臭氧诱导的急性、亚急性AHR模型小鼠BALF中IL-17A的影响结果,可见生理盐水组BALF中IL-17A水平较正常组明显升高(**p<0.01);雾化吸入梯度剂量的穿山龙总皂苷后,各药物治疗组IL-17A的水平较生理盐水组(空白溶剂对照组)显著降低,且药物浓度越高穿山龙总皂苷降低IL-17A的水平越明显。
3.4 穿山龙总皂苷对急性AHR模型小鼠肺组织匀浆液中IL-17A的影响
图5显示穿山龙总皂苷对臭氧诱导的急性AHR模型小鼠肺组织匀浆液中IL-17A的影响结果,可见生理盐水组肺组织匀浆中IL-17A水平明显升高,与正常组相比有显著性差异(**P<0.01),各穿山龙总皂苷治疗组与阴性对照组相比,IL-17A水平明显降低,当雾化吸入80、40 mg/kg的穿山龙总皂苷时可显著降低肺匀浆液中IL-17A的水平(**p<0.01),其作用效果优于10 mg/kg醋酸泼尼松悬液。
图4穿山龙总皂苷对臭氧诱导AHR模型小鼠肺泡灌洗液中IL-17A的影响
(急性(A)、亚急性(B);n=5, **p<0.01vs正常, **p<0.01vs生理盐水)
Fig4EffectofCDNonIL-17AinBALFofozone-inducedAHRmodlemice.(acute(A)、subacute(B);n=5, **p<0.01vscontrol, **p<0.01vs生理盐水)

图5穿山龙总皂苷对臭氧诱导的AHR模型小鼠急性肺组织匀浆液中IL-17A的影响。(n=5,**p<0.01vs.正常, **p<0.01vs生理盐水)
Fig5EffectofCDNonIL-17Ainlungtissuehomogenatesofozone-inducedacuteAHRmodlemice(n=5,**p<0.01vs.control, **p<0.01vssaline)
4 讨论
哮喘发病率的持续上升提示环境因素可能起重要作用。臭氧是环境中的有害因素,可以改变肺结构和肺功能,导致哮喘症状,如气道炎症和气道高反应[10]。臭氧诱导产生AHR模型小鼠的方式通常可分为急性、亚急性、及慢性三种[11]。由于慢性模型伴有肺炎,肺气肿,气道重塑等严重肺部病理变化,影响到对AHR的治疗效果的评判[12],而本研究旨在探究穿山龙总皂苷对AHR的治疗作用,故选择采用臭氧诱导小鼠建立急性[13]、亚急性AHR[14]模型。
研究证明急性、亚急性AHR模型中暴露于臭氧,可诱导嗜中性粒细胞气道炎症和气道阻力增加[15]。我们的研究也证实了这一现象。实验结果显示,臭氧应激后急性、亚急性气道阻力及嗜中性粒炎症细胞数均呈剂量依赖性增加。表明臭氧组小鼠存在AHR及气道炎症病理变化。动物实验表明穿山龙总皂苷对吸入卵清蛋白(ovalbumin, OVA)诱导的小鼠呼吸道炎症具有良好的治疗效果,可抑制Th2炎症反应、气道重塑[3,16]。但穿山龙总皂苷对臭氧诱导的AHR的影响未见研究。本研究结果显示,对急性模型而言,当Mch的剂量达到25 mg/mL浓度激发时,雾化吸入80、40 mg/kg的穿山龙总皂苷均能显著降低气道阻力,但对于亚急性模型而言,雾化吸入80 mg/kg的穿山龙总皂苷可降低小鼠气道阻力;当Mch的剂量增加到100 mg/mL时,雾化吸入80、40、20 mg/kg剂量的穿山龙总皂苷均可降低两模型组小鼠气道阻力。因此,从本研究的结果看,不论对急性或亚急性AHR模型小鼠,雾化吸入梯度剂量的穿山龙总皂苷可不同程度降低Mch诱导的气道阻力,且气道阻力的降低程度呈剂量依赖性。这些结果从表象上证明,穿山龙总皂苷至少对臭氧诱导的急性、亚急性AHR模型小鼠具有有效缓解AHR的治疗作用。
AHR的内在机制是由于炎症介质导致气道平滑肌产生急性收缩反应[17]。而由Th17 细胞分泌的IL-17A是一种具有多种功能的强效致炎因子,可促进组织炎症发生,并参与AHR的发生[18]。文献报道穿山龙总皂苷可通过抑制OVA诱导的哮喘小鼠体内IL-17A 的水平,发挥治疗哮喘的作用[6]。但穿山龙总皂苷对臭氧诱导的AHR模型小鼠气道阻力的降低是否也与体内IL-17A 的改变有关,尚未见报道。本研究的实验结果显示,无论在急性、亚急性AHR模型小鼠中,臭氧刺激都会导致IL-17A的显著增高。但对急性AHR模型而言,雾化吸入80 mg/kg的穿山龙总皂苷即可显著降低肺泡灌洗液中IL-17A水平。对亚急性AHR模型而言,雾化吸入80、40、20 mg/kg的穿山龙总皂苷均可有效降低肺泡灌洗液中IL-17A的水平。本研究还发现雾化吸入80、40 mg/kg的穿山龙总皂苷也可降低急性AHR模型小鼠肺组织匀浆中IL-17A的水平。这些结果与气道阻力的变化趋势一致。因此,在臭氧诱导AHR模型中,AHR的产生很可能与研究报道的OVA通过驱动IL-17A上调,从而增强气道平滑肌收缩,进而诱导AHR[19]的机制一致。同时也说明穿山龙总皂苷很可能是通过抑制小鼠体内IL-17A水平,而降低臭氧诱导AHR模型小鼠的气道阻力,进而达到缓解其AHR的作用。
综上所述,雾化吸入穿山龙总皂苷(80、40、20 mg/kg)可不同程度降低急性、亚急性AHR,此作用可能与穿山龙总皂苷能够降低IL-17A的水平相关,从而为穿山龙总皂苷缓解或治疗AHR症状提供实验依据。

