铜绿假单胞菌重组Bb-OprH疫苗诱导的保护力及其细胞免疫应答
江 帆,李文桂
重庆医科大学附属第一医院传染病寄生虫病研究所,重庆 400016
铜绿假单胞菌(Pa)是院内感染的常见机会致病菌之一,以往治疗铜绿假单胞菌感染多采用头孢菌素类、单环β-内酰胺类,氨基糖苷类和喹诺酮类、碳青霉烯类等抗生素药物,但近年来随着抗生素的广泛使用,铜绿假单胞菌的耐药率逐渐上升,抗生素的使用受到了限制[1-3]。疫苗是预防铜绿假单胞菌感染的较好途径,其中重组活载体疫苗因感染途径类似自然感染,能诱导较为全面的免疫应答,而成为近年来疫苗研究的热点之一[4]。
OprH蛋白是铜绿假单胞菌最小的外膜孔蛋白,其与脂多糖的相互作用可参与稳定Pa外膜,从而介导Pa对抗生素的耐药[5-6]。徐波等[7]以重组质粒pRNV-OprF/H电穿孔转化乳酸乳球菌NZ9000,乳菌肽诱导表达,SDS-PAGE证实重组菌可表达目的蛋白;结果显示OprH蛋白具有良好的免疫原性。目前铜绿假单胞菌活载体疫苗包括沙门氏菌疫苗、土拉热弗朗西斯菌疫苗和乳球菌疫苗等[7-9],但沙门氏菌疫苗和土拉热弗朗西斯菌疫苗存在着毒力回复的可能,而乳球菌疫苗在多次免疫后效力低下,故仍需探索新的疫苗。双歧杆菌是一种肠道益生菌,具有调节肠道菌群和抗肿瘤等功能[10]。用作宿主菌时可在体内存活较长时间,在表达外源基因的同时还能发挥益生作用,有着良好的疫苗研发前景[11-12]。研究拟将重组Bb-OprH疫苗免疫小鼠,Pa攻击后观察其诱导产生的保护性细胞免疫应答,从而为研究该疫苗保护性免疫机制提供有价值的材料。
1 材料与方法
1.1 实验材料
21只6~8周雌性BALB/c小鼠,购自重庆医科大学实验动物中心。噻唑蓝(MTT)和二甲基亚砜(DMSO,重庆百萃公司);异硫氰酸荧光素(FITC)标记的兔抗大鼠IgG和大鼠抗小鼠CD4单克隆抗体(mAb)(北京邦定泰克公司);异硫氰酸荧光素标记的膜联素Ⅴ/碘化丙啶(annexin Ⅴ-FITC/PI)凋亡检测试剂盒(深圳欣博盛公司);伴刀豆球蛋白A(ConA,Sigma);RPMI1640培养液、胎牛血清(FBS,上海生工公司);酶标仪(Scientific Thermo);荧光激活细胞分选仪(BD);铜绿假单胞菌重组Bb-OprH疫苗由本室构建和保存。
1.2 动物免疫
21只BALB/c小鼠随机分为3组,每组7只,均采用灌胃免疫。疫苗组:5×108克隆形成单位(CFU)的疫苗悬浮于100 μL MRS液体培养基中;空载体组:5×108CFU的疫苗悬浮于100 μL的MRS液体培养基中;Bb对照组:5×108CFU的Bb悬浮于100 μL的MRS液体培养基中。接种1次/d,每周3 d,持续3周。
1.3 攻击感染
于首次免疫后4周,将5×107CFU的铜绿假单胞菌PAO1株悬浮于10 μL的LB液体培养基进行滴鼻攻击,1次/d,连续3 d。
1.4 肺细菌负荷
攻击2周后杀鼠,无菌取肺、匀浆稀释后涂皿,37 ℃培养2 d,进行菌落计数。肺细菌菌落计数以l g CFU/g表示。
1.5 脾细胞制备
攻击后2周处死小鼠,无菌取脾,于200目尼龙网研磨过滤;0.15%生理盐水溶解红细胞后,用10 mL含BSA的RPMI 1640培养液调制细胞浓度为5×106/mL,并加入青霉素100 U/mL和链霉素100 U/mL。
1.6 MTT法检测脾细胞增殖
将5×106/mL脾细胞加入24孔细胞培养板,每份标本设3孔,分别加入1 mL脾细胞原液、1 mL脾细胞原液+10 μg铜绿假单胞菌抗原、1 mL脾细胞原液+10 μg ConA,每孔加入5 mg/mL的MTT 10 μL,置37 ℃、5% CO2中培养18 h,每孔吸弃150 μL上清培养液,加入DMSO 150 μL,反复吹打,使形成的甲臜充分溶解后,酶标仪测定A450nm。
1.7 流式细胞术检测脾脏T细胞亚群
吸取200 μL细胞浓度为5×106/mL的脾细胞悬液于1.5 mL EP管中,加入1 mL PBS,3000 r/min离心3 min,弃上清,加入1%的阻断液100 μL,于1.5 mL EP管中混匀,置37 ℃孵育1 h,加PBS重复洗涤1次后,加5 μL大鼠抗小鼠CD4 mAb或大鼠抗小鼠CD8 mAb,4 ℃放置30 min,PBS洗涤2次,再加入5 μL FITC标记的兔抗大鼠IgG,PBS洗涤2次,用200 μL 1%多聚甲醛进行固定,4 ℃保存。同时制备只加脾细胞悬液的阴性对照管。荧光激活细胞分选仪测定CD4+T细胞和CD8+T细胞亚群百分比。
1.8 Annexin Ⅴ-FITC/PI双标记结合流式细胞术检测脾细胞凋亡
收集1×106培养18 h的脾细胞于1.5 mL离心管中,用4 ℃ PBS洗涤2次,2500 r/min离心3 min;100 μL结合缓冲液重新悬浮细胞,加入Annexin V-FITC 5 μL和碘化丙碇(PI)10 μL(20 μg/mL),混匀后室温避光孵育15 min,流式细胞术检测细胞凋亡。
1.9 统计学分析
用SPSS22.0软件对实验数据进行t检验、单因素方差分析、SNK-q检验或非参数检验。数据用均数±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 肺细菌负荷
与空载体组和Bb对照组相比,重组Bb-OprH疫苗组肺组织的细菌菌落数明显减少,差异有统计学意义(P<0.01,表1)。
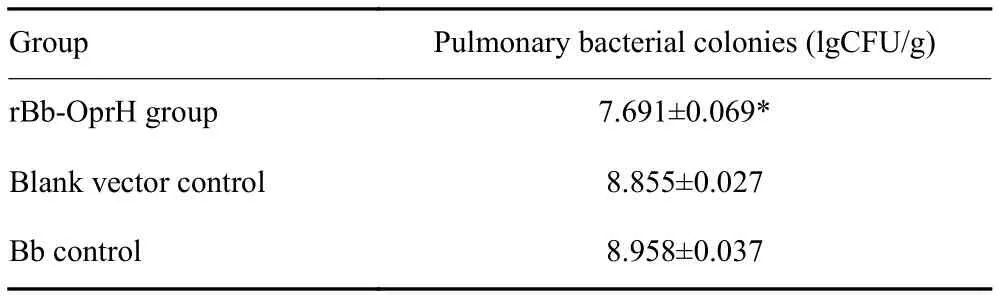
表1 疫苗免疫及PA01株攻击后小鼠肺组织细菌的菌落数(n=7,Mean±SD)
2.2 脾细胞增殖活性
原液、PaAg、ConA刺激时,疫苗组的脾细胞增殖水平显著高于空载体组和Bb对照组(P<0.01),而空载体组和Bb对照组之间差异无统计学意义(P>0.05)。3组的增殖水平表现为ConA>PaAg>原液(P<0.01,图1)。
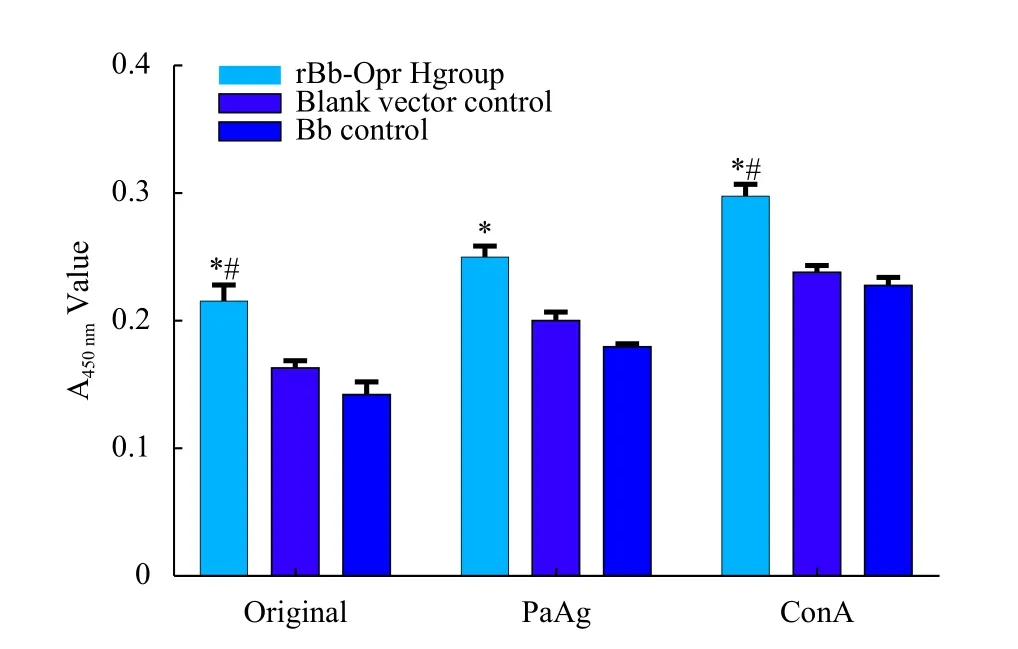
图1 rBb-OprH疫苗免疫及PAO1株攻击后小鼠脾细胞增殖水平
2.3 脾CD4+ T细胞亚群
重组疫苗组的CD4+T细胞百分比显著高于空载体组和Bb对照组,差异具有统计学意义(P<0.01)。空载体组和Bb对照组之间差异无统计学意义(P>0.05)。3组的CD8+T细胞百分比差异无统计学意义(P>0.05,图2)。
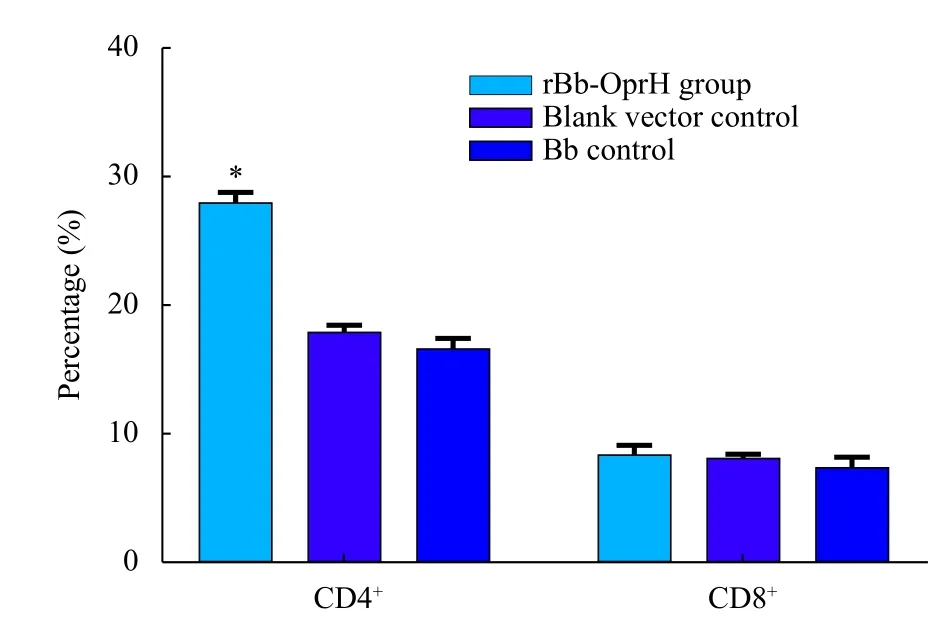
图2 rBb-OprH疫苗免疫及PAO1株攻击后小鼠脾细胞亚群百分比
2.4 脾细胞凋亡率
原液、PaAg或ConA刺激时,重组疫苗组的脾细胞凋亡率显著低于空载体组和Bb对照组,且差异具有统计学意义(P<0.01),而空载体组和Bb对照组之间差异无统计学意义(P>0.05)。3组之间的凋亡率表现为ConA>PaAg>原液,差异有统计学意义(P<0.01,图3)。
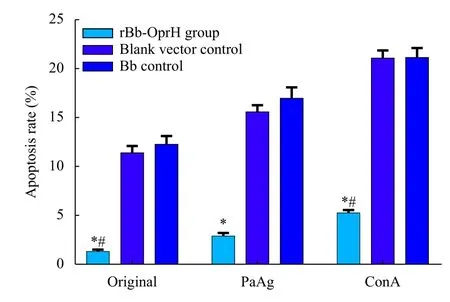
图3 rBb-OprH疫苗免疫及PAO1株攻击后小鼠脾细胞凋亡率
3 讨论
铜绿假单胞菌外膜蛋白高度保守,其中以外膜蛋白F、I和H抗原性最强,是制备疫苗的良好候选分子,有研究发现小鼠脾细胞增殖、脾CD4+和CD8+T细胞亚群及IFN-γ、IL-12、TNF-α和IL-10较免疫前明显升高(P<0.05)[13]。刘潇等[14]发现小鼠脾细胞增殖、CD4+T细胞亚群较免疫前明显升高,而脾细胞凋亡显著降低(P<0.01)。这些研究表明重组Bb-OprF及重组Bb-OprI疫苗均可诱导小鼠产生对铜绿假单胞菌感染的保护力,然仍存在保护力低下的问题,故需进一步研制新的疫苗。本文将重组Bb-OprH疫苗口服灌胃免疫小鼠,按文献[14]的方法进行免疫与攻击,检测结果与其类似,提示重组Bb-OprH疫苗可诱导小鼠产生一定的保护力。
Restagno等[15]发现宿主肺细菌负荷与免疫应答水平及生存率密切相关。本文用铜绿假单胞菌重组Bb-OprH疫苗灌胃免疫小鼠,攻击2周后杀鼠取肺,发现疫苗组小鼠肺细菌负荷较正常组明显降低(P<0.01),表明重组疫苗对小鼠具有一定的保护作用。Th1细胞分泌的IL-2及Th2细胞分泌的IL-4分别是T细胞与B细胞增殖的关键因素。Qadi等[16]认为OprH蛋白还可通过旁路途径激活C3补体系统。本研究发现重组疫苗免疫及PAO1株攻击后,小鼠脾细胞增殖水平明显升高,推测OprH蛋白激活C3补体系统,产生的活性片段C3dg与B细胞补体受体CR2结合,而C3a、C3b分别与T细胞补体受体C3aR、C5aR结合,从而促进B细胞与T细胞的活化增殖。Dunkley等[17]发现免疫组生存率明显高于对照组,肺细菌负荷明显低于对照组,而抗体变化不明显,提示CD4+T细胞可通过非抗体依赖途径增强宿主对急性铜绿假单胞菌感染保护作用。Kamei等[18]发现免疫组CD4+T细胞通过分泌GM-CSF,刺激巨噬细胞增殖,提高了中性粒细胞减少症小鼠的生存率。这些研究表明CD4+T细胞在宿主对急性铜绿假单胞菌感染的保护中起着重要作用。本研究发现疫苗免疫及PAO1株攻击后,小鼠CD4+T淋巴细胞较免疫前明显升高(P<0.01),而CD8+T淋巴细胞无明显变化(P>0.05),推测疫苗免疫后,其抗原部分经APC处理,通过MHCⅡ途径刺激CD4+T细胞活化、分化为Th1及Th2细胞,Th1细胞及Th2细胞又各自分泌多种细胞因子,激活免疫细胞,诱发免疫应答。
铜绿假单胞菌感染小鼠后,通过与宿主细胞直接接触或分泌毒力因子,可诱发大量脾淋巴细胞凋亡[19-20],且多认为其凋亡经线粒体途径诱导产生[21-22]。研究表明细菌感染诱发的淋巴细胞凋亡降低了宿主免疫力,导致宿主生存率下降[23-25]。本研究在疫苗免疫及Pa PAO1株攻击后,发现小鼠脾细胞凋亡率较对照组明显下降,推测重组Bb-OprH疫苗免疫小鼠后,激活免疫细胞,这些激活的免疫细胞分泌多种细胞因子与免疫细胞相互作用,最终减少脾细胞凋亡,促进脾细胞增殖,从而增强小鼠抗Pa感染的保护性免疫反应。