七叶皂苷的制备及其对大鼠后肢水肿的疗效
薛晓畅,李志兰,张 存,王多宁,王春娟,党林涛,王增禄
1第四军医大学药学系生物制药学教研室,陕西 西安 710032;2西安蓝绿卓生物科技有限公司,陕西 西安710000;3西安医学院科研中心,陕西 西安 710021
七叶皂苷为七叶树科植物七叶树的干燥成熟果实娑罗子中提取得到的总皂苷、β-七叶皂苷或异七叶皂苷等的总称[1-3]。目前在临床中应用最多的为总七叶皂苷,主要含有七叶皂苷A、B、C和D[4-6]。在我国根据液相色谱出峰时间的先后,A~D的物质分别对应escin Ia、escin Ib、isoescin Ia及isoescin Ib[7-8]。其中的七叶皂苷A和B是β-型七叶皂苷,七叶皂苷C和D是七叶皂苷A和B的C21-羟基上乙酸酯转位到C28-羟基的异构体,是Crypto-型(异型)七叶皂苷。研究表明,总七叶皂苷具有抗炎、抗渗出和改善血液循环等生物学特性[9-12],因此已经被广泛应用于治疗各种原因引起的脑水肿、创伤或手术所致肿胀、静脉回流障碍或烧伤等疾病[13-14]。
鉴于七叶皂苷的广泛临床应用前景,分离纯化七叶皂苷日益受到重视,然而传统的方法多采用醇提取、大孔树脂分离、有机溶剂脱脂和结晶等方法,制备周期长,操作繁杂、有机溶剂使用过多,使得七叶皂苷的生产成本相对较高且易造成环境污染。本研究使用醇提或者水提(未发表数据)然后进行离子交换柱层析从七叶树的果实娑罗子中提取了七叶皂苷,总七叶皂苷纯度达到90%以上,层析中使用氯化钠进行洗脱使得产物为七叶皂苷成盐,解决了化合物的溶解性难题并降低了七叶皂苷致血管痉挛的毒性。将分离纯化的七叶皂苷制备成气雾剂/喷雾剂用于大鼠组织水肿模型,发现七叶皂苷对于组织水肿有显著的疗效,表明使用该工艺制备的七叶皂苷生物活性良好,其具良好的开发前景。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠60只,SPF级,体质量200±20 g,购自第四军医大学实验动物中心。
1.2 主要试剂和仪器
乙醇、Na2HPO4和NaH2PO4等常规化学试剂(西安红岩试剂厂),乙腈、磷酸(美国Fisher)。活性炭(北京市光华晶科活性炭有限公司),0.45 μm过滤膜(Millipore)。离子交换层析柱及介质(美国GE)。Purifier层析仪(美国GE)、HPLC十八烷基硅烷键合硅胶层析柱(美国迪马)、旋转蒸发仪(宁波新芝生物科技股份有限公司)、高效液相色谱仪(美国Waters 2695和大连伊力特)。
1.3 方法
1.3.1 七叶皂苷的提取和纯化 称取500 g娑罗子,粉碎,将其粉用2500 mL的80%乙醇溶液浸泡1 h、常规回流提取1 h,温度控制在70 ℃,过滤,留滤液;向滤渣加入50%的乙醇溶液2000 mL,常规回流提取1 h,温度控制在70 ℃,过滤,弃渣。合并两次滤液,共3000 mL。向滤液中边搅拌边加入活性炭至棕红色消失为止,静置20 min,将脱色液在3500 r/min离心15 min,去沉淀,上清液用旋转蒸发浓缩回收乙醇,浓缩液用0.45 μm膜抽滤,得滤液940 mL,备用。
选用 SP-Sepharose F.F 离子交换层析介质,将其装入45×300 mm柱,柱床高100 mm,连接到AKTA Purifier色谱仪(GE),以10 mmol/L Na2HPO4-NaH2PO4缓冲液pH5.69为平衡液平衡柱子,流速10 mL/min,检测波长为220 nm。向滤液中加入115 mL的200 mmol/L Na2HPO4-NaH2PO4pH5.69缓冲液,为上样液。待柱子平衡后上样,流速8 mL/min,收集穿过峰;上完样后,用平衡液洗去末吸附物,收集洗涤末吸附物液体,将该液体与穿过峰合并为穿过液;线性梯度洗脱,洗脱液A即平衡液:10 mmol/L Na2HPO4-NaH2PO4缓冲液pH5.69;洗脱液B:1 mol/L NaCl-10 mmol/L Na2HPO4-NaH2PO4缓冲液pH5.69;用洗脱液B洗柱,流速10 mL/min,洗脱体积:1000 mL;平衡液平衡柱子备用。
向穿过液中边搅拌边加入乙醇溶液,使乙醇浓度达80%以上,密封4 ℃存放1 h,待沉淀完全,将沉淀物经抽滤至干;收集滤液;减压旋转蒸发回收滤液中乙醇,待有七叶皂苷结晶出现时停止;静置待七叶皂苷析出。用3500 r/min离心5 min收集晶体和浓缩母液。向浓缩母液中加入适量无水乙醇,混匀;减压旋转蒸发浓缩回收乙醇,浓缩液中结晶出七叶皂苷时停止,静置,3500 r/min离心5 min收集晶体。合并收集的晶体,加入无水乙醇脱水,抽滤至干,弃上清,重复脱水洗涤两次,继续抽滤至干,沉淀物装于烘盘内,干燥箱内烘干,箱内温度设置为45~55 ℃。称重,得七叶皂苷。
1.3.2 七叶皂苷纯度鉴定 按照高效液相色谱法(中国药典2010年版二部附录ⅤD)测定。色谱条件,用反相柱(十八烷基硅烷键合硅胶为填充剂),乙腈-磷酸溶液(取85%磷酸5.5 mL,用水稀释至1000 mL)(33:67)为流动相,调节pH值为2.1,检测波长为215 nm。
供试品溶液制备:称取七叶皂苷2.0 mg,加甲醇0.8 mL溶解、过滤,备用,其浓度为2.5 mg/mL。仪器选用Waters公司2695型HPLC仪,采用自动进样器进样20 μL,流速1.0 mL/min。
1.3.3 七叶皂苷喷雾剂制备 按照下表的配方制备七叶皂苷喷雾剂(表1)。具体的制备工艺为:首先将A相原料称量后,加入B相,溶解搅拌均匀;然后将C相原料分别称量后,溶解;在30 ℃下,将C相混合原料在搅拌下,缓慢加入到A、B相混合原料中;然后加入D相原料继续搅拌均匀;最后加入E相原料和F原料,搅拌均匀后静置24 h,检验合格后,灌装,成品检验,入库备用。
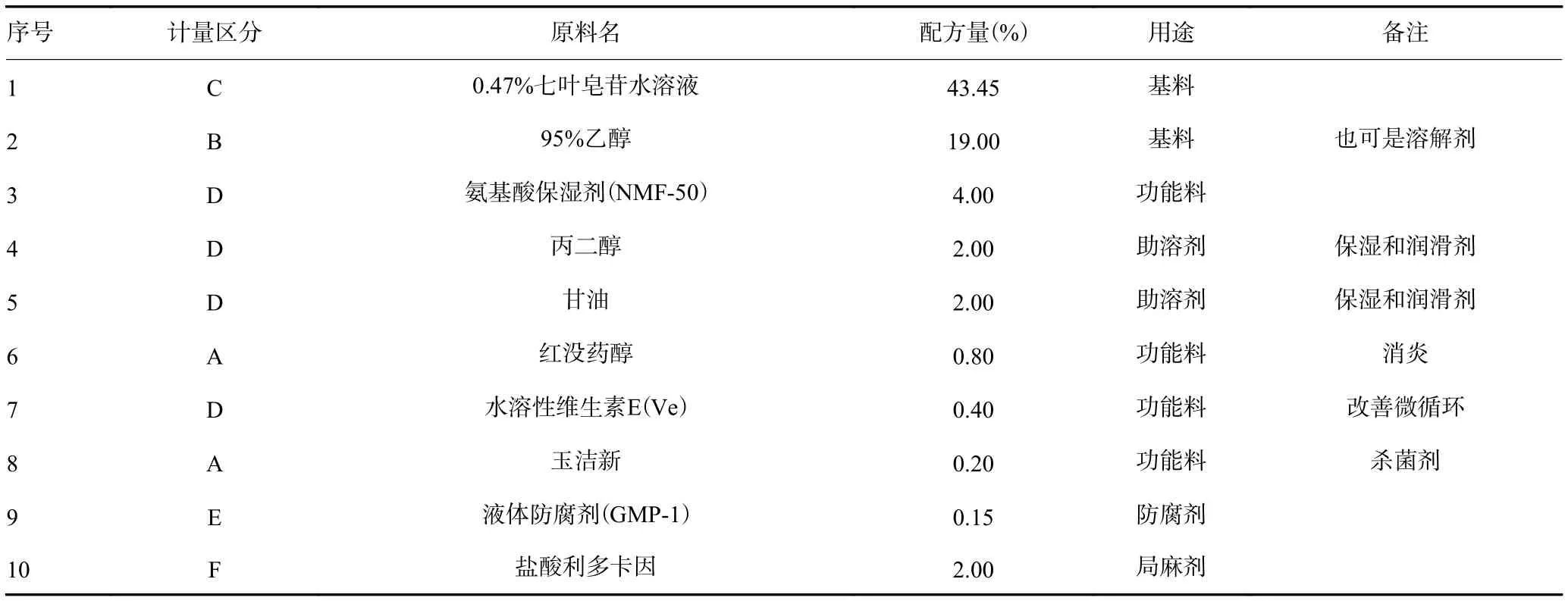
表1 七叶皂苷喷雾剂配方
1.3.4 建立大鼠组织水肿模型、实验分组 所有SD大白鼠予以标准饲料适应性喂养1周,然后随机分为6组:正常组、模型组、云南白药(阳性药物)治疗组、七叶皂苷钠喷雾剂治疗高、中、低剂量组。采用自制自由落体致伤模型进行,SD大鼠组织水肿造模,对不同打击力度的模型进行评估分析,总结最优化造模方案。具体方法为:除正常组以外的大鼠,固定架上固定四足后用电动理发推脱除后腿部毛发,随后用自制撞击器(以10 g砝码从50 cm处卷筒内自由落体掉下,撞击接触面直径约为0.8 cm,撞击冲量为2 kg/m)在小腿中部外侧同一部位连续击打3次,造成大鼠腿部肌肉局部软组织挫伤。20 min后,裸露的肌肉发红紫且肿胀起来形成局部淤血水肿。结果表明,出模率为100%且操作治疗过程中无动物死亡。
1.3.5 大鼠软组织损伤模型的治疗 以云南白药喷雾剂(市售药,国药准字Z53021107,云南白药集团股份有限公司)为阳性对照药物,设立七叶皂苷低(0.5 g/10 mL)、中(1 g/10 mL)、高剂量组(2.0 g/10 mL),分别在大鼠软组织损伤的红肿部位进行局部喷雾给药进行治疗。给药2次/d,给药日剂量分别为50、100、200 mg。治疗4 d后,迅速麻醉处死大鼠,进行取材观察。
1.3.6 组织取材和切片染色 选取大鼠损伤治疗的中心部位组织,10%福尔马林中固定24 h后,送西安交通大学附属一医院病理科和中国人民解放军西京医院病理科进行常规的梯度酒精脱水、透明、浸蜡、包埋、切片(片厚5 μm),并进行HE染色和结果分析。
1.4 统计学处理
运用SPSS 18.0统计软件进行统计学分析,各组数据以均数±标准差表示,组间比较采用双尾t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 七叶皂苷的制备
采用前述的方法,对七叶皂苷进行了制备。我国不同地域娑罗子经过0%~80%乙醇提取,滤液经活性炭或中性氧化铝脱色后进行HPLC鉴定,结果显示七叶皂苷的纯度达到80.9%以上(图1)。将脱色后的提取液分别进行离子交换层析、精制和结晶等步骤,所获得的七叶皂苷纯度>90%(HPLC分析,图2)。分析图谱中有4个主成分峰,分别为七叶皂苷A、B、C和D,其面积占比分别44.96%、26.04%、15.31%和6.48%,4个组分七叶皂苷面积占比之和为92.79%。符合“总七叶皂苷中含七叶皂苷A和七叶皂苷B应分别为25.0%~45.0%和20.0%~35.0%”的药用要求。在此研究基础上,该项目已经申报国家发明专利1项(一种七叶皂苷钠的制备方法包含其的外用制剂及其应用. ZL201510213030.5)。
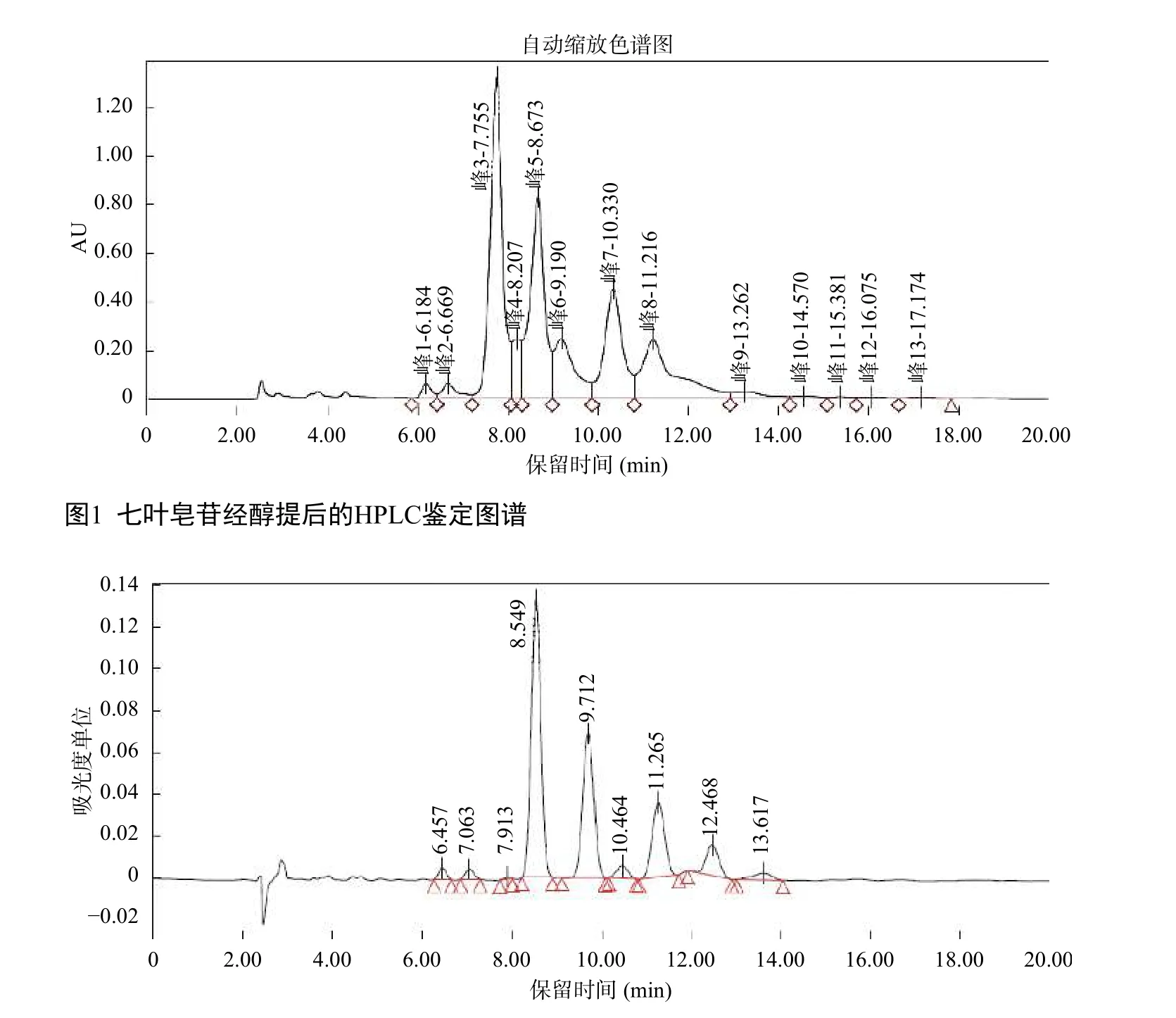
图2 七叶皂苷经离子交换色谱纯化后的HPLC鉴定图谱
2.2 七叶皂苷喷雾剂对大鼠水肿模型的治疗作用
将制备的七叶皂苷按照前述的配方制备成喷雾剂,对大鼠挤压伤导致的组织水肿模型进行了治疗,云南白药设为阳性对照药物。对大鼠模型制备前后以及治疗后的后肢围度进行测定,结果如图3所示,云南白药对后肢水肿具有良好的治疗效果,七叶皂苷低剂量组效果不明显(与治疗前相比,P=0.14),而中剂量组(P<0.05)和高剂量组(P<0.01)则具有明显的疗效,可以显著改善后肢的水肿程度。药物治疗72 h后处死大鼠,取损伤部位组织进行甲醛固定,石蜡包埋并组织切片,HE染色结果如图4所示。染色结果表明正常大鼠腿部肌肉组织中未见肌肉细胞损伤(坏死)及炎性细胞浸润(图4A);模型组大鼠损伤组织中可见大片组织坏死,炎性细胞浸润明显,肌间纤维组织中的炎细胞和纤维细胞浸润明显(图4B)。阳性对照药物云南白药治疗组大鼠损伤组织局部可见小量的炎性细胞浸润,病灶比较小(图4C);七叶皂苷低、中和高剂量组均可有效改善模型动物症状,与模型组相比病灶小、肌间纤维组织中无或仅有极少量的炎性细胞和纤维细胞浸润,其效果等同或优于云南白药。

图3 七叶皂苷钠喷雾剂对组织水肿模型大鼠后肢肿胀程度的影响
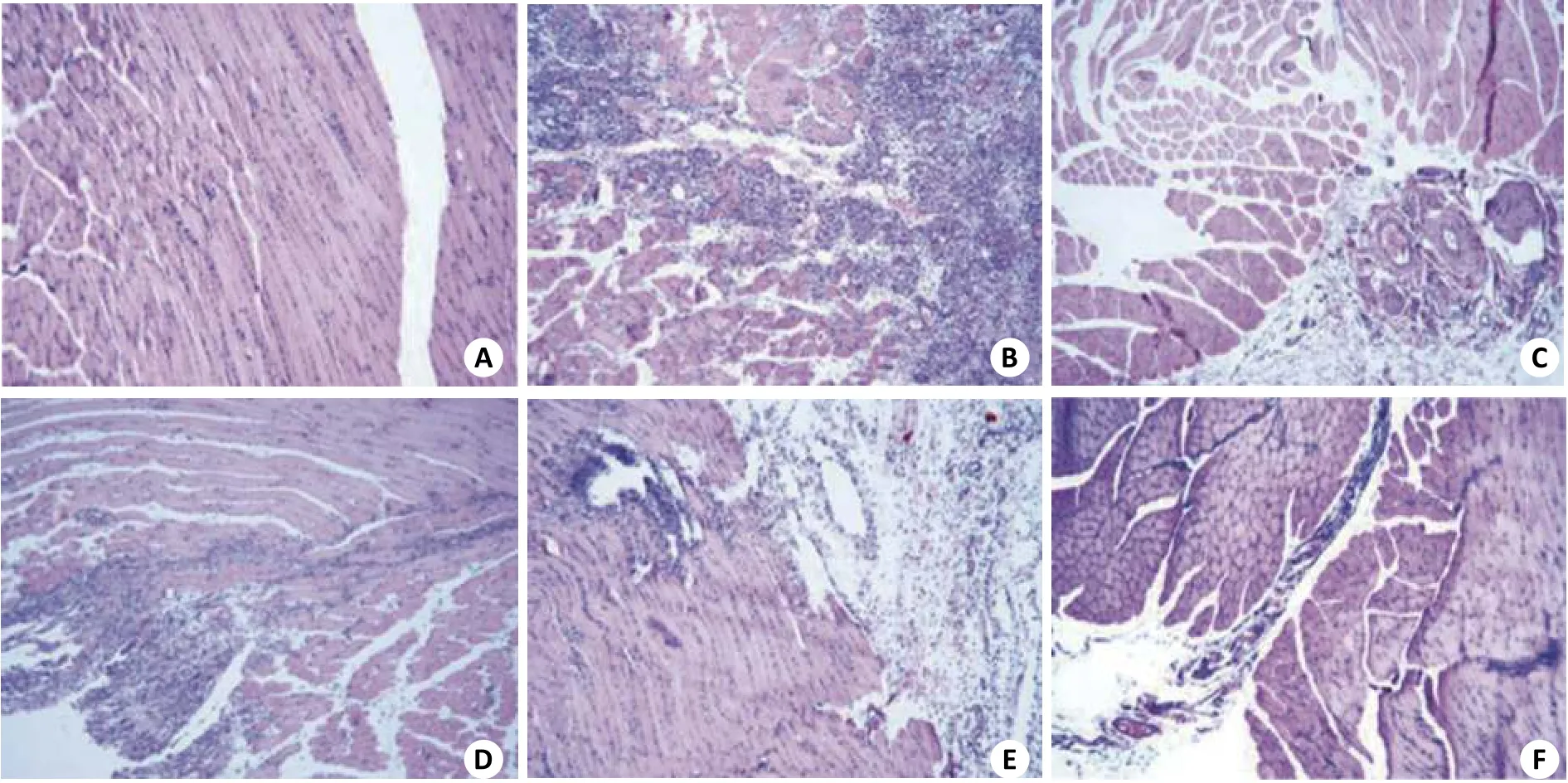
图4 七叶皂苷对组织水肿大鼠模型的治疗作用(HE染色,×100)
3 讨论
大量研究表明,七叶皂苷在临床具有广阔的应用前景,总七叶皂苷具有抗炎、抗渗出和改善血液循环等生物学特性[9-12],已经被广泛应用于脑水肿、创伤或手术所致肿胀、静脉回流障碍或烧伤等疾病的治疗[13-15]。此外,王梦炎等[16]研究表明,β-七叶皂甙钠可以有效地预防术后肠粘连;杨秀伟等[17]报道七叶皂苷-Ia组份可以作为抗肿瘤前药,其在经过人肠内细菌和短乳杆菌粗酶转化后产生的去酰基七叶皂苷I具有抗肿瘤活性;β-七叶皂苷对于肝癌也具有潜在的治疗作用,可以抑制肝癌细胞系的增殖并对其化疗有增敏作用[18]。此外,对于七叶皂苷的作用分子机制也日益受到重视。周庆博等[19]研究发现β-七叶皂甙钠可以通过调控超氧化物歧化酶(SOD)、一氧化氮和肿瘤坏死因子-α(TNF-α)而发挥对大鼠脑出血的治疗作用;有报道七叶皂甙钠能够通过调控巨噬细胞的HMGB1而抑制炎性因子的分泌,从而延长LPS诱导的败血症小鼠模型的生存期[20]。
考虑到七叶皂苷的诸多临床用途,七叶皂苷单体及其复合体的分离纯化一直备受关注。然而,传统的中药单体分离方法常常依赖于有机溶剂的萃取以及大孔吸附树脂等填料的分离纯化,具有较大的局限性。有机溶剂造价高、易造成环境污染、废水回收处理成本高等;大孔吸附树脂主要依靠非特异性吸附以及疏水作用进行目标组份的分离,分离度不够精细,洗涤常常采用乙腈、甲醇等有机溶剂也提高了生产成本。如王绪英等[21]用乙酸乙酯除去脂溶性物质、丙酮沉淀、NKA-9大孔树脂和C18反相柱获得最终的七叶皂苷,他们还比较了5种大孔树脂 D4020、D101、NKA-9、H103、201×4和1种硅胶G分离七叶皂苷的效果,数据表明,NKA-9对七叶皂苷的吸附和解吸附性能均较好,专一性也较强,在实践中有一定的开发和应用价值[22]。陈新艳等[23]采用D101大孔树脂(吸附时间24 h)和硅胶柱层析(需要氯仿和甲醇等有机溶剂洗涤)进行七叶皂苷的分离纯化。也有人直接使用反相C18柱进行七叶皂苷的分离制备,如湛建峰等采用制备色谱柱waters HR C18进行了七叶皂苷的制备,然而该工艺造价高,使用了乙腈等有机溶剂作为流动相,且主要可用于A、B组份的制备[24]。
为了对传统七叶皂苷纯化工艺进行改良,本研究开创性地选择常常用于蛋白质等生物大分子分离纯化的软填料Sepharose琼脂糖进行了七叶皂苷的组份分离。该填料与大孔树脂比,主要依靠组份的荷电状态进行分离纯化,目标组份的分离可以选择磷酸盐和氯化钠进行洗涤即可,载样量大、使用寿命长(100~1000次),填料利用高浓度的氯化钠溶液洗涤即可方便地再生。实验结果表明,利用乙醇萃取出的混合物经过一步离子交换色谱分离即可获得90%以上的含有合乎药用标准的A、B、C、D 4组份的七叶皂苷,再经过乙醇洗涤沉淀、浓缩即可得最终的产物。经过我们对传统七叶皂苷提取工艺的优化,获得了简便(节省几十小时)、经济(使用水提或低浓度醇提代替高浓度醇提)和环保(去除了氯仿、乙醚等处理步骤)的七叶皂苷提取工艺。此外,分离纯化过程中使用了无机钠盐使得七叶皂苷直接鳌合Na+成为七叶皂苷钠盐,在后期的使用中减少了对于肌肉和粘膜的刺激作用,减轻用药部位局部疼痛和肿胀。
研究表明七叶皂苷具有消炎、抗组织水肿、抗渗出、和预防组织内水分存积等作用[25-27],临床用于脑水肿及创伤性水肿治疗,已取得良好效果[28-30]。然而,目前市场上的七叶皂苷注射液不便于携带和使用,运输储存不便。为了考察提取制备的七叶皂苷是否具有良好的活性,本研究将其制成喷雾剂,并用于处理挤压伤所致组织水肿动物模型。结果表明,与阳性对照药物云南白药相比[31-32],中高剂量的七叶皂苷(0.5 g/10 mL)即对挤压伤所致组织水肿具有良好的疗效,高剂量七叶皂苷在抑制炎性细胞浸润方面的作用优于云南白药。
总之,本研究获得了利用离子交换层析进行七叶皂苷分离纯化的经济高效的工艺,纯化产品制备的喷雾剂对挤压伤后的组织水肿具有良好的治疗作用,有望成为一种功能更优异、制备更环保、成本更低廉的组织水肿治疗药物。