MRI对肝孤立性坏死结节诊断及鉴别诊断价值研究*
李 鹏,刘小丽,喻奇志
肝脏孤立性坏死结节(solitary necrotic nodules of liver,SNNL)是一种发病率较低的良性肝脏病变,具有隐匿性,通常无明显临床症状,易被忽视[1,2]。虽可通过影像学检查发现病灶,但由于该病缺乏特异性临床表现,临床难以将SNNL与肝内占位性疾病区分开来[3]。国内研究[4,5]表明,SNNL 极易被误诊为肝脏肿瘤而进行了不必要的治疗。因此,提高临床鉴别诊断SNNL的准确性,而给予对症处理,对患者具有重大的意义。本研究回顾性分析了我们诊治的43例SNNL患者的病例资料,总结了SNNL在MRI下的影像学特征,现将结果报道如下。
1 资料与方法
1.1 临床资料 2013年3月~2017年3月我院收治的SNNL患者43例,男性26例,女性17例;年龄28~73岁,平均年龄为(43.7±5.4)岁。经B 超检查发现肝占位后行肝脏 MRI检查。纳入标准:①肝功能正常,且无肝炎史;②影像学检查图片清晰,可用于诊断;③血清癌胚抗原(CEA)、甲胎蛋白(AFP)、糖类抗原19-9(CA19-9)均为阴性。排除肝内比较明确的血管瘤和肝癌。
1.2 MRI检查 使用3.0 T MR扫描仪(菲利普Achieva)。患者取仰卧位,扫描参数为T1WI序列:同相位TR 210 ms,TE 2.3 ms,反相位 TR 210 ms,TE 3.6 ms,FOV 34~38 mm,矩阵 256×179,层厚 5 mm;FS-TSE-T2WI 序列,TR 2000 ms,TE 78 ms,FOV、矩阵、层厚同 T1WI 序列,ETL为 9。冠状 位采 用 HASTE,TR 1400 ms,TE 93 ms,FOV 34~38 mm,矩阵 320×224,层厚 5 mm,ETL 为179,以上层间距均为1 mm。DWI序列采用呼吸导航SSFSE技术,横轴位成像在增强扫描前进行,FOV 38 cm,矩阵 128×81,层厚 5 mm,TR 2200 ms。根据b值变化,调整TE。动态增强扫描采用3D-Radial-VIBE T1WI序列:64 层,TE 1.4 ms,TR 3.94 ms,FOV 36 cm,矩阵 320×224,层厚 3 mm,层间距 0.6 mm。应用对比剂钆喷酸葡胺注射液0.1 mmol·kg-1,于注药后 15 s、40 s、5 min 和 10 min各行多次快速扫描[6]。根据文献[7]定义平扫和增强 T1WI、T2WI中的高、稍高、低或稍低信号。
2 结果
2.1 病灶情况和MRI表现特点 在43例 SNNL患者中,病灶直径为(2.8±0.4)cm ,其中38个病灶≤3 cm,5个病灶>3 cm;39个为单发病灶,4个为融合型病灶;36个病灶位于肝右叶,7个病灶位于肝左叶;34个为浅表部位病灶,9个为深部病灶;27个病灶为不规则形,16个为圆形或类圆形;T1WI显示32个病灶呈低信号(图1A),,6个病灶呈稍低信号,5个呈等信号;T2WI显示2个病灶呈高信号或稍高信号,39个呈等信号(图1B),其中4个病灶中可见片状或斑点状高信号;DWI序列显示21个病灶呈等信号,22个呈高信号或稍高信号(表1);43例在增强扫描后病灶内部均未见强化,且均呈低信号。
2.2 病理学表现 经手术后发现,大体病灶切面呈土黄色或灰白色,部分可见含液体的小囊腔,病灶周围无薄膜。在显微镜下观察,39个病灶呈大片状单纯的凝固性坏死,外周有完整的纤维组织包绕;3个病灶为坏死结节状融合,除凝固性坏死外,部分结节内伴有小片状液化性坏死,结节间可见纤维分隔及包膜;1个病灶除凝固性坏死外,病灶中心还伴有裂缝状液化性坏死。2例伴有胃壁间质瘤,1例伴有乙状结肠腺癌。
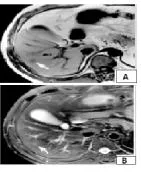
图1 SNNL患者腹部MRI表现
2.3 典型病例介绍 患者女,29岁。SNNL病灶直径为1.9 cm,为融合型,位于肝脏VⅢ段右前叶上端,T1WI显示为稍低信号(图2A),T2WI显示为等信号,伴斑点状高信号(图2B),增强扫描显示门静脉期和延迟期病灶边界及其形态清楚,呈明显的低信号,边缘轻度强化,可见结节状相互融合的病灶(图2C),大体标本切面为土黄色结节(图2D),病灶为凝固性坏死伴灶性液化坏死,周围有炎性细胞浸润,且四周可见纤维组织增生(图2E)。
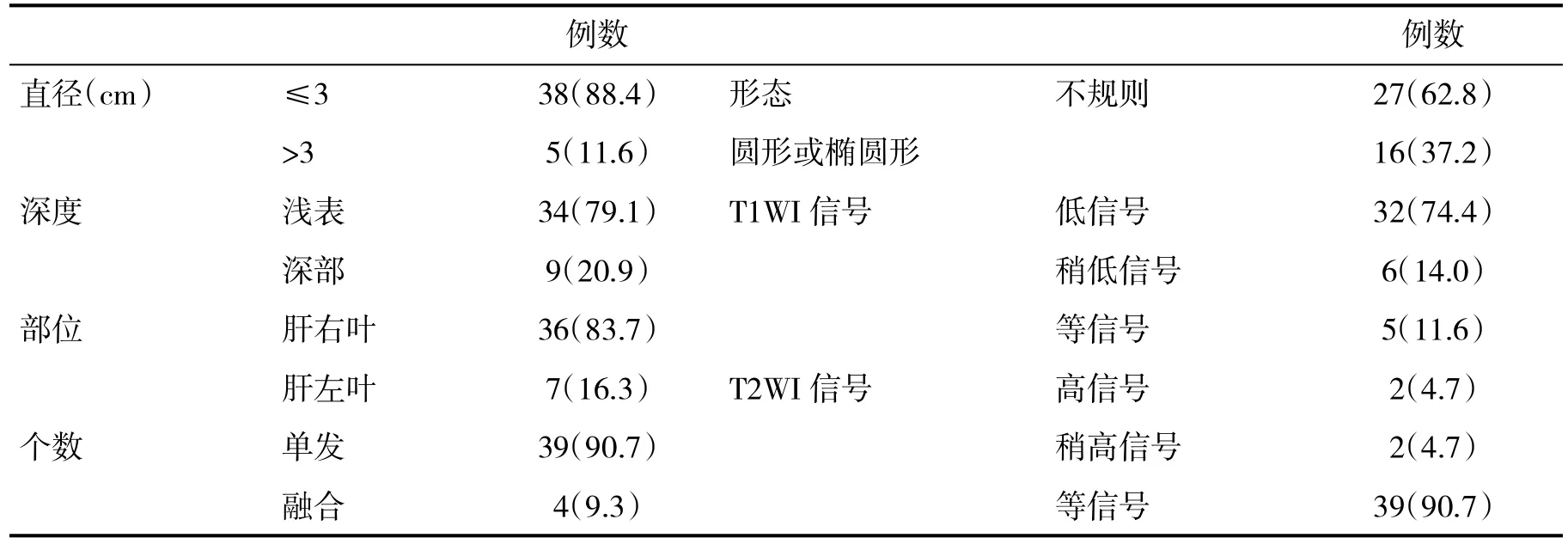
表1 SNNL患者MRI表现特点(n,%)

图2 SNNL患者腹部MRI、大体和病理学表现
3 讨论
SNNL是一种发生率较低的良性肝脏病变[8]。国外研究[3,9]曾报道称,SNNL多发于男性,且多为中老年患者。本组人群男性26例,女性17例,年龄为28~73岁。目前,该病发病机制尚不明确,但有文献[10-12]认为SNNL可能与幼虫感染、血管病变等因素有关。近年来,随着MRI、CT等影像学技术的更新和发展,越来越多的学者开始关注SNNL。国内研究[13,14]发现大部分SNNL病灶均发生在肝右叶,病灶直径约为2~4 cm。有36个病灶位于肝右叶,7个位于肝左叶;34个处于浅表部位,病灶直径多不超过3 cm,验证了上述观点。相关研究也[13]曾报道称,SNNL患者通常无明显的临床症状,多数患者是在体检等偶然情况下发现的,血清CEA、AFP、CA19-9等指标均属于正常范围。虽然SNNL检出率有所提高,但由于SNNL患者并无特异性的临床表现和特异性指标,为临床诊断和鉴别诊断增加了一定的难度。病理学检查虽能帮助临床确诊,但大部分病灶只能在手术切除后才能获得诊断。
SNNL多为边界清晰的单发结节,切面呈现土黄色或白色,部分可见含液体的小囊腔。显微镜下可见纤维包膜中有多种炎性细胞浸润,呈大片状单纯凝固性坏死,部分结节中央有裂缝状液化性坏死物质,并可见钙化[15]。
多数病灶发生在肝右叶,生长于浅表部位,大部分SNNL病灶为单个病灶,形状以不规则的多边形为主。SNNL病灶在T1WI上多以低信号或稍低信号为主,本组 32个病灶在 T1WI上为表现出低信号,6个为稍低信号,5个为等信号。在T2WI上,SNNL的信号变化波动较大,国内相关研究[16]表明,SNNL病灶在T2WI上呈等信号或低信号。本研究结果则表明,39个病灶在 T2WI上表现为等信号,4个为高信号或稍高信号。血管性肝结节良性病变常见在T2WI上有明显的高信号,周围呈球状强化增强,周围边缘强化[17]。MRI是一种能够判断乏血管性肝结节的有效检查方法。SNNL多为单纯凝固性坏死,部分病灶伴液化坏死,病灶内可见点片状高信号[18]。本研究结果表明,在T2WI上3个等信号和 1个稍高信号病灶内可见斑片状高信号,经病理学检查证实病灶中央发生液化坏死。有报道,在几个多结节状融合型SNNL病灶中央均有液化坏死情况的存在,推测SNNL病灶信号强度可能与病灶脱水严重程度有关,脱水程度轻重与坏死病灶表现的信号强弱存在密切的关联,经病理学检查证实凝固性坏死病灶中缺乏水分[19,20]。因此,在 T1WI、T2WI和DWI上多呈等信号或稍低信号。本研究结果还显示,在MRI动态增强扫描后,SNNL病灶无强化表现。原因可能为病灶内并没有组织细胞结构,故病灶在增强扫描后无明显的强化表现,尤其在门静脉期和延迟期,SNNL病灶与增强后的肝实质相比,表现出明显的低信号,病灶边界也更加清晰可见。SNNL病灶出现边缘强化,则是由于对比剂逐渐扩散渗透至细胞外间隙的结果。值得注意的是,常规平扫结果显示SNNL病灶为等信号,很容易引发漏诊,而通过MR动态增强扫描能够更直观地观察病灶,还能帮助医生了解病灶内分隔及四周的纤维包膜情况。
SNNL需与肝硬化结节相鉴别。肝硬化患者由慢性肝炎发展而来,既往存在慢性肝炎史及门静脉高压等影像学表现,而SNNL患者可能没有这些病史,经MR平扫,在T2WI上多为低信号或等信号,但肝硬化结节在T1WI上多为高信号[20,21]。SNNL还需与肝内转移肿瘤相鉴别,转移灶为多发病灶,往往存在肝外原发灶的表现[22]。SNNL与乏血供的转移性肝癌的鉴别也不难。乏血供的转移性肝癌为圆形或类圆形多发病灶,增强扫描后,病灶边缘出现逐渐强化[23]。SNNL与肝内胆管细胞癌(ICC)的鉴别着重在ICC典型表现为T2WI上呈不均匀高信号,增强后病灶边缘明显强化及渐进性强化,而SNNL在增强后则无明显强化。除此之外,临床还可根据ICC的临床特征和特异性指标等,加以区分[24,25]。炎性假瘤(IPL)往往需要经过门静脉供血,因此动脉期MRI平扫未见强化,在门静脉期及延迟期,呈不均匀强化或分隔状强化,在T1WI上表现为略低信号,在T2WI上则呈等信号或高信号,其MRI影像学资料与 SNNL相类似[26],增加了临床的鉴别难度。
综上所述,SNNL是一种发病率较低的良性肝脏病变,准确诊断能够为保守治疗提供基础,为患者减轻痛苦。但SNN无典型症状和特异性指标,无法直接诊断,但通过MRI检查发现SNNL具有以下特点时,如多为单个存在的病灶,生长于浅表部位,多数直径≤3 cm,且形状为不规则,T1WI呈等信号或稍低信号,T2WI则呈等信号或略高信号,MRI动态增强扫描后,病灶未见明显强化,边缘或分隔轻度强化等,可帮助临床医生做出判断。

