念珠菌血症的临床特征及其与(1, 3)-β-D葡聚糖的关系
申 旺,杨文丽, 陈彦波, 李月桂, 钟一梅, 张 鑫
关健词: 念珠菌血症; (1,3)-β-D-葡聚糖; 培养; 定植
随着医疗技术的快速发展,器官和骨髓移植的大量开展,各种导管插管等侵袭性治疗技术的应用,以及抗生素和免疫抑制剂的广泛使用等,侵袭性真菌感染患者逐年增多[1]。念珠菌血症是侵袭性真菌感染中最常见的类型,约占医院血流感染的6%~11%[2]。念珠菌血症临床表现呈多样性,常合并其他并发症,治疗难度大,病死率高。如何在早期及时诊断念珠菌血症是目前临床面临的难题。(1, 3)-β-D葡聚糖是念珠菌细胞壁的主要成分,研究已证实其可用于侵袭性真菌感染的早期诊断[3]。念珠菌深部定植和外科手术均被认为是引起念珠菌血症的重要因素[4],本研究主要通过对念珠菌血症患者和念珠菌深部定植患者的临床资料和血清(1, 3)-β-D葡聚糖水平进行比较,分析念珠菌血症患者的临床特征和(1, 3)-β-D葡聚糖的诊断价值。
1 材料与方法
1.1 材料
1.1.1 临床资料 对2015年9月-2018年3月于江门市五邑中医院住院患者进行回顾性分析,发现血培养念珠菌阳性,且排除可能的污染,同时表现出念珠菌感染体征的念珠菌血症[5]患者31例,其中男19例,女12例,平均年龄64.6岁(34~91岁);同期在胸水、腹水、胆汁等引流液标本中培养出念珠菌,但血培养为阴性,无相应临床表现的39例患者作为念珠菌深部定植组[4],其中男21例,女18例,平均年龄55.3岁(29~87岁)。详细记录两组患者的临床资料,包括性别、年龄、手术、基础疾病、药物使用情况、体内留置导管等情况。同时选择50名健康体检人员作为健康对照组,其中男28名,女22名,平均年龄48.9岁(24~74岁)。入选对象均排除了抽血前2周内进行透析、输注白蛋白和免疫球蛋白及使用过抗肿瘤多糖类药物的患者。
1.1.2 仪器与试剂 法国生物梅里埃公司BacT/AlerT 3D全自动血培养仪及其配套的血培养瓶;沙保弱真菌显色培养基;上海跃进SPX-400-Ⅱ真菌生化培养箱;法国生物梅里埃公司ATB Expression半自动微生物鉴定仪及其配套的细菌和真菌鉴定试剂盒;厦门市鲎试剂实验厂有限公司提供的血浆(1, 3)-β-D葡聚糖检测试剂盒。
1.2 方法
1.2.1 真菌培养和鉴定 按照《全国临床检验操作规程》,以无菌操作的原则采集念珠菌血症患者和念珠菌深部定植患者的血液5~10 mL和胸腹水、胆汁等引流液分别接种于双套血培养瓶和血平皿、沙保弱平皿中,血培养瓶放置BacT/AlerT 3D全自动血培养仪中培养7 d,若报警阳性,则转接血平皿、沙保弱平皿;若平皿有细菌和真菌生长,则采用微生物鉴定试剂和鉴定仪进行鉴定。多次血培养阳性患者以首次培养阳性的结果为 准。
1.2.2 G试验 按照(1, 3)-β-D葡聚糖检测试剂说明书进行操作,严格遵守无菌操作原则。健康对照组人群检测1次,念珠菌血症组和念珠菌深部定植患者均检测2次,结果以首次检测出阳性结果和天数为准。血浆(1, 3)-β-D葡聚糖≥10 pg/mL为阳性。
1.2.3 统计学分析 用统计学软件SPSS 19.0进行统计分析。计量资料采用四分位数Q(P25,P75)描述,组间的比较采用秩和分析。计数资料采用百分率表示,组间比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 念珠菌血症患者病原菌分布情况
在31例念珠菌血症患者的血液中培养出13株白念珠菌,18株非白念珠菌(包括9株热带念珠菌、5株光滑念珠菌、2株克柔念珠菌和2株近平滑念珠菌)。同时还从14例念珠菌血症患者血液中培养出细菌,其中5例是细菌合并白念珠菌血症,9例是细菌合并非白念珠菌血症。
2.2 念珠菌血症患者的临床特征
将念珠菌血症患者和念珠菌深部定植患者的临床资料进行比较,发现念珠菌血症更容易发生在>65岁、7 d内有手术史、留置导管≥2根且留置时间≥5 d、持续机械通气≥5 d的患者中(P<0.05),而与患者性别、基础疾病、免疫抑制剂或糖皮质激素使用情况、广谱抗生素和抗真菌药物同时使用情况、低蛋白血症无关(P> 0.05),见表1。
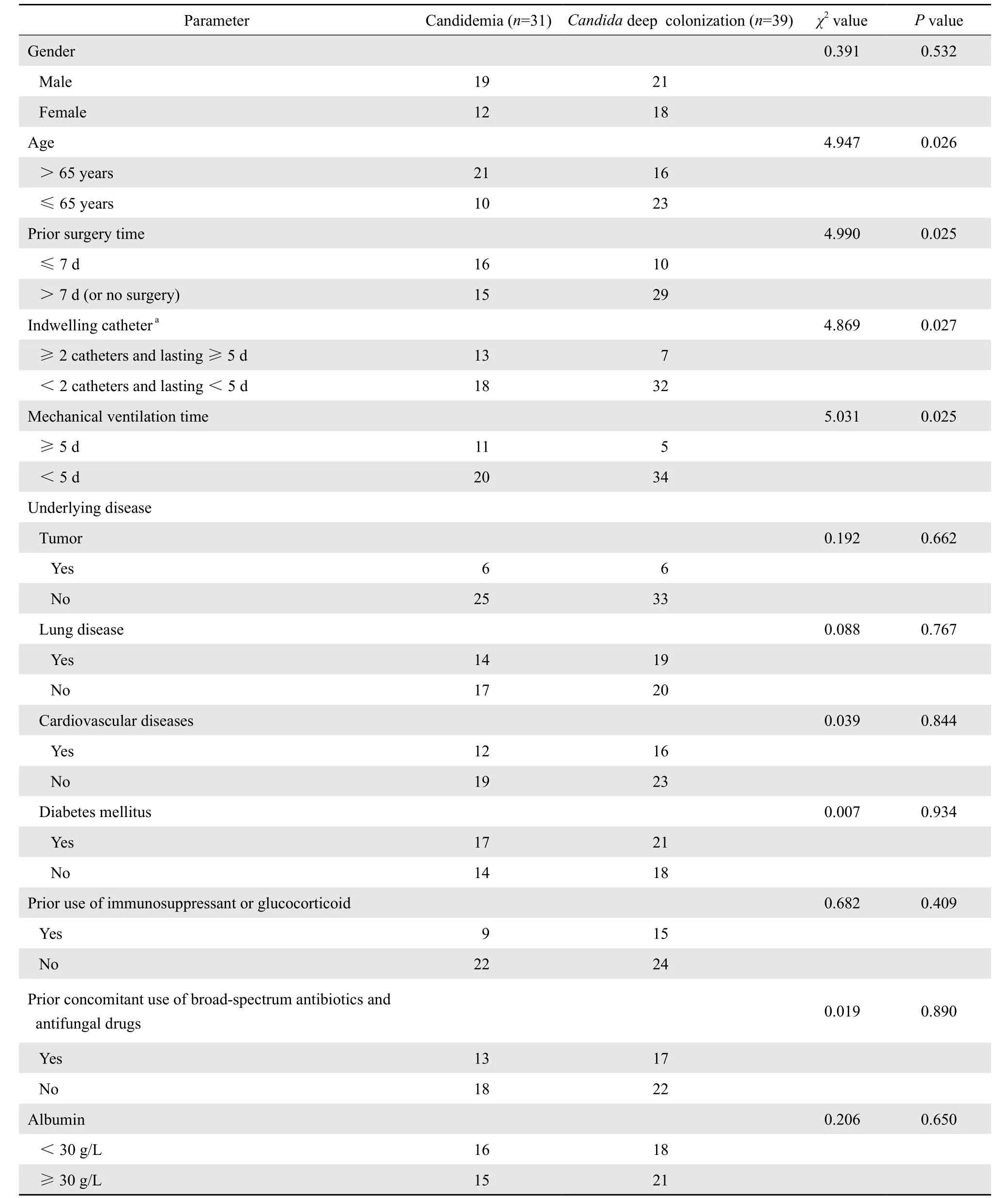
表1 念珠菌血症与念珠菌深部定植患者的临床特征比较Table 1 Clinical characteristics of patients in terms of Candida infection
2.3 各组患者的血浆(1, 3)-β-D葡聚糖水平和阳性率比较
念珠菌血症患者的血浆(1, 3)-β-D葡聚糖水平均显著高于念珠菌深部定植组(z=-3.135,P=0.018)和健康对照组(z=-7.245,P<0.001),念珠菌深部定植组的血浆(1, 3)-β-D葡聚糖水平均显著高于健康对照组(z=-5.484,P<0.001)。以健康对照组作为对照,分析血浆(1, 3)-β-D葡聚糖在念珠菌血症患者中的诊断价值,发现其诊断念珠菌血症的特异度为96.0%(48/50),灵敏度为87.1%(27/31),显著高于念珠菌深部定植组的灵敏度56.4%(22/39),差异有统计学意义(χ2=7.745,P=0.005),见表2。

表2 各组患者血浆(1, 3)-β-D葡聚糖水平和灵敏度分析Table 2 Serum level of (1, 3)-β-D glucan compared between groups and sensitivity analysis
2.4 血浆(1, 3)-β-D葡聚糖水平与念珠菌血症病原菌间关系
31例念珠菌血症患者中,17例血培养为单一念珠菌,包括8例白念珠菌和9例非白念珠菌;14例血培养中同时培养出细菌。合并细菌感染的念珠菌血症患者血浆(1, 3)-β-D葡聚糖水平显著高于单一念珠菌血症患者(P=0.021),单一白念珠菌感染组患者血浆(1, 3)-β-D葡聚糖水平显著高于单一非白念珠菌感染组(P=0.014),见表3。
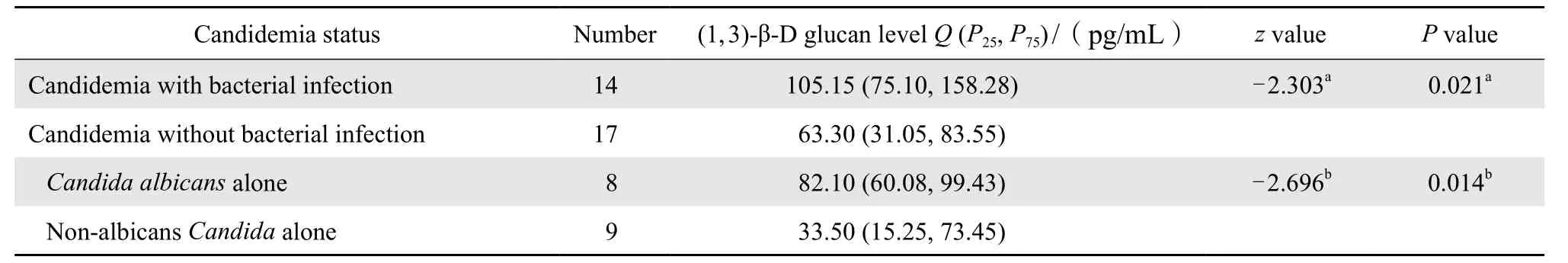
表3 血浆(1, 3)-β-D葡聚糖水平在念珠菌血症患者各组中的比较Table 3 Serum (1, 3)-β-D-glucan level in terms of candidemia etiology
3 讨论
念珠菌是一类在自然界分布最广、引起人体感染最常见的机会致病性真菌。念珠菌常定植在正常健康人群的口腔、表皮、胃肠道和阴道黏膜中,一般不会导致疾病,当人体免疫功能受损、黏膜被破坏时,念珠菌可侵入到组织或器官中,引发侵袭性念珠菌感染,其中最常见的临床表现形式就是念珠菌血症[6]。因其常合并其他并发症且不易被发现,故患者病情较危重,病死率高。
以往报道显示白念珠菌是念珠菌血症的首要感染病原体,占总念珠菌菌种的50%~70%,然而根据美国1998-2006年52所不同医院的统计[7]和2008-2012年上海多所医院的数据[8],发现近年非白念珠菌感染率逐步上升。在本研究的31例念珠菌血症患者中,白念珠菌占41.9%,低于非白念珠菌的58.1%,但仍是分离培养最多的单一念珠菌种,与国内外研究基本一致[9-10],这可能与临床对真菌感染的意识增强,大量使用预防性抗真菌药物尤其是抗白念珠菌药物有关。本研究中分离鉴定的非白念珠菌种以热带念珠菌和光滑念珠菌为主,与陈玉等[11]研究略有出入,这可能与地域性差异及样本收集的类型和数量不同有关。马春芳等[12]研究显示热带念珠菌感染主要与患者的年龄、肿瘤、手术相关,光滑念珠菌感染则与患者前期使用抗真菌药物相关。
既往研究显示引起念珠菌血症的危险因素包括外科手术、广谱抗菌药物应用、肿瘤、糖尿病、免疫抑制剂治疗或者免疫功能低下、中心静脉导管等[13-15]。这些其实也是其他真菌感染和念珠菌深部定植的危险因素,同时念珠菌在机体深部大量定植又是念珠菌血症发生的预警指标,当机体组织或器官黏膜遭破坏时,定植在此处的念珠菌极易通过黏膜屏障,侵入血液或组织器官,导致念珠菌血症。为了进一步探索念珠菌血症的特征,本研究特意对念珠菌血症患者和念珠菌深部定植患者的临床特征进行了比较分析。研究发现念珠菌血症更容易发生在>65岁、7 d内有手术史、体内留置导管≥2根且留置时间≥5 d、持续机械通气≥5 d的患者中(P<0.05),而与性别、基础疾病、抗菌药物和免疫抑制剂的应用、低蛋白血症等无关(P>0.05)。这可能是因为机体免疫力随着年龄的增加逐渐下降;另外手术、各种插管和留置导管等有创性操作导致人体的皮肤屏障、黏膜屏障等免疫屏障被破坏,血液暴露等。
早期诊断和早期治疗是改善念珠菌血症患者预后的关键,其中早期诊断尤为关键。目前临床最常采用的检测方法是血培养,同时也是念珠菌血症诊断的金标准,血培养可以鉴定出念珠菌种类并测定药敏结果,对临床诊断和治疗念珠菌血症有很重要的指导意义。但血培养时间长,需3~5 d,常延误患者的诊断和治疗,同时血培养操作过程中易受其他杂菌的污染,故不利于念珠菌血症的早期诊断。念珠菌抗体检测如甘露聚糖抗体、烯醇化酶抗体等,虽然在念珠菌感染患者中的阳性率较高,但在不同念珠菌菌种中的抗原抗体反应强度并不一致,如在近平滑念珠菌和克柔念珠菌中效果较差;即使阳性结果也无法判断患者是既往感染还是现行感染;在免疫功能低下和应用免疫抑制剂的患者中还可出现假阴性,也不利于念珠菌血症患者的早期诊断。分子生物学方法虽可早期诊断,但因念珠菌胞壁厚实坚硬,DNA提取困难,故难以应用于临床。念珠菌定植指数和念珠菌评分只是一种念珠菌感染的筛查手段,而非诊断指标。因此,寻找一种新的诊断指标势在必行。(1, 3)-β-D葡聚糖存在所有念珠菌菌种中,占细胞壁含量的50%以上。当念珠菌侵入人体组织或血液时,经吞噬细胞的吞噬和消化作用,(1, 3)-β-D葡聚糖可从细胞壁中释放至体液或血液,从而导致其浓度立即增高,并随着念珠菌含量的减少迅速下降;当念珠菌只是定植或浅部感染时,(1, 3)-β-D葡聚糖不会被释放出来[16-17]。(1, 3)-β-D葡聚糖试验操作简单、方便快捷,因此可用于念珠菌血症的早期诊断。
本研究中,念珠菌血症患者的血浆(1, 3)-β-D葡聚糖水平显著高于健康对照组(P<0.001)和念珠菌深部定植组(P=0.018),差异有显著统计学意义。念珠菌深部定植组的血浆(1, 3)-β-D葡聚糖水平与健康对照组相比,差异也有统计学意义(P<0.001),这可能与患者菌种失调导致念珠菌大量定植和繁殖或细菌感染造成的假阳性有关。以健康人群作为对照,发现血浆(1, 3)-β-D葡聚糖诊断念珠菌血症的特异度为96.0%,灵敏度为87.1%,显著高于念珠菌深部定植组的灵敏度(56.4%),差异有统计学意义(P=0.005),并且(1, 3)-β-D葡聚糖在念珠菌侵入血液的早期就可升高,表明血浆(1, 3)-β-D葡聚糖在念珠菌血症的早期诊断中具有较高的应用价值,其水平高低也有助于区分念珠菌血症与念珠菌深部定植。一项队列研究表明,对于在ICU住院超过5 d的重症患者,血浆(1, 3)-β-D葡聚糖对念珠菌血症的灵敏度和特异度分别为93%和94%[18]。(1, 3)-β-D葡聚糖检测也存在局限性,一方面其不能区分具体念珠菌种类型,另一方面在长期接受纤维膜透析的患者,接受白蛋白、球蛋白、凝血因子等血制品治疗的患者中可呈假阴性。因此,对疑似念珠菌血症患者建议尽早同时进行(1, 3)-β-D葡聚糖检测和血培养。
本研究发现念珠菌血症患者的(1, 3)-β-D葡聚糖水平与是否合并细菌感染和念珠菌菌种有关。合并细菌感染的念珠菌血症患者血浆(1, 3)-β-D葡聚糖浓度较单一念珠菌血症患者高,差异有统计学意义(P=0.021)。有研究显示念珠菌与金黄色葡萄球菌、链球菌共同培养时,可形成混合型生物膜,相互刺激对方生长,存在共生及协同作用[19-20];而当念珠菌与铜绿假单胞菌一起生长时,会产生金合欢醇抑制铜绿假单胞菌繁殖,存在拮抗作用[21]。由于本研究标本量较小,未对革兰阳性球菌和革兰阳性杆菌感染念珠菌血症患者进行比较分析,是本研究的不足之处。本研究还发现单一白念珠菌血症患者的血浆(1, 3)-β-D葡聚糖水平显著高于单一非白念珠菌血症患者,差异有统计学意义(P=0.014)。这可能与白念珠菌细胞壁(1, 3)-β-D葡聚糖含量高,以及白念珠菌能释放磷脂酶进一步促进其侵袭深部组织有关。
综上所述,白念珠菌虽在念珠菌血症感染中的比例有所下降,但仍是最常见的念珠菌菌种;念珠菌血症易发生在高龄(>65岁)、7 d内有手术史、有多根体内插管导管且持续时间长、机械通气时间长(≥5 d)的患者中;(1, 3)-β-D葡聚糖可用于念珠菌血症中早期诊断。

