同晶取代法制备Cu-Ni双金属催化剂及其催化CO加氢合成乙醇性能
郑华艳,章 敏,付 华,张华成,李 忠
(太原理工大学 煤科学与技术教育部和山西省重点实验室,山西 太原 030024)
中国石油资源较为匮乏,开发可替代石油的绿色能源对缓解能源压力具有重要的意义。乙醇作为一种优质的液体燃料和良好的汽油添加剂,被认为是最佳替代能源之一。由煤经合成气一步法制备以乙醇为主的低碳醇,不仅能够充分利用CO中的O原子,降低CO2排放,还能减少长期以来对有限石油资源的依赖,缓解能源危机,成为煤化工领域研究的热点之一[1,2]。
从低碳醇合成机理来看,合成气制乙醇的反应[3]主要包括催化剂表面金属活性位点上CO活化解离形成CHx单体、CHx单体相互耦合形成CnHz基团、CO非解离插入形成酰基中间体和进一步加氢生成产物等步骤。其中,CO解离形成CHx和CO非解离插入金属位点与CnHz基团之间形成中间体同时发生在不同活性位上[4]。目前,常见的合成乙醇催化剂有以下四类[5]:铑基催化剂、钼基催化剂、改性甲醇合成催化剂以及改性费托合成催化剂[6]。其中,具有甲醇合成功能的铜基催化剂与具有链增长能力的费托组分结合形成的Cu-M催化剂,可提供低碳醇合成所需要的双活性位,表现出较高的低碳醇选择性[7,8]。研究发现,传统共沉淀法制备的Cu-Fe、Cu-Co和Cu-Ni催化剂表现出不同的醇产物分布[9]。其中,Cu-Fe催化剂中由于Fe较强的碳链增长能力,其产物以C6+醇等长链产物为主,甲烷与甲醇选择性则较低;Cu-Co催化剂中Co的碳链增长能力较Fe稍差,因此,其长链产物,如C6+OH和C5+烃类选择性较低,短链产物C2-5OH和C2-4烃类选择性则较高;相较于Fe和Co的引入会表现出较强碳链增长活性,Ni的引入对碳链的增长则相对较弱,不利于高碳产物的生成[10]。若能通过Ni的引入构建具有强协同作用的双活性位点的Cu-Ni催化剂,有效抑制高碳醇的生成,是提高低碳醇选择性的重要措施。
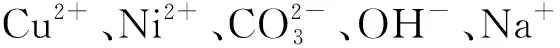
本研究采用同晶取代法来制备Cu-Ni催化剂,即先将Cu2+沉淀制备孔雀石Cu2CO3(OH)2物相,然后洗去杂离子,加入Ni2+定向同晶取代Cu2CO3(OH)2中的Cu2+,制备单一前驱体(Cu,Ni)2CO3(OH)2物相,经焙烧后得到Cu-Ni催化剂。结合XRD、TG、ICP、XPS和BET等表征手段以及催化剂活性分析前驱体物相组成与催化剂结构性能之间的关系,并通过调节不同的Ni/Cu进一步优化Cu-Ni催化剂的催化性能。
1 实验部分
1.1 催化剂的制备

1.2 催化剂的表征
采用德国Netzsch公司生产的STA409C型热分析仪对样品进行TG-DTG分析。空气流量50 mL/min,由室温升至600 ℃,升温速率8 ℃/min。
采用Shimadzu XRD-6000型X射线衍射仪对样品进行XRD表征分析,采用CuKα辐射源(λ=0.154056 nm),Ni滤波,管电压和管电流分别为40 kV和30 mA,5°-80°扫描,扫描速率为8(°)/min。
样品中Cu和Ni元素的含量是通过ICP-OES分析测定,在Perkin Elmer公司的2000 DV型电感耦合等离子体发射光谱仪上进行。
采用日本JEOL公司的TEM-2100F型电子透射显微镜对样品进行TEM表征。样品首先分散在乙醇中,经超声均匀分散后滴加在3 mm铜网碳膜上,室温下干燥后进行测定,加速电压为200 kV。
采用意大利SORPTMATIC1990型全自动物理吸附仪进行BET表征,用于分析催化剂比表面积。测试前,样品先在300 ℃真空下预处理4 h,然后进行N2吸附-脱附实验,通过Brunauer-Emmett-Teller方程计算样品比表面积。
采用美国Thermo Fisher公司ESCALAB250型X射线光电子能谱仪对样品进行XPS表征分析。以单色化AlKα(1486.6 eV)为激发光源,真空度优于2.0×10-7Pa。功率约150 W,基础真空为2×10-7Pa,电子结合能用污染碳的C 1s峰(284.6 eV)作为内标校正。
采用美国Micromeritics公司AutochemⅡ2920型化学吸附仪进行H2-TPD和CO-TPD表征分析。催化剂装填量为100 mg,升温至270 ℃在He气氛下(50 mL/min)处理2 h,然后分别用H2/Ar和CO/He在270℃连续吸附30min,稳定后,升高温度至800 ℃,升温速率为10 ℃/min,H2和CO的脱附量通过TCD检测得到。
1.3 催化剂的评价
催化剂的活性评价在500 mL浆态床反应釜中进行。首先将5.0 g催化剂和250 mL液体石蜡(AR,天津市科密欧化学试剂有限公司)加入到高压反应釜(WHF,威海自控反应釜有限公司)中。通入VH2/VN2=1∶9的混合气,在270 ℃、0.4 MPa下还原6 h。以VCO/VH2=1∶2作为反应气,在270 ℃和5.0 MPa以及气体质量空速3000 mL/(g·h)下进行活性评价实验。反应所得产物经低温冷凝器进行气液分离,液相产物每隔12 h收集一次并在7890A的氢火焰离子化检测器(FID)离线分析。气相产物在配有热导池检测器(TCD)的Agilent HP-7890A型色谱分析仪上检测。液相产物采用外标法定量,其中,CO转化率、气相产物和液相产物选择性的计算公式如下[15]:
(1)
(2)
(3)
(4)
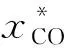
2 结果与讨论
2.1 (Cu,Ni)2CO3(OH)2前驱体的微观结构
2.1.1前驱体的XRD结构分析
图1为孔雀石物相和不同Ni/Cu制备的前驱体镍孔雀石的XRD谱图;表1为前驱体的晶胞参数值及采用Scherrer公式计算前驱体的平均晶粒粒径(2θ=31.3°)。由图1可知,Ni2+取代后的样品在14.8°、17.6°、24.1°、31.3°、32.3°和35.6°处均出现了强度较高的(Cu,Ni)2CO3(OH)2的特征衍射峰,且没有Ni2CO3(OH)2对应的前驱体产生。Ni取代后制备的前驱体均只出现(Cu,Ni)2CO3(OH)2的特征衍射峰,没有其他杂质的衍射峰,说明同晶取代法制备的(Cu,Ni)2CO3(OH)2为纯物相。对比孔雀石Cu2CO3(OH)2(JCPDS No.27-0178)和镍孔雀石(Cu,Ni)2CO3(OH)2(JCPDS No.41-1390)的标准衍射峰,可以发现,同晶取代法制备的(Cu,Ni)2CO3(OH)2前驱体的特征衍射峰与Cu2CO3(OH)2的衍射峰基本重合[16],说明Ni2+同晶取代Cu2CO3(OH)2中的Cu2+后形成的(Cu,Ni)2CO3(OH)2仍保持较好的孔雀石结构。
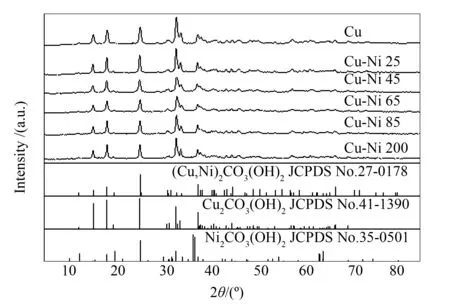
图 1 前驱体(Cu,Ni)2CO3(OH)2的XRD谱图
由表1可知,随着Ni取代量的增加,(Cu,Ni)2CO3(OH)2物相的各个特征衍射峰强度逐渐减弱,前驱体(Cu,Ni)2CO3(OH)2的晶粒粒径下降。当Ni/Cu原料比从65∶100增加到200∶100时,(Cu,Ni)2CO3(OH)2物相的特征衍射峰强度几乎保持不变,说明Ni2+取代Cu2+反应已趋于平衡,这与后面的ICP表征结果一致。
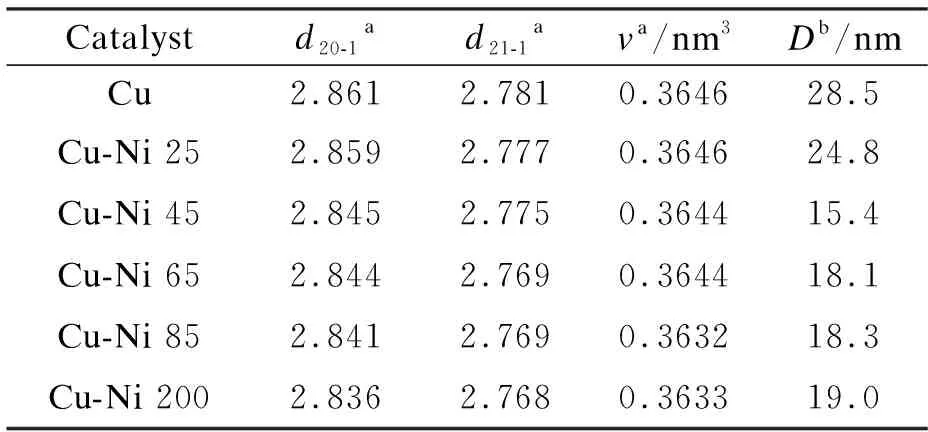
表 1 前驱体(Cu,Ni)2CO3(OH)2的晶胞参数和平均晶粒粒径
a: the lattice parameters of (Cu,Ni)2CO3(OH)2were calculated from the XRD patterns;
b:D: crystallite size of the precursors, derived from XRD peak 2θ=31.3°
此外,与纯孔雀石相比,Ni取代后制备的(Cu,Ni)2CO3(OH)2前驱体(20-1)晶面(31.3°)和(21-1)晶面(32.2°)的特征衍射峰均向高角度偏移,晶面间距不断减少。这是由于(Cu,Ni)2CO3(OH)2结构中Cu八面体配位存在Jahn-Teller效应,Ni2+取代Cu2+后,径向轴上的M-O的J-T变形减弱,即M-O的平均距离减小,从而导致(20-1)和(21-1)面的晶面间距d值减小,晶体体积也相应减小,证明Ni发生了取代,形成了(Cu,Ni)2CO3(OH)2前驱体[17,18]。
2.1.2前驱体的ICP元素分析
表2为前驱体(Cu,Ni)2CO3(OH)2的ICP表征结果。由表2可知,随着原料中Ni/Cu的增加,Ni取代Cu的量上升。同时,当Ni投入量较低时,Ni2+基本都能发生取代反应,如原料Ni/Cu=25∶100时,将近72%的Ni2+发生取代;而随着Ni投入量的加大,发生取代的Ni2+的比值减小,如Cu-Ni 200催化剂中,仅17%的Ni2+发生了取代反应。当Ni/Cu原料比由65∶100增加到200∶100时,前驱体中Ni/(Cu+Ni)却几乎不变,说明Ni2+取代Cu2+的反应已趋于平衡。
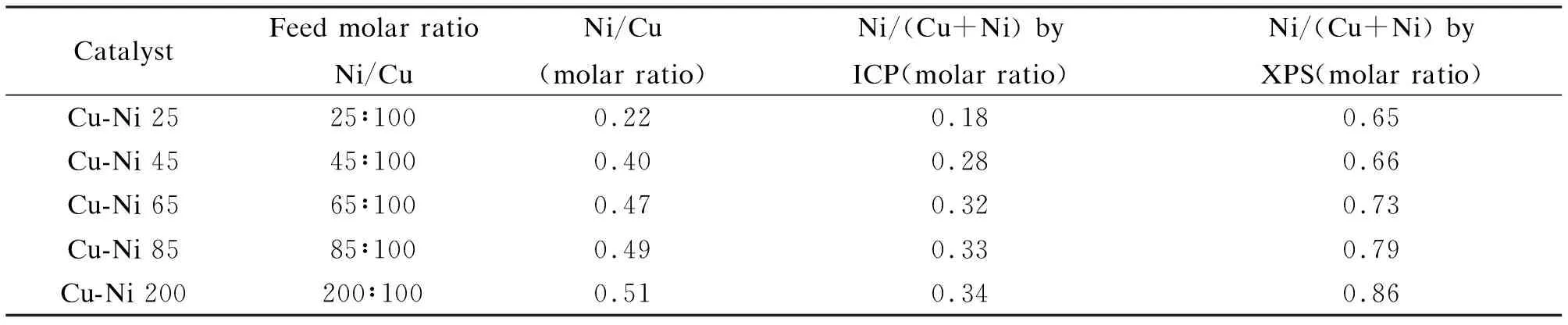
表 2 前驱体(Cu,Ni)2CO3(OH)2的ICP分析
2.1.3前驱体的TG-DTG热稳定性分析
图2为前驱体镍孔雀石的DTG曲线。

图 2 前驱体(Cu,Ni)2CO3(OH)2的DTG曲线
本研究选择将未掺杂物相孔雀石的DTG曲线作为参照。所有样品均只在312-330 ℃处出现了一个失重峰,结合前驱体的XRD和ICP表征结果可知,同晶取代制备的样品为(Cu,Ni)2CO3(OH)2单一物相。热分解的过程是一步分解脱出H2O和CO2。其中:
Cu2CO3(OH)2分解反应的方程式[19]为:
Cu2CO3(OH)2→2CuO+CO2+H2O
(5)
(Cu,Ni)2CO3(OH)2分解反应的方程式为:
(Cu1-x,Nix)2(CO3)(OH)2→2(Cu1-x,Nix)O+CO2+H2O
(6)
由图2可知,前驱体(Cu,Ni)2CO3(OH)2的DTG分解温度要高于孔雀石的分解温度,且失重峰更宽泛。这是因为Cu2CO3(OH)2中Cu2+被Ni2+取代后会形成Cu-O-Ni结构,加强了Cu、Ni之间的相互作用,形成的(Cu,Ni)2CO3(OH)2结构更稳定,且Ni2+的电负性大于Cu2+,当Ni2+取代Cu2CO3(OH)2中Cu2+时,Ni与OH-及-OCO2形成化学键,O往Ni上转移的电子增多,导致Ni-O键能增加,因此,(Cu,Ni)2CO3(OH)2的分解温度高于Cu2CO3(OH)2。而与Ni结合的共价键和与Cu结合的共价键键能之间的差异导致失重峰变宽泛[20]。此外,随Ni2+取代量的增加,前驱体(Cu,Ni)2CO3(OH)2的分解温度先上升,直至Cu-Ni 45催化剂达到最大,之后前驱体的分解温度开始下降,说明取代量为45∶100时Cu、Ni之间的协同作用最强,形成的(Cux,Ni1-x)O固溶体最稳定。
2.2 Cu-Ni催化剂的结构分析和性能研究
2.2.1催化剂的XRD分析
图3为Cu-Ni催化剂的XRD谱图。由图3可知,纯物相孔雀石Cu2CO3(OH)2焙烧后形成的催化剂在35.4°、35.5°、38.7°、38.9°、46.2°和48.7°处均只出现尖锐的CuO衍射峰。而Ni2+取代Cu2+后的催化剂则在37.3°和43.3°出现了NiO (JCPDS No.65-5745)或(Cux,Ni1-x)O (JCPDS No.25-1049)的特征衍射峰,且CuO的各个特征衍射峰的强度降低,衍射峰变得比较宽泛。结合前驱体的XRD谱图(图1)可知,Ni2+取代后的前驱体中并没有Ni2CO3(OH)2物相,焙烧后无法形成NiO物相,且Cu-Ni催化剂的TEM照片(图5)中同时存在CuO和(Cux,Ni1-x)O固溶体两种晶格条纹,说明Cu-Ni催化剂中存在(Cux,Ni1-x)O和CuO两种物相。且随着Ni2+取代量的增加,Cu-Ni催化剂表面的(Cux,Ni1-x)O固溶体增多,促进了Cu、Ni物种的分散。

图 3 Cu-Ni催化剂的XRD谱图
2.2.2催化剂的织构性质
Cu-Ni催化剂的BET结果见表3,同时列出了利用Scherrer公式分别计算CuO和(Cux,Ni1-x)O固溶体的平均晶粒粒径(35.5°,37.2°)。
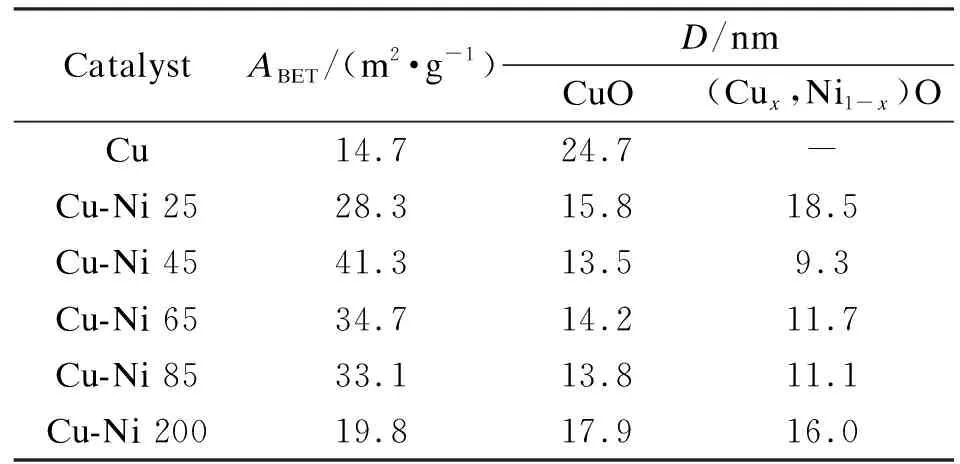
表 3 Cu-Ni催化剂的织构性质
ABET: specific surface area of the Cu-Ni catalysts;D: crystallite size of CuO, derived from XRD peak 2θ=38.7°
由表3发现随着Ni取代量的增加,Cu-Ni催化剂的比表面积先增大,催化剂Cu-Ni 45达到最大(41.3 m2/g),然后逐渐减小。单金属CuO的晶粒粒径为24.7 nm,Cu-Ni双金属催化剂中CuO的晶粒粒径则显著减小,在13.5-17.9 nm。这是由于Ni2+进入Cu2CO3(OH)2晶格后其晶粒粒径会减小,由“化学记忆”效应可知,前驱体晶粒粒径越小,焙烧后催化剂的晶粒粒径越小。随着Ni取代量的增加,催化剂的晶粒粒径呈现先降低后增加的趋势,与BET和XRD表征的变化趋势一致。
2.2.3催化剂的XPS表征
为了进一步探究催化剂的表面状态,对Cu-Ni催化剂进行了XPS表征。其中,表面的Ni/(Cu+Ni)物质的量比见表2。纯CuO的Cu 2p3/2峰对应的结合能为932.38 eV,Cu-Ni催化剂在933.10-933.23 eV,同时在938-945 eV内出现了明显的卫星伴峰,表明催化剂中Cu物种均为Cu2+[21]。与纯CuO的Cu 2p3/2峰相比,Cu-Ni催化剂中Cu 2p3/2结合能都向高结合能进行了位移,这是因为Ni2+进入Cu2CO3(OH)2晶格后,Cu、Ni之间产生较强的电子协同作用,主要体现为Cu的最外层电子向Ni偏移,导致Cu的电子云密度降低,电子结合能增大,而相应地Ni的电子云密度升高[22]。从表2可知,Cu-Ni催化剂表面Ni/(Cu+Ni)物质的量比高于体相,说明Ni2+主要分散在催化剂表面。结合XRD谱图(图3)可知,Cu-Ni催化剂中并没有NiO物相,进一步证明了CuO和(Cux,Ni1-x)O固溶体两种物相存在于催化剂的表面。

图 4 Cu-Ni催化剂的Cu 2p3/2的XPS谱图
2.2.4催化剂的TEM表征
图5为Cu-Ni催化剂的TEM和HRTEM照片,对比图5 (a)和图5 (b)可以发现,Ni的加入明显减小了催化剂的颗粒粒径,增大了催化剂的分散度。与图5(a1)中仅存在一种晶格间距为0.232 nm(对应CuO的(111)晶面)不同,图5(b1)中出现了两种晶格,分别为CuO的(111)晶面(晶格间距为0.232 nm)和(Cux,Ni1-x)O物相的(200)晶面(晶格间距为0.209 nm),且两种晶格相互均匀分布,形成了较多的Cu-Ni接触界面。说明(Cu,Ni)2CO3(OH)2前驱体物相经焙烧后Ni2+进入CuO晶格中形成(Cux,Ni1-x)O固溶体,Cu、Ni相互均匀分散,产生了较多的Cu-Ni活性界面,从而提高了催化剂的反应活性[23]。
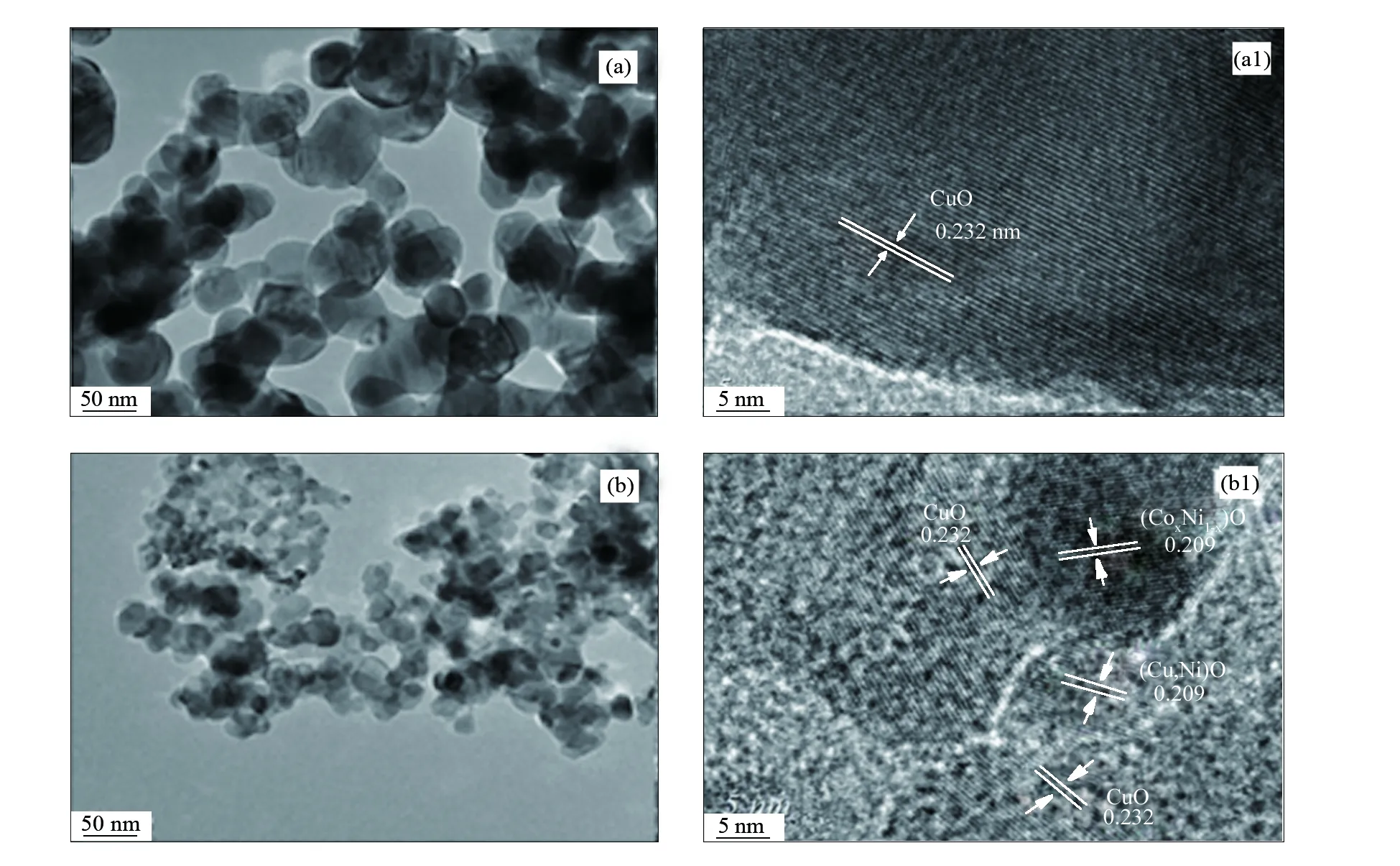
图 5 孔雀石焙烧形成的CuO和Cu-Ni 45催化剂在不同倍数下的TEM照片
2.2.5催化剂的CO-TPD和H2-TPD表征
图6(a)、(b)分别是CuO和Cu-Ni 45催化剂的CO-TPD和H2-TPD谱图。其中,349.2、440.7和531.4 ℃的脱附峰分别对应CO非解离吸附以及两种不同解离吸附[24]。

图 6 Cu-Ni催化剂的CO-TPD和H2-TPD谱图
由图6可以看出,CuO催化剂的CO脱附峰强度较低,说明其对CO的吸附力较弱,而Cu-Ni 45催化剂对CO的吸附力则强得多。同时,Ni掺杂后,CO的吸附量从22.4 μmol/gcat提高到191.9 μmol/gcat。研究发现,Cu-Ni双金属催化剂中CO解离吸附加氢形成CHx单体反应主要发生在Ni活性位点上,而Cu活性位点上的CO则以非解离吸附为主[1]。从CO-TPD表征结果看出,Ni加入后CO的非解离和解离吸附都明显提高,说明Ni的加入既提供了CO解离吸附的活性位点,又促进了Cu位点对CO的非解离吸附,提高了低碳醇的选择性。
由图6(b)H2-TPD的表征结果显示,两种催化剂上的H2吸附量相差并不明显,但Cu-Ni 45催化剂的H2脱附温度相对较高。结合XPS可知,(Cux,Ni1-x)O固溶体经还原后会形成Cu-Ni合金,而合金中Cu、Ni物种之间存在较强的电子协同作用,Cu物种的最外层电子向Ni发生偏移,其周围的电子密度降低[22],增强了Cu物种对H2的吸附力。
2.2.6催化剂的催化性能分析
表4为Cu-Ni催化剂催化CO加氢合成乙醇的CO转化率和产物选择性。由表4可知,随着Ni取代量的增加,产物中甲烷的选择性持续升高,而CO的转化率和乙醇的选择性均表现出先升高后降低的趋势,其中,Cu-Ni 45催化剂的CO转化率和乙醇选择性最高,分别为35.3%和19.1%,同时乙醇在低碳醇中的选择性达到了38.9%。结合CO-TPD可知,Ni的加入既提供了CO解离吸附的活性位点,又促进了Cu位点对CO的非解离吸附,有助于催化活性和低碳醇选择性的提高。而Ni本身较强的H2吸附力导致生成的CHx单体更倾向于直接加氢生成甲烷,而不是相互耦合增长碳链[2],因此,随着催化剂中Ni含量的增加,产物中甲烷的选择性逐渐升高。同时由于催化剂表面形成了不连续分布的Ni活性位点阻止了碳链的进一步增长,提高了低碳醇中乙醇的选择性。
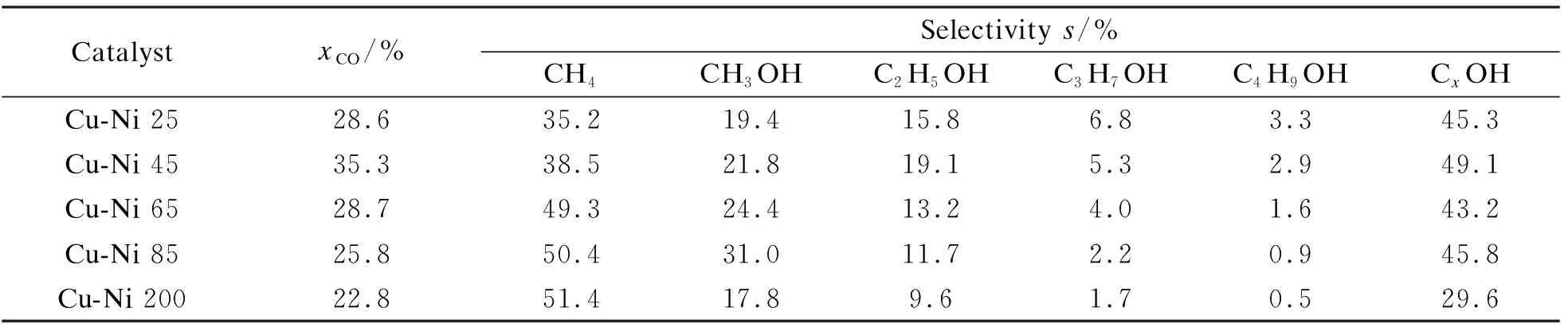
表 4 Cu-Ni催化剂催化CO加氢合成醇性能
reaction conditions: 270 ℃, 5.0 MPa, CO∶H2(volume ratio)=1∶2, 3000 L/(kg·h)
3 结 论
采用定向同晶取代法可以制备出具有原子层面相互分散的(Cu,Ni)2CO3(OH)2单一物相前驱体,其中,Ni的最大取代量为0.34。Ni2+在取代过程中优先取代Cu2CO3(OH)2表面的Cu2+,形成Cu2+和Ni2+均匀分布的(Cu,Ni)2CO3(OH)2前驱体,因此,Ni2+主要富集在前驱体表面。前驱体(Cu,Ni)2CO3(OH)2结构中存在大量的Cu-O-Ni键,焙烧后Ni2+进入CuO晶格中形成(Cux,Ni1-x)O固溶体,(Cux,Ni1-x)O固溶体均匀分散在CuO之间,极大地提高了Cu物种的分散度。还原后形成的Cu-Ni合金中Cu、Ni均匀分散且具有较强的电子协同作用,促进了活性位点对CO和H2的吸附,有效地提高了催化活性。且不连续分布的Ni活性位点抑止了碳链的增长,提高了低碳醇中乙醇的选择性。当Ni/Cu原料比为45∶100时,Cu、Ni之间的协同作用最强,表现出最好的反应活性和乙醇选择性。
- 燃料化学学报的其它文章
- 低温水热预处理对高蛋白小球藻N分布和藻渣热解特性的影响
- 高碱煤含钠矿物沉积层的高温熔融及多相反应过程分析
- Liquefaction of thermal extracts from co-thermal dissolution of a sub-bituminous coal with lignin and reusability of Ni-Mo-S/Al2O3 catalyst
- Interaction between low-rank coal and biomass during degradative solvent extraction
- 预热处理对褐煤热解过程氧元素迁移的影响
- 新型Brønsted-Lewis双酸位碳基固体酸的制备及其催化生物柴油的合成

