粪菌移植治疗炎性肠病的研究进展
张维兰综述 罗和生审校
炎性肠病(inflammatory bowel disease,IBD)是一种慢性的、致残的、会显著降低患者生活质量的肠道炎性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),其发病机制是多因素的且目前尚未完全明确[1]。有研究指出肠道微生态失衡与IBD的发展或恶化相关[2]。粪菌移植(fecal microbiota transplantation,FMT)治疗难辨梭状芽胞杆菌感染(recurrent Clostridium difficile infection,RCDI)非常有效,且早在2013年就已经被官方指南推荐为RCDI的标准疗法[3],尽管其具体机制尚不完全清楚,但是有研究指出FMT可通过增加肠道微生物群的多样性及恢复保护性肠道微生物群来改善微生态失衡,从而有利于治疗RCDI[4]。因为IBD和RCDI均存在微生态失衡,目前FMT也作为IBD的一种新疗法正在被研究。近期临床试验结果支持了FMT在IBD中的治疗作用,自Anderson等[5]于2012年首次发表关于FMT治疗IBD的系统综述以来,已有数篇Meta分析探讨了FMT治疗IBD的疗效。本文将对FMT治疗IBD的疗效、安全性等最新进展进行综述。
1 IBD的微生态失衡
肠道微生物群和IBD之间似乎存在显著的联系,但是并没有发现某单一的病原体作为致病因子[6],因此,目前的焦点已经转移到了微生态失衡这一整体概念上,即肠道有益菌与致病菌的不平衡。有研究指出在IBD患者中,微生态失衡与黏膜炎性反应和肠道上皮屏障改变有关[7]。IBD患者微生物群改变的特点是致病微生物增多,而有益菌如拟杆菌和厚壁菌门减少。IBD患者肠道细菌RNA测序显示保护性细菌如梭菌属或柔嫩梭菌群的多样性减少,而致病菌如大肠杆菌、弯曲杆菌、分枝杆菌和绿脓杆菌却大量繁殖[1]。新发CD患儿的微生态失衡表现为巴斯德菌科(嗜血杆菌)、韦荣球菌科、奈瑟氏菌科、梭杆菌科、肠杆菌科的增加,以及双歧杆菌科、丹毒菌科、梭菌目和拟杆菌目的减少。此外,Gevers等[8]还指出IBD患者存在微生态功能失调,包括基本生物合成的丧失以及转变成致病性营养缺陷型导致出现营养不良和氧化应激的疾病信号。然而是微生态失衡导致了IBD还是基因易感个体异常免疫反应导致了微生态失衡,这仍然是个尚未解决的问题[9]。鉴于有害微生物群可能在IBD的启动和发展过程中起作用,目前正在研究将FMT应用于IBD的治疗。
2 FMT治疗IBD的疗效
Paramsothy等[10]关于FMT治疗IBD的Meta分析纳入了53个研究,总体来说,FMT治疗UC的临床缓解率为36%(201/555),CD为50.5%(42/83);而就队列研究而言,FMT治疗UC的总临床缓解率为33%(95%CI23%~43%),CD为52%(95%CI31%~72%),两者均有中等程度的异质性(前者I2= 54% ,后者I2=52%),尽管存在一定的异质性,但这些数据也支持FMT对IBD的治疗有积极的影响,至少在一些患者中是这样的。目前关于FMT治疗CD的证据仅限于非随机对照试验,而有4个随机对照试验(randomised controlled trials ,RCTs)比较了FMT与安慰剂治疗UC的疗效。
2.1 FMT治疗UC 目前有4个RCTs评估了FMT治疗UC的近期疗效,各研究的特点及结果见表1。Costello等[15]对4个RCTs结果进行分析,得出FMT组临床缓解率为28%(39/140),而安慰剂组临床缓解率为9%(13/137),比值比(odds ratio,OR)为3.67 (95%CI1.82~7.39,P<0.001),各试验组间无显著异质性(I2=0%);FMT组临床应答率为49%(69/140),安慰剂组为28%(38/137),其OR为2.48 (95%CI=1.18~5.21,P=0.02),各试验组间有中等程度异质性(I2=52%);FMT组内镜下缓解(梅奥内镜评分=0)率为14%(20/140),安慰剂组为5%(7/137),OR值为2.69(95%CI1.07~6.74,P=0.04),I2=0%。Narula等[16]从相反的方向对RCTs结果进行分析,得出FMT组与安慰剂组未达到临床缓解的相对危险度(risk ratio,RR)为0.76(95%CI0.62~0.93,P=0.01) ,I2=31% , χ2=4.36 (df =3),P=0.23,同时指出其异质性是由Rossen等[12]的试验结果导致的,当去除这一试验结果时,其RR值为0.70 (95%CI0.58~0.85),I2=0% , χ2=1.37(df =2),P=0.50,无显著异质性;另外,FMT组与安慰剂组未达到内镜下缓解的RR为0.85(95%CI0.69~1.05,P=0.12),I2=77% , χ2=12.86 (df =3),P=0.000。Paramsothy等[10]也发现将Rossen等[12]的试验结果去除后各临床试验间的异质性明显减小以及FMT治疗UC的疗效更为明显,将4个RCTs结果一起分析时,FMT组与安慰剂组获得临床缓解的OR值为2.89(95%CI1.36~6.13,P= 0.006),有中等程度的异质性(I2=37%);FMT组与安慰剂组产生临床应答的OR值为2.48(95%CI1.18~5.21,P= 0.016),有中等程度的异质性(I2=52%);而去掉Rossen等[12]的试验结果后,两者获得临床缓解的OR值为4.05(95%CI2.08~7.89,P< 0.001),I2= 0%;两者产生临床应答的OR值为3.39 (95%CI1.90~6.04,P< 0.001),I2= 0%。最新一篇Meta分析[17]采用固定效应模式对RCTs结果进行分析得出FMT组有较高的临床应答率为59.23%,安慰剂组为39.13%,其OR值为2.73(95%CI1.45~5.15,P= 0 002);同时这篇文章分析了16篇关于FMT治疗UC的文献得出其总体临床应答率及临床缓解率分别为(46.18±25.08)%和(28.96±22.39)%。
2.2 FMT治疗CD 与UC相比,FMT治疗CD的疗效证据是有限的,且现有相关研究的结果好坏参半。目前尚无相关的RCTs,仅有几个小型研究探讨了FMT治疗CD的疗效。李宁等[18]对FMT治疗的10例CD患者进行回顾性分析得出其临床缓解率为30%,临床应答率为60%。一项纳入19例活动性CD患者的队列研究指出第4周时有58%(11/19)患者发生临床应答,而有55%(6/11)患者在12周的时间里存在持续临床应答[19]。另一个队列研究分析了FMT治疗难治性小肠CD的疗效,进行1次FMT后的第1个月,其临床应答率为86.7%(26/30),临床缓解率为76.7%(23/30)[20]。然而Vermeire等[21]的队列研究指出6例CD患者接受FMT治疗8周后并未获得临床应答或内镜下缓解;另外有一个研究指出CD患者接受FMT治疗后未获得临床缓解,但其生活质量有所提高[22]。Paramsothy等[10]的Meta分析通过分析6个队列研究结果得出FMT治疗CD总的临床缓解率为52%(95%CI31%~72%),有中等程度的异质性;另有研究指出该总缓解率受到其中一个有相对较大样本量和高治疗成功率的队列研究结果的影响,需辨证看待这一Meta分析结果[20,23]。综上,这些结果表明,FMT可能是CD患者潜在的治疗方法,但有待更为严谨的RCTs去证实FMT治疗CD的真正疗效。
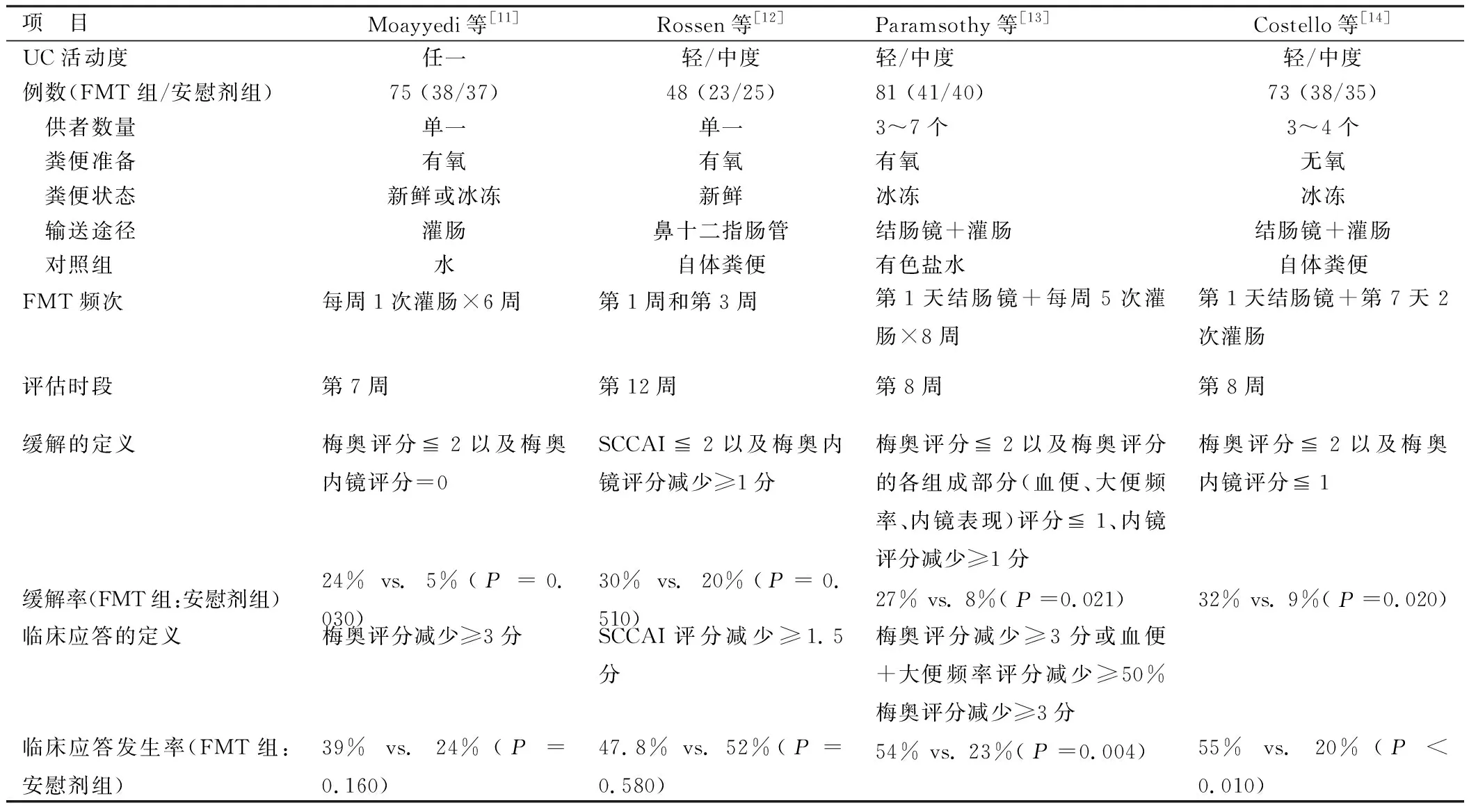
表1 FMT治疗UC的随机对照试验特点和结果
Syal等[23]指出FMT治疗CD可能比UC更具有挑战性并分析其可能的原因有以下几点:CD患者较UC患者有更为显著的肠道微生态失衡[24];FMT成功后可能不发生变化的黏膜附着细菌在CD的发病机制中起着重要的作用;再者,FMT的成功可能取决于将供者粪菌靶向转运到病变肠道,这对于小肠CD具有挑战性;最后,由于具有透壁性炎性反应特征,CD患者可能需要更频繁更持久的FMT治疗。
3 FMT治疗IBD疗效的相关因素
3.1 疾病严重度 中到重度IBD对局部黏膜治疗反应较差,通常需要全身治疗。Paramsothy等[13]发现FMT治疗UC的成功率与UC的临床和内镜下严重度呈反比。Ishikawa等[25]指出由FMT诱导的肠道微生物群再平衡不太可能发生于内镜下表现严重的IBD患者。此外,有些IBD患者接受FMT治疗后病情发生恶化,这引起了关注并有文献指出FMT对已经存在严重炎性反应性肠病的患者是有害的[23],因此FMT可能对轻中度IBD患者更有效。有待更进一步高质量研究去证实IBD初始严重程度与FMT治疗疗效的关系。
3.2 供者特点 粪菌供者的肠道微生物组成可能会对FMT治疗IBD产生最为深远的影响。多个研究已经指出IBD患者接受FMT治疗后产生临床反应与供者微生物组成息息相关,产生临床反应者较无反应者肠道微生物更具多样性及和供者肠道微生物群组成更相似[11,19,21,26]。以往大多数研究中的供者和受者是有关系的(如亲戚、朋友或者配偶),这可能是因为最初认为使用与受者相关的供者可能会使受者对FMT产生更好的耐受性[27]。然而,有研究发现IBD患者的亲属自身可能也存在肠道菌群失衡[28-29],因此,目前的研究通常采用与受者不相关的供者粪菌进行FMT。 Cao等[17]在其Meta分析的亚组分析中指出相关供者组的临床缓解率为27.79%(P= 0.23,I2= 31.1%),而不相关供者组的临床缓解率为36.95%(P= 0.4,I2= 0.0%)。另外,接受某一特定供者粪菌较接受其它供者粪菌的受者更有可能获得临床缓解。这在Moayyedi等[11]的临床试验中得到了强调,接受供者B粪菌的UC患者的临床缓解率为39%,而接受其他供者粪菌的UC患者临床缓解率为10%(P=0.06)。Paramsothy等[13]试图通过使用多供者粪菌来规避供者优势,然而,事后分析的结果显示,接受了某一特定供者粪菌的患者中有37%达到了治疗主要终点,而接受了其他供者粪菌的患者仅18%达到了治疗主要终点(P= 0.054)。因而,在进一步的研究能够确定FMT最合适的粪菌供者之前,使用多供体粪菌是确保供体微生物多样性和丰富性的最佳方法。
3.3 供者粪菌状态 从理论上来说,采用新鲜粪菌对IBD患者进行FMT应该更为有效,因为冷冻和解冻粪便的过程会使部分细菌失效。然而,有研究指出用新鲜和冰冻粪菌对CD患者进行FMT所产生的疗效相当[4]。Moayyedi等[11]的临床试验结果显示应用冰冻粪菌进行FMT较新鲜粪菌更易获得临床缓解(40% vs. 15%;P=0.06),但这一结果可能受到接受某一特定供者粪菌相关成功的干扰。Cao等[17]的Meta分析也得出类似的结果,新鲜粪菌组获得的临床缓解率为25.3%,冰冻粪菌组为43.9%,而这一结果也应该与混杂因素一起考虑,比如输送粪菌的次数和方式。对粪便进行无氧处理的FMT可能具有理论上的优势,因为与结肠健康相关的一些细菌(如柔嫩梭菌群)是专性厌氧微生物[30]。然而,Costello等[14]对粪便进行无氧处理进行FMT获得的疗效与其他未进行无氧处理的临床试验获得的疗效相似。因此,需要进一步的研究来确定哪种状态的粪菌进行FMT疗效更好。
3.4 输送方式 粪菌输入途径主要包括:上消化道途径主要是口服肠溶胶囊,中消化道途径主要通过鼻肠管、胃镜、经皮内镜胃造瘘空肠管,下消化道途径包括结肠镜、灌肠、结肠造瘘等。目前采用较多的途径为鼻肠管、结肠镜和灌肠[31],目前较新的一个途径是经内镜肠道置管输注(transendoscopic enteral tubing,TET)[32],但最有效的输送方式尚不明确。对于UC,尽管保留灌肠比经结肠镜输送粪菌更便宜、安全,但经结肠镜输送可能更有效,因为经结肠镜可以将更大量的粪菌直接输送到病变肠道处[16],同时还有利于临床医生进行全面的黏膜评估以判断疗效[33]。Ishikawa等[25]指出UC患者经结肠镜进行FMT的临床缓解率为52.94%;Paramsothy等[13]的临床试验结果显示经灌肠进行FMT的临床缓解率为43.9%。而Cao等[17]的Meta分析结果显示灌肠组的临床缓解率为33.37%(95%CI0.25~0.41),I2= 8.4%,结肠镜组为25.74%(95%CI0.19~0.44),I2= 58.3%,但需排除一些不明干扰因素。另外,目前多数研究支持经下消化道途径较经上消化道途径对IBD患者进行FMT疗效更好,因为经上消化道途径注入的粪菌液可能在其到达结肠前其内的一些成分的活性会受到影响(如胃酸会破坏拟杆菌门)[34]。经结肠镜(约20%)与经鼻十二指肠管(10%)输送粪菌的临床试验相比,前者FMT组与安慰剂组的疗效差异更大[11-14]。Paramsothy等[10]指出UC患者经上消化道途径进行FMT的临床缓解率较经下消化道途径低(17% vs. 36%)。国内外对FMT移植途径还没达到统一共识,主要根据患者的意愿、自身情况承受能力、病情特点及医师的临床经验来决定个体化移植途径[35]。有待进一步高质量的临床研究去探讨FMT治疗IBD时最佳输送方式。
3.5 FMT执行的频次及维持时间 有文献指出对IBD患者进行更频繁及维持时间更长的FMT可能会产生更好的疗效[23]。这可能解释了为什么对UC患者进行相对频繁FMT的临床试验较仅进行2次FMT的临床试验结果更成功[11-13]。Paramsothy等[10]的Meta分析结果显示接受了≥10次FMT的UC患者较<10次的UC患者的临床缓解率更高(49% vs. 27%)。然而Costello等[14]的临床试验仅对UC患者进行了3次FMT就获得较为理想的疗效,这对多频次强化治疗的必要性提出了质疑。这可能存在太少不够,太多又不必要的情况,因而需要进一步的研究去探索FMT最佳执行频次。迄今,所有关于FMT治疗IBD的研究都主要评估了近期疗效,但有文献[31]指出IBD患者接受FMT治疗后,其肠道菌群随时间变化的长期趋势不容乐观,靶向性微生态疗法可引起肠道微生物群快速变化,但治疗结束后肠道微生态逐渐恢复到治疗前状态,FMT 可能很难通过短暂操作来达到永久缓解IBD的目的。Paramsothy等[13]的临床试验结果显示经过8周FMT强化治疗获得临床缓解的患者中有34%在第16周复发了。同样,Vaughn等[19]指出接受1次FMT治疗的CD患者在第4周获得了临床缓解,而在第8、12周的复发率分别为27%、45%。因此在FMT强化诱导阶段结束后需要一段低强度的FMT维持治疗时期[23],但具体方案至今尚不明确,将来的研究需进一步探索FMT治疗有效的IBD患者的维持治疗方案。
4 FMT治疗IBD的安全性
由于缺乏长期随访的研究,FMT治疗IBD的远期安全性数据有限,但就目前的研究结果来看,FMT治疗IBD整体而言是相对安全的。进行FMT时,往往担心经粪便传播的传染性病原体会从供者传染给受者导致受者感染,Schwartz等[36]报道了2例接受了FMT治疗的复发性CD患者患上了诺如病毒胃肠炎;Hohmann等[37]报道了1例UC患者自行粪菌灌肠后发生了巨细胞病毒结肠炎。其实,经过严格的供者筛选过程,传染性病原体传播的风险是很低的。包括RCTs在内的多个研究都报道了IBD患者接受FMT治疗后不久会出现短暂的不良反应,包括发热、腹痛、腹泻加剧以及C-反应蛋白上升,这些患者中仅1例发生了多重耐药大肠杆菌菌血症[38]。
有文献报道了接受FMT治疗的一些IBD患者发生病情恶化,且有部分需行结肠切除术[39-40],但由于这些研究缺乏对照组而限制了这一发现的重要性。关于FMT治疗UC的临床试验也报道了IBD的恶化,最终共有2例患者接受了结肠切除术[11-13];然而,FMT组和安慰剂组在不良反应和IBD恶化方面并无显著统计学差异。Qazi等[41]的Meta分析指出IBD接受FMT治疗后的总恶化率为14.9%,然而在高质量研究和随机临床研究中该率值低至4.6%。总的来说,在FMT治疗IBD缺乏可靠的安全数据的情况下,必须对供者粪便传染性病原体进行彻底检测后方可进行FMT以及最好避免对严重IBD患者进行FMT。
5 结 语
综上,FMT可能是IBD患者一种有前景、相对安全的治疗方法。关于FMT治疗UC的RCTs已经证实某些UC患者接受FMT治疗可以获得临床缓解。另外,未来需要RCTs去证实FMT治疗CD在小型队列研究中显示出来的疗效。与FMT治疗IBD疗效相关的一些因素(如疾病初始严重程度、供者特点、粪菌状态、输送方式、FMT执行的频次及维持治疗方案)尚有许多未知的领域有待进一步的研究去探索。总之,在FMT成为IBD主要治疗方法之前,还需更大型、高质量的研究去证实其长期疗效、安全性以及最佳供者及其粪菌状态、最佳输送方式、最佳强化及维持治疗方案。

