共信号分子CD28、ICOS、PD-1、CTLA-4在系统性红斑狼疮患者外周血中的表达水平及意义
白冷媚,谢传美
(川北医学院附属医院风湿科,四川 南充 637000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种以多系统损害为主要临床表现,以多种特异性自身抗体阳性为主要实验室特征的慢性自身免疫性疾病。目前研究显示其病因及发病机制可能与环境因素、基因、固有免疫和获得性免疫、特定的器官损害有关[1]。
随着研究深入,发现许多细胞因子(IL-6、IL-17等)参与免疫性疾病的发生发展,且已在风湿病中进行了临床试验[2]。近年来又发现一些新的抗原如CD28、可诱导共信号分子(inducible co-stimulator,ICOS)、程序性坏死分子1(programmed death-1,PD-1)和细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4/CD152)这样的共信号分子,它们在SLE等多领域的疾病中均异常表达,通过阻断上述共信号分子通路作为免疫系统疾病的靶点治疗,或可成为一种新型的治疗方案。CD28和ICOS是正性共信号分子[3](共刺激分子),主要参与激活T细胞;PD-1及CTLA-4作为负性共信号分子[4](共抑制分子),主要抑制淋巴细胞活化,它们的共同作用维持着体内免疫应答及免疫耐受的平衡。查阅国内外文献发现,部分上述共信号分子在SLE患者外周血中的表达水平尚有争议。
基于目前国内外的文献资料,涉及同一患者活跃期与非活跃期自身对照的研究还很少,故拟采用FCM检测CD28、ICOS、PD-1、CTLA-4在SLE患者活跃期外周血中CD4+T细胞上的表达水平,并与自身对照组及健康对照组比较,探讨上述共信号分子是否与疾病活动度有关,以此初步推测在上述4种共信号分子中哪1种或哪几种共信号分子占主导地位。
1 材料与方法
1.1 研究方法
本研究采用病例对照研究,应用免疫荧光标记和流式细胞术检测20例SLE活跃期患者及30名健康体检者外周血CD4+T细胞表面上CD28、ICOS、PD-1、CTLA-4的表达水平,并以上述狼疮患者非活跃期作为自身对照,同时统计所有受试者的基本资料、各项临床数据及实验室检查结果,分析各实验室数据之间的差异是否有统计学意义,以及共信号分子与疾病活动度的相关性。
1.2 研究对象
收集2015年6月至2017年11月川北医学院附属医院风湿血液科住院及门诊20例SLE患者。
应用免疫荧光标记和流式细胞术检测各受试者外周血CD4+T细胞上4种共信号分子的表达水平。其中女性18例,男性2例,年龄10~57岁,平均(38.50±13.10)岁,病程0~20年,平均(3.9±4.52)年(其中15例为初诊患者),活跃期SLE患者SLEDAI评分均≥10分平均(15.3±4.18)分。非活跃期患者SLEDAI评分均≤6分平均(3.9±1.33)分;健康对照组为30名女性健康体检者,年龄24~63岁,平均(35.67±11.82)岁。各组间性别、年龄无显著性差异。所有患者均符合美国风湿病学会(ACR)1997年修订的SLE诊断标准[5],排除合并以下疾病的患者:(1)感染;(2)恶性肿瘤、慢性肾炎、甲状腺疾病等;(3)重叠综合征。同时记录所有SLE患者的一般资料,包括症状、体征、实验室检查结果、影像学检查结果等。
1.3 实验方法
1.3.1 外周血的采集和保存 所有受试者均清晨空腹采集外周血标本1 mL,室温下EDTA抗凝,及时(6 h内)行流式细胞术检测。
1.3.2 流式细胞术检测 流式细胞术检测外周血CD4+T细胞上CD28、ICOS、PD-1、CTLA-4的表达水平。
1.4 统计学分析

2 结果
结果显示,在活跃期组、非活跃期组及健康对照组外周血CD4+T淋巴细胞上,4种共信号分子(CD28、ICOS、PD-1、CTLA-4)均表达。
2.1 CD28
活跃期组外周血CD4+T细胞上CD28的表达为(46.53±14.55)%,与健康对照组[(40.78±14.51)%]比较差异无统计学意义(P=0.176,P>0.05),与自身对照组[(31.39±16.29)%]比较,差异有统计学意义(P=0.045,P<0.05),活跃期组高表达。见图1。

2.2 ICOS
活跃期组与健康组、自身对照组ICOS的表达分别为(1.9±0.98)%、(1.76±1.18)%、(1.749±0.67)%,差异均无统计学意义(P=0.6839,P>0.05;P=0.5863,P>0.05)。见图2。
2.3 PD-1
活跃期组PD-1的表达为(10.88±4.09)%,较健康组(4.65±3.08)%显著升高(P<0.001),与自身对照组(6.67±4.00)%比较也有显著差异(P=0.002)。见图3。

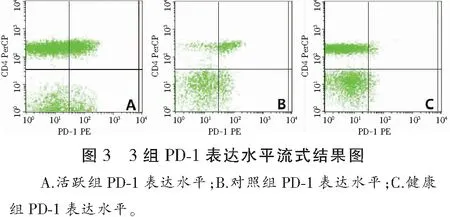
2.4 CTLA-4
活跃期组(0.16±0.13)%与健康组(0.67±0.83)%比较差异有显著统计学意义(P=0.008,P<0.01);非活跃期组(0.17±0.13)%与健康组比较差异有统计学意义(P=0.01,P<0.05);但20例自身对照组差异无统计学意义(P=0.724,P>0.05)。见图4。

经过统计学分析发现,CD28、ICOS的表达与SLEDAI呈正相关性,PD-1、CTLA-4的表达与SLEDAI呈负相关性,但4种共信号分子与SLEDAI均无明显相关性(表1,图5-图6)。


表1外周血CD4+T细胞上4种共信号分子表达水平与SLEDAI的相关性

组别r值(Spearman)CD28 vs SLEDAI0.110 609ICOS vs SLEDAI0.047 729PD-1 vs SLEDAI-0.280 311 CTLA-4 vs SLEDAI-0.050 058
上述4种共信号分子与SLEDAI的|r|均<0.3。
3 讨论
人体获得性免疫应答和造血动态平衡的维持需要T淋巴细胞增殖的精确调节,要完全激活静止的T细胞需要CD28、ICOS这样的受体,而抑制淋巴细胞活化则需要PD-1和CTLA-4这样的受体转导信号。这种正/负信号的平衡能够在维持机体免疫耐受的同时保证有效的免疫应答以及防止自身免疫[4]。
CD28通过激活磷脂酰肌醇3-激酶(PI3K),影响细胞因子的合成和存活[4],同时促进T 细胞活化、IL-2生产和 T 细胞的存活[6]。
在本实验中,仅自身对照组之间差异有统计学意义(活跃期组高表达)。既往有研究显示CD28在患者血清中高表达,但与SLEDAI评分无相关性[7-8]。而1996年的一项研究指出狼疮患者CD28+T细胞选择性降低,且是由于CD28-介导的协同信号影响了T细胞对激活诱导细胞死亡(activation-induced cell death,AICD)的易感性[9]。本实验统计学显示自身对照组之间差异有统计学意义,但由于样本量较少,上述结果是否有意义尚不明确。现有文献中,Bijl等[10]的一项类似研究与本实验结果相近,除结果外,该研究与本实验相似处还在于样本量也较少,故在后续的实验中可通过进一步扩大样本量来证实CD28是否异常表达。
同样作为共信号分子的ICOS有24%氨基酸序列与CD28同源, CD28可增强ICOS的表达,当缺乏CD28的配体B7-1和B7-2时其表达的上调则显著降低,故据此推测ICOS可能为活化后的T细胞提供共刺激信号[6]。虽然ICOS的表达水平是否存在差异仍有争议,但有文献显示ICOS在SLE患者中高表达[10-13]。
本实验结果显示ICOS的表达差异无统计学意义,与CD28的检测结果一致。查阅国内外文献发现,二者的表达有一致性,由于本实验是使用同一样本同时检测4种共信号分子,那么上述检测结果是否可以用ICOS与CD28的一致性来解释,或仍然是由于样本量少而使得阳性结果尚不能被检测出来?要证实上述猜测仍需要进一步收集样本量来解决。
PD-1亦属于免疫球蛋白超家族,它通过阻止CD28介导的磷脂酰肌醇3-激酶活化来抑制蛋白激酶磷酸化,从而对T细胞活化起负性调节作用。SLE以T细胞的异常活化为特征,机体为维持免疫平衡增加PD-1的表达,从而达到负性调节的作用。同时也有研究证实缺失PD-1的小鼠更容易患自身免疫性疾病[4,14-18]。
本实验结果显示PD-1在SLE患者中较健康对照组显著高表达,且活跃期组较对照组仍高表达,这一结果与既往文献相符[17]。
CTLA-4的作用机制尚未研究清楚,但多项研究已经证实其主要功能是下调T细胞反应。早年Liu等[19-20]的研究发现与健康对照组相比,SLE患者CTLA-4阳性T细胞的百分比显著增加。但其后的一项研究显示在诱导后SLE患者表达的T细胞中,CTLA-4的表达较健康对照组低。随后Lee等[21]发现在活跃期SLE患者中,CD4+CD25+Treg细胞的百分比较非活跃期SLE患者及健康对照组显著降低,同时发现在活跃期SLE患者外周血PBMCs中,CD4+T细胞上CTLA-4的表达较非活跃期及健康组升高,由于CD4+T细胞上CTLA-4的优先表达主要受限于Treg细胞,由此推测CTLA-4的表达可能与活跃期SLE患者免疫防控功能所致的Treg细胞介导的抑制功能活化相关。
本实验结果显示活跃组组CTLA-4较健康组低表达,而自身对照组差异无统计学意义。曾有文献报道在小鼠的一项实验中,刺激后的CTLA-4相较于细胞表面,更多的是在细胞质表达[22],同时也有研究推测其低表达可能是由于CTLA-4为瞬时表达并快速的进入细胞质[23-24],那么通过流式细胞术检测细胞表面的CTLA-4的表达便尤为困难,或许这可以解释为何在SLE患者外周血CD4+T细胞表面上CTLA-4的表达是降低的,同时也不排除其低表达是否与SLE患者CTLA-4分子下调功能的受损或与“T细胞耗竭”有关。要证实上述观点仍需要进一步的实验或其他实验室检测方法。

