PPy含量对Fe2O3/PPy锂离子电池负极材料性能的影响
何声太,吴垚震,高 海
(天津工业大学 天津市先进纤维与储能技术重点实验室,天津 300387)
伴随着便携式电子产品的增长,对拥有优越电化学性能的可充电电池提出了更高要求.其中,高能量密度的锂离子电池受到广泛欢迎,被应用于各种电子设备,拥有十分良好的发展前景[1-2].而石墨作为传统负极材料,提供的理论比容量仅为372 mA·h/g,一定程度上限制了其进一步的应用[3].近年来,金属氧化物材料以其良好的化学稳定性和较高的理论比容量而受到高度重视.其中,α-Fe2O3纳米材料的理论容量达到1 006 mA·h/g,还具有成本低、环保、资源丰富等优点,预计将满足未来能源储存的要求[4-5].但是,Fe2O3在嵌脱锂过程中有着巨大的体积变化,导致材料团聚和粉碎,最终造成电池严重的容量损失,同时其导电性较差,不利于电子的高效传输.为了解决这些问题,一方面,研究人员制备了不同形貌和结构的Fe2O3负极材料,例如Fe2O3纳米粒子、棒状结构、片状结构、花状结构、中空球结构、管状结构等[6-11];另一方面是将Fe2O3与碳类材料复合[12].
在锂离子电池中常用的碳材料有碳纳米管、碳纳米纤维、石墨烯、导电聚合物等[13-19].其中,吡咯以其合成简单、成本低、电子导电性好等优点,被认为是最有前景的导电聚合物之一,广泛用于电极材料的涂层来提高电极的结构稳定些.研究表明,聚吡咯(PPy)具有良好的力学性能和化学稳定性,在电化学反应中作为保护层能够抑制电极材料团聚和溶解,增强材料导电性,可以显著提升循环性能和倍率性能.
本文采用水热法合成Fe2O3纳米片,然后采用原位聚合法合成了不同PPy含量的Fe2O3/PPy复合材料,并对材料的微观结构和电化学性能进行研究.
1 实验部分
1.1 材料和仪器
主要材料:FeCl2·4H2O(分析纯)、K2SO4(美国化学学会标准)、甘油(美国化学学会标准)、吡咯(化学纯)、氮甲基吡咯烷酮(分析纯),均为上海阿拉丁生化科技股份有限公司产品;电解液、聚偏氟乙烯、导电炭黑、隔膜、铜箔、锂片、电池壳,均为电池级,深圳市科晶智达科技有限公司产品.
主要仪器:DHG-9070A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司产品;DHG-9035A型鼓风干燥箱,上海一恒科技有限公司产品;DZF-6020型真空干燥箱,巩义市予华仪器有限责任公司产品;STX-Z型手套箱,南京科析实验仪器研究所产品;D/MAX-2500型X-射线衍射仪,日本理学公司产品;Gemini SEM500型场发射扫描电子显微镜,德国ZEISS公司产品;CHI-660E型电化学工作站,上海辰华仪器公司产品;CT2001A型蓝电电池测试系统,武汉蓝电电子股份有限公司产品.
1.2 Fe2O3和Fe2O3/PPy的合成
在35 mL去离子水中加入5 mL甘油,然后依次加入0.8 g FeCl2·4H2O和0.7 g K2SO4,超声处理15 min.然后将混合溶液转移进100 mL聚四氟乙烯内衬的高压釜中,从室温升温至180℃,保持4 h.待冷却至室温后,用去离子水和无水乙醇反复洗涤、离心,将沉淀于80℃下鼓风干燥12 h,收集,得到Fe2O3样品.
将0.07 g Fe2O3加入到50 mL去离子水中,常温下搅拌至分散均匀.然后依次加入0.1 g FeCl3·6H2O和4 μL吡咯,继续搅拌24 h.反应完成后,用去离子水和无水乙醇洗涤、离心,将沉淀于80℃下鼓风干燥12 h,收集,得到PPy质量分数为5.0%的Fe2O3/PPy,命名为Fe2O3/5.0%PPy.其他条件不变,分别加入 2 μL和6 μL Py,合成了Fe2O3/2.5%PPy和Fe2O3/7.5%PPy.
1.3 Fe2O3和Fe2O3/PPy的结构表征
使用D/MAX-2500型X-射线衍射仪对样品进行物相和结构分析,辐射源为Cu靶Kα线,管电压40 kV,管电流 150 mA,扫描范围 20°~80°,扫描速率 8 °/min;使用Gemini SEM500型场发射扫描电子显微镜观察材料表面微观形貌和尺寸.
1.4 Fe2O3和Fe2O3/PPy的电化学性能测试
将合成的样品、导电剂(导电炭黑)和粘结剂(聚偏氟乙烯)以质量比70∶20∶10的比例与溶剂(氮甲基吡咯烷酮)混合成均匀浆料,涂覆在铜箔上,然后置于真空干燥箱,在60℃下真空干燥12 h,将干燥好的极片裁片并称量.将电极片转移进充满氩气、水和氧质量浓度均在0.5×10-6mg/mL以下的手套箱中,以制备的极片为正极,锂片为对电极和辅助电极,溶有1 mol/L LiPF6的EC+DMC+EMC(体积比 1∶1∶1)溶液为电解液,Celgard 2400膜为锂离子电池隔膜,组装成CR2430型扣式电池.
采用CHI-660E型电化学工作站进行循环伏安和交流阻抗测试,电压扫描区间为0~3 V,扫描速率为0.5 mV/s;采用CT2001A型蓝电电池测试系统进行恒流充放电测试,电压窗口为0.1~2.5 V.
2 结果与讨论
2.1 XRD分析
图1为Fe2O3/PPy复合材料的XRD图.

图1 Fe2O3和Fe2O3/PPy复合材料的XRD图Fig.1 XRD patterns of Fe2O3and Fe2O3/PPy composite
由图1可知,不同PPy含量的Fe2O3/PPy复合材料均表现出明显的Fe2O3的衍射峰,峰位与纯Fe2O3一致,表明Fe2O3与PPy复合后晶型没有发生明显变化,均为JCPDS 33-0664的赤铁矿α-Fe2O3,且曲线中没有出现明显杂峰,表明制备的样品纯度较高.图1中位于24.2°、33.2°、35.6°、40.9°、49.5°、54.1°、57.6°、62.4°和64.0°的衍射峰分别对应于 Fe2O3的(012)、(104)、(110)、(113)、(024)、(116)、(018)、(214)和(300)的晶面.由于PPy呈聚合物状态,因此,图1中没有其明显的特征峰.
2.2 SEM分析
Fe2O3/PPy复合材料的SEM照片如图2所示.

图2 Fe2O3和Fe2O3/PPy复合材料的SEM图Fig.2 SEM images of Fe2O3and Fe2O3/PPy composite
由图2(a)可知,Fe2O3呈片状结构,层叠在一起,表面较光滑.Fe2O3与PPy复合后,PPy粒子附着在Fe2O3片表面,整体呈现粗糙形貌.由图 2(b)—图 2(d)可知,随着PPy含量增加,Fe2O3表面的PPy增加,最终被PPy粒子包覆.
2.3 电化学性能分析
对Fe2O3/PPy进行了电化学性能测试,结果如图3所示.
图3(a)为电流密度为200 mA/g时的循环性能图.很明显,不同PPy含量的Fe2O3/PPy复合材料的循环性能均优于纯Fe2O3,其中,Fe2O3/5.0%PPy的循环稳定性最好,首次库仑效率达到75.1%.Fe2O3/2.5%PPy、Fe2O3/5.0%PPy和Fe2O3/7.5%PPy的首次放电比容量分别为1 306.4、1 342.3和1 217.7 mA·h/g,经过100周充放电循环后,其比容量分别为244.6、487.4和319.0 mA·h/g,均高于纯Fe2O3(172.6 mA·h/g).复合材料表现出较好的稳定性,这是由于PPy层提高了电极稳定性:一方面,PPy层作为保护层能够缓冲Fe2O3膨胀,阻止团聚,提高Fe2O3的结构稳定性;另一方面,PPy层能阻止Fe2O3与电解液直接接触,有效保护了Fe2O3.
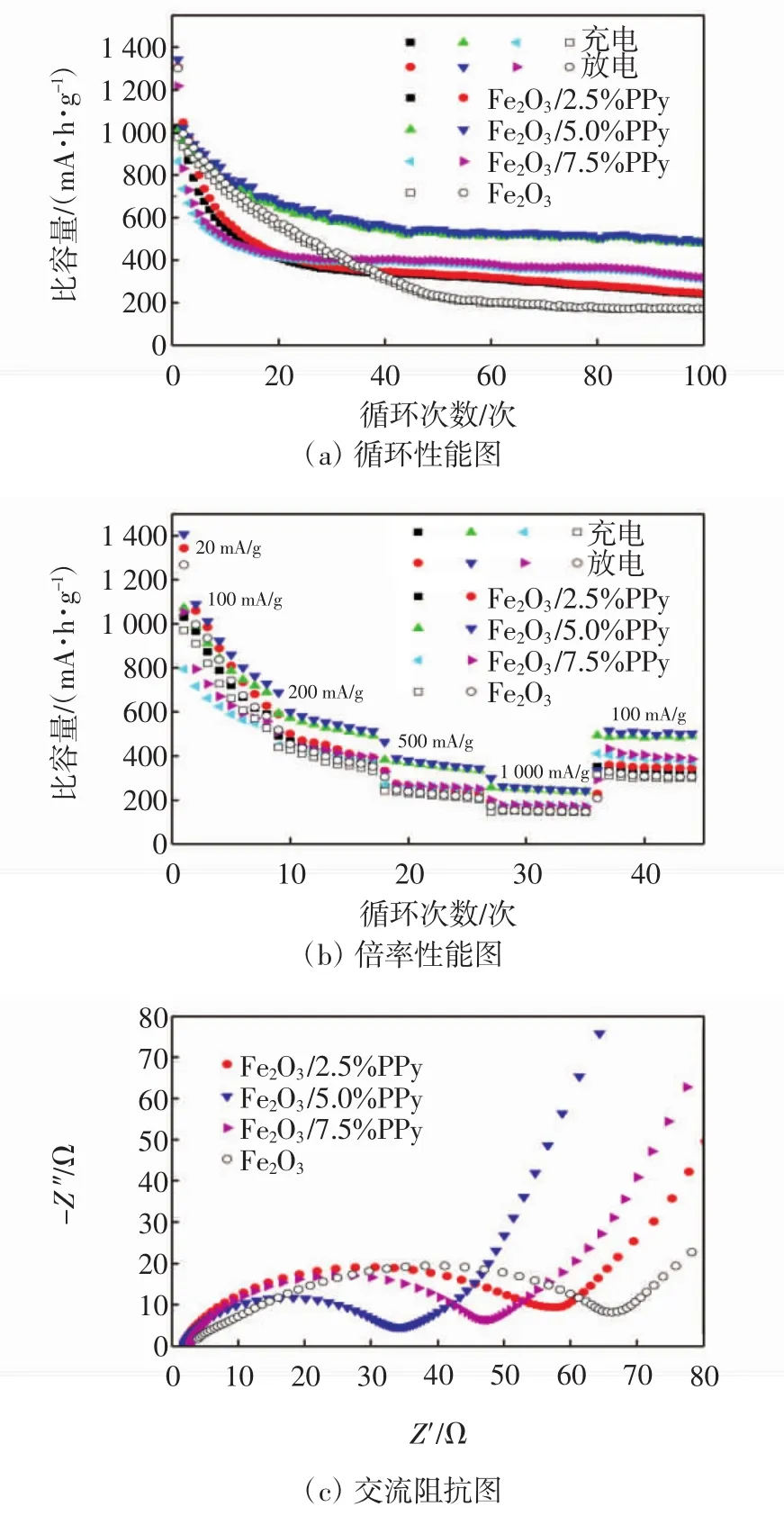
图3 Fe2O3和Fe2O3/PPy的电化学特性Fig.3 Electrochemical characteristics of Fe2O3and Fe2O3/PPy
图3(b)为倍率性能图,可见复合材料表现出较好的倍率性能,其中Fe2O3/5.0%PPy的性能最好,当电流密度为100 mA/g时,经过8次充放电其比容量为729.1mA·h/g.经过高倍率充放电,当电流密度重新回到100 mA/g后经过9次循环,比容量达到501.1 mA·h/g,而 Fe2O3/2.5%PPy、Fe2O3/7.5%PPy和 Fe2O3分别为343.6、385.9和306.2 mA·h/g.此外,当电流密度为100 mA/g时,Fe2O3的比容量高于Fe2O3/7.5%PPy,这是由于其中有效活性物质较少,导致容量有一定下降.但是经过一定次数循环后,纯Fe2O3容量衰减严重,而复合材料容量衰减较慢,即复合材料的稳定性有所提高,与图3(a)中循环性能的结果一致.
图3(c)为Fe2O3和Fe2O3/PPy的交流阻抗图.曲线由高频区的半圆和低频区的倾斜直线2部分组成.高频区半圆的直径代表电荷传递引起的电荷迁移电阻,直径越小代表内阻越小,而低频区的直线与电极反应的反应物或产物的扩散有关.由图3(c)可以看出,不同PPy含量的Fe2O3/PPy曲线的半圆直径均小于纯Fe2O3,表明复合材料拥有较小的阻抗,这是由于PPy层增加了材料与电解液的接触面积且增强了材料导电性,有利于Li+和电子传输.其中,Fe2O3/5.0%PPy拥有较小的阻抗值,再一次证明了其较好的电化学性能.
由上面的电化学性能测试结果发现,Fe2O3/5.0%PPy拥有较好的储锂性能.从SEM图像看出,Fe2O3/2.5%PPy中PPy含量较少,大部分Fe2O3处于裸露状态,PPy没有起到保护作用;Fe2O3/7.5%PPy中PPy含量多,PPy层厚,不利于Li+在Fe2O3中嵌入和脱出.而Fe2O3/5.0%PPy中PPy含量适中,既能够有效缓冲Fe2O3在充放电中的体积变化,同时不会因厚度过厚而影响Li+在Fe2O3中嵌脱.下面对Fe2O3/5.0%PPy作进一步讨论,其电化学特性如图4所示.
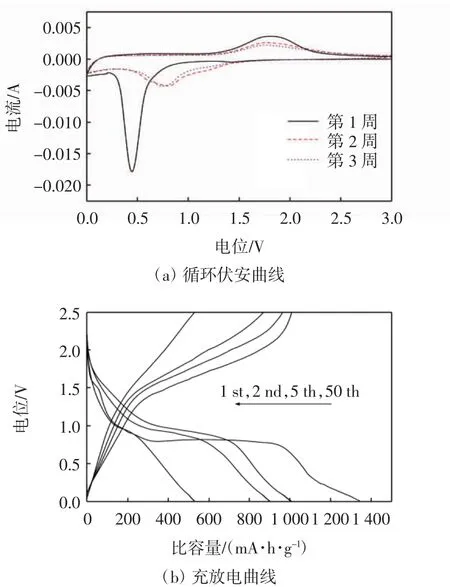
图4 Fe2O3/5.0%PPy的电化学特性Fig.4 Electrochemical characteristics of Fe2O3/5.0%PPy
图4(a)为Fe2O3/5.0%PPy的前3周循环伏安曲线图.首次放电中,在0.5 V附近出现了一个强还原峰,对应于Fe3+还原为Fe0以及电解液的不可逆分解.在1.6~1.9 V附近出现一个宽泛的氧化峰,对应于Fe0氧化为Fe2+然后氧化为Fe3+过程[20].在以后的反应中,曲线几乎重合,表明Fe2O3/5.0%PPy在嵌脱锂过程中的结构稳定性较好.图4(b)为Fe2O3/5.0%PPy在电流密度为200 mA/g下的充放电曲线.在首次放电中,位于1.7~1.5 V和1.5~0.8 V的缓坡分别为六方LixFe2O3的形成和其转换为立方LixFe2O3的过程.在0.8 V附近的长平台对应于Fe2+的还原和SEI膜的形成.在首次充电中,1.5~2.2 V的平台表示Fe0的氧化过程[21].
3 结论
采用水热法和原位聚合法分别合成了Fe2O3和不同PPy含量的Fe2O3/PPy,然后研究了它们的电化学性能.结果表明:
(1)SEM分析显示,PPy纳米粒子附着在Fe2O3纳米片表面.
(2)电化学性能测试表明,Fe2O3/5.0%PPy的循环性能最好,当电流密度为200 mA/g时,首次放电比容量为1 342.3 mA·h/g,首次库仑效率达到75.1%;经过100次循环后,放电比容量为487.4 mA·h/g,高于其他PPy含量的复合材料和Fe2O3的放电比容量.
(3)复合材料表现出比较优异的电化学性能,这主要是由于PPy能有效抑制Fe2O3在嵌脱锂过程中的体积变化和团聚,增强材料导电性,阻止Fe2O3在电解液中发生不可逆溶解.

