莱州湾扇贝养殖区环境因子的变化特征及其对浮游植物的影响
杨俊丽,李希磊,于 潇,崔龙波
(烟台大学生命科学学院, 山东 烟台264005)
莱州湾是黄、渤海渔业生物的主要产卵场、栖息地和传统渔场,拥有莱州湾单环刺螠、近江牡蛎等多个国家级水产种质资源保护区[1],更是海湾扇贝主要养殖区之一.近年来,对莱州湾近岸海水中营养盐、富营养化以及有机污染的研究已有不少报道[2-4],对莱州湾浮游植物群落结构的研究也逐渐增多[5-7],但对该海域浮游植物与环境因子的相关性研究却鲜有报道,特别是养殖区海域.浮游植物是海洋生态系统最重要的初级生产者,还是海水养殖活动的重要支撑(鱼、虾、贝类等经济生物的天然饵料),其数量、物种组成等群落结构的变化对扇贝等海洋生物的生长产生着重要影响,而浮游植物群落结构的变化又受到水温、pH值以及营养盐等环境因子的影响,所以研究养殖区内环境因子的变化及其对浮游植物的影响对扇贝养殖具有重要意义.本研究选取莱州湾8个扇贝养殖区作为研究海域,在扇贝养殖期间对其进行为期8个月的调查,分析其环境因子的变化、浮游植物的群落结构特征以及环境因子的变化对浮游植物影响,以期实时、全面地反映莱州湾扇贝养殖区生态环境水域的变化趋势,影响浮游植物生长的限制因素,旨在为提高扇贝健康养殖和环境保护提供科学参考.
1 材料与方法
1.1 采样时间与站位设置
在莱州湾设置了8个站点(见图1),分别位于莱州、招远和龙口,均养殖海湾扇贝,记为L1—L8,每个站点设置4个平行采样点,于2016年4—11月每月中旬共进行了8个航次的调查,最后取其平均值记录实验结果.
1.2 样品的采集与处理
研究海域水深范围为8~14 m,用有机玻璃采水器分别采集表层(距水面2 m)和底层(距海底2 m)的水样,然后等量混合.现场采用美国奥立龙便携式水质分析仪(520M-01A)实时监测海水中水温、盐度、pH值和溶解氧(DO);取1 000 mL水样于聚乙烯瓶中,经冷藏暂存后,带回实验室参照《海洋监测规范》[8]指定方法进行营养盐检测;另取1 000 mL水样于棕色瓶子中,加入15 mL的鲁哥氏液,带回实验室,用于浮游植物的鉴定与计数.
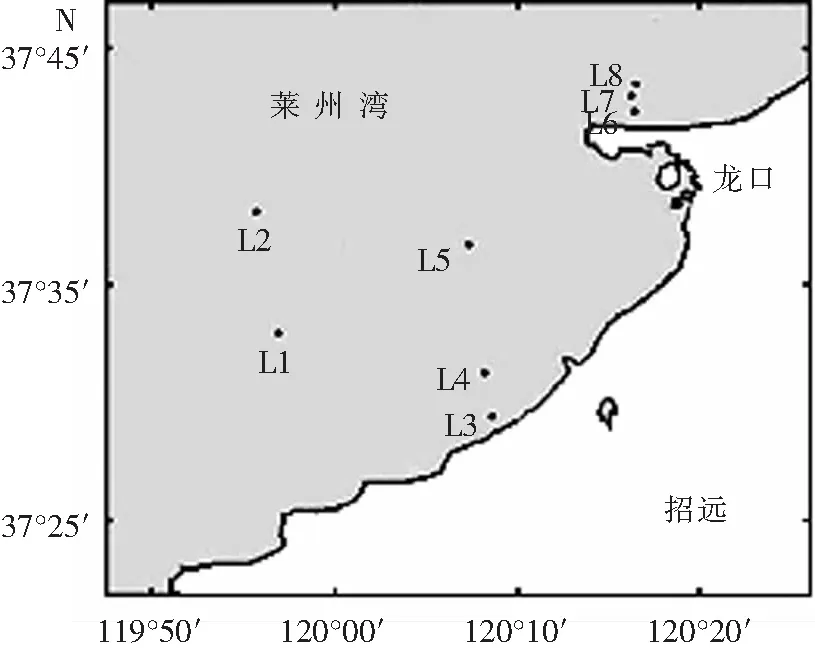
图1 莱州湾海域扇贝养殖区调查站位Fig.1 Sampling stations of shellfish culture areas in Laizhou Bay
1.3 水质检测方法
化学需氧量(COD)采用碱性高锰酸钾法测定,亚硝酸盐(NO2-N)采用萘-乙二胺分光光度法测定,硝酸盐(NO3-N)采用镉柱还原法测定,氨氮(NH3-N)采用靛酚蓝分光光度法测定,活性磷(DIP)采用磷钼蓝分光光度法测定,总氮(TN)和总磷(TP)采用过硫酸钾氧化法测定.
1.4 浮游植物计数
在分液漏斗中静置24~48 h后,逐步浓缩至20~40 mL,暂储存于50 mL磨口玻璃瓶中,观察时将样品摇匀,取0.1 mL滴于浮游植物计数板上,然后在400倍显微镜下观察鉴定,每瓶样品计数3次,取其平均值,同一样品的计数结果和平均数之差的绝对值不大于其均数的15%,即为有效结果,最后依相应的体积公式计算体积[6, 9].
1.5 数据处理
采用物种优势度Y(McNaughton)[10]判断群落的优势种,采用物种多样性指数H'(Shannon-Wiener index)[11]、均匀度指数J(Pielou index)[12]和物种丰富度指数D(Margalef index)[13]来研究浮游植物群落的结构特征.计算公式分别为
式中,ni为第i种的总个数,N为所有种类的总个数,fi为该种在各样品中出现的频率,Pi为第i种的个体数与样品中总个体数的比值,S为样品中种类总数.
2 结果与分析
2.1 扇贝养殖区海水温度、pH值和盐度的变化
莱州湾8个扇贝养殖区4—11月水温的变化范围为10.69~28.71 ℃,各养殖区的变化趋势完全一致,均随气温的变化而变化,其中4或11月份温度最低,8月份温度最高.pH值的变化范围为7.79~8.23,8月份pH值略为偏低,各养殖区各月份之间差异较小,变化趋势较一致,均符合海水水质一、二类标准[8].盐度的变化范围为29.1~30.27,在一定范围内波动,且波动范围较小.
2.2 扇贝养殖区海水DO和COD的变化
莱州湾8个扇贝养殖区4—11月DO的变化范围为6.16~9.90 mg/L,各养殖区在同一月份的差异较小,但同一养殖区的月际变化幅度较大,表现为随着水温的的升高而降低,但总体均符合海水水质一类标准.COD的变化范围为0.48~2.76 mg/L,10月份含量最高,L2—L5养殖区超出海水水质二类标准,其它月份差异性较小,均符合海水水质二类标准.
2.3 扇贝养殖区海水营养盐的变化
莱州湾8个扇贝养殖区4—11月TN的变化范围为0.495~1.324 mg/L,DIN的变化范围为0.015~0.396 mg/L,其中NO3-N变化范围为0.008~0.363 mg/L,NO2-N的变化范围为0.001~0.052 mg/L,NH4-N的变化范围为0.003~0.047 mg/L.NO3-N是DIN的主要组成形式,两者的变化趋势较一致,5月份含量最高;NO2-N除10月份之外,其他月份各养殖区含量较小,且差异不大;NH4-N的变化无明显规律,各养殖区在各月份的含量在一定范围内波动.TP和DIP的变化范围分别为0.012~0.111 mg/L和0.002~0.034 mg/L,其中DIP相比TP月份波动较明显.氮磷比(N/P)的变化范围1.91~158.15,其中L3—L5养殖区在5月份值最大,其余养殖区在6月份最大,其他月份各养殖区在20上下波动.
2.4 扇贝养殖区浮游植物群落结构变化
2.4.1 浮游植物物种及优势种变化 莱州湾8个扇贝养殖区在4—11月共鉴定出浮游植物5门96种,其中硅藻门最多,有63种,占所有发现物种的65.53%;其次为甲藻门和绿藻门,分别有14和9种,分别占所有发现物种的14.58%和9.38%;金藻门和隐藻门最少,各有5种,均占所有发现物种的5.21%(表1).优势种主要有长菱形藻(Nitzschialongissima)、新月拟菱形藻(Nitzschiaclosterium)、角毛藻(Chaetocerosspp.)、柔弱几内亚藻(Guinardiadelicatula)、小环藻(Cyclotellasp.)、中肋骨条藻(Skeletonemaceaecostatum)、扁藻(Platymonassp.)、单鞭金藻(Chromulinasp.)、等鞭金藻(Isochrysissp.)、隐藻(Cryptomonassp.)、蓝隐藻(Chroomonassp.)和裸甲藻(Gymnodiniumspp.)等,一共有27种优势种,不同月份所形成的优势种虽有所相同,但总体呈现演替状态,有的浮游植物在4或5个月连续形成优势种,有的浮游植物只在单个月份形成优势,具有较强的季节差异性.

表1 莱州湾扇贝养殖区浮游植物种类组成Tab.1 Species composition of phytoplankton in scallop culture area of Laizhou Bay
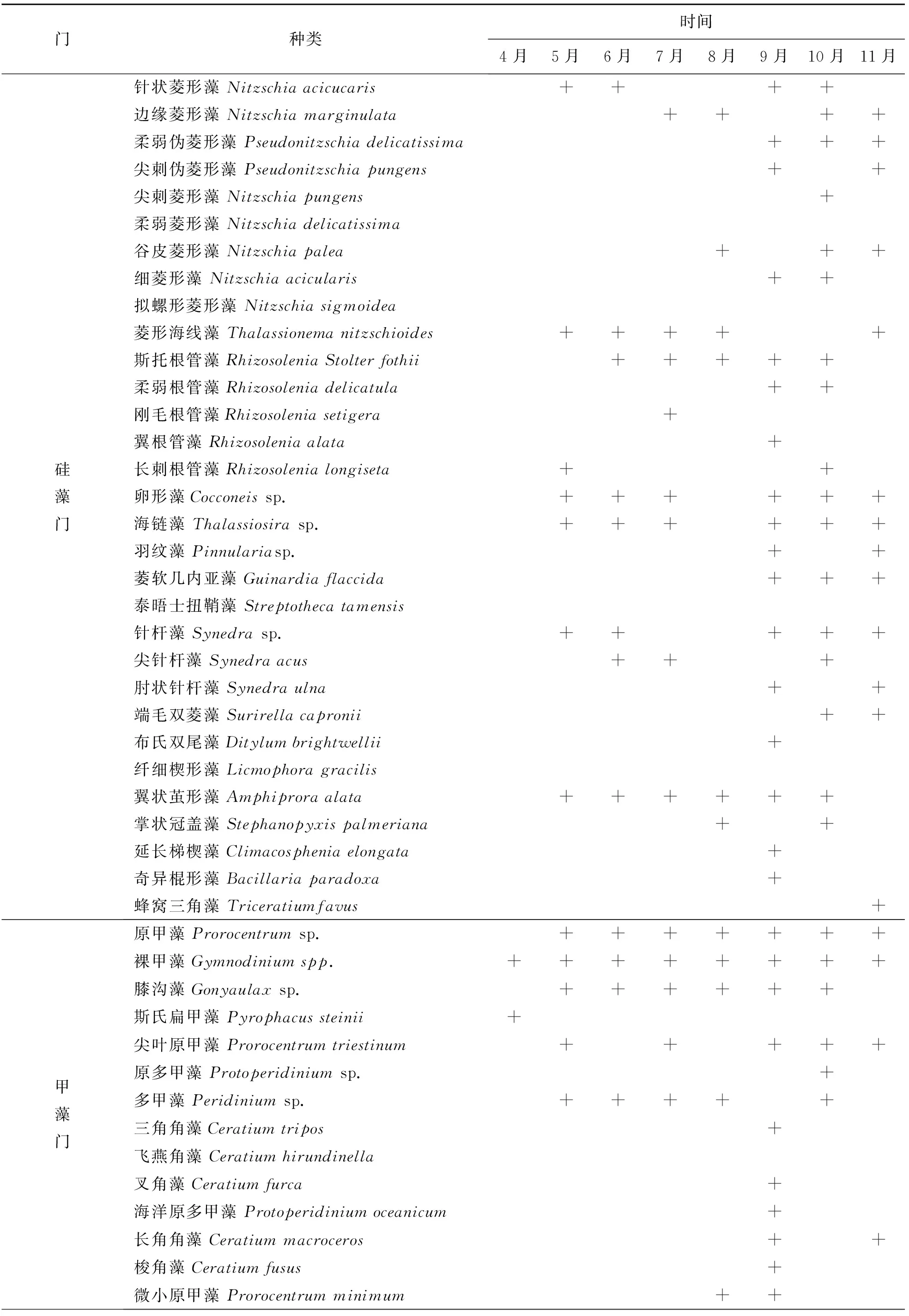
表1(续)
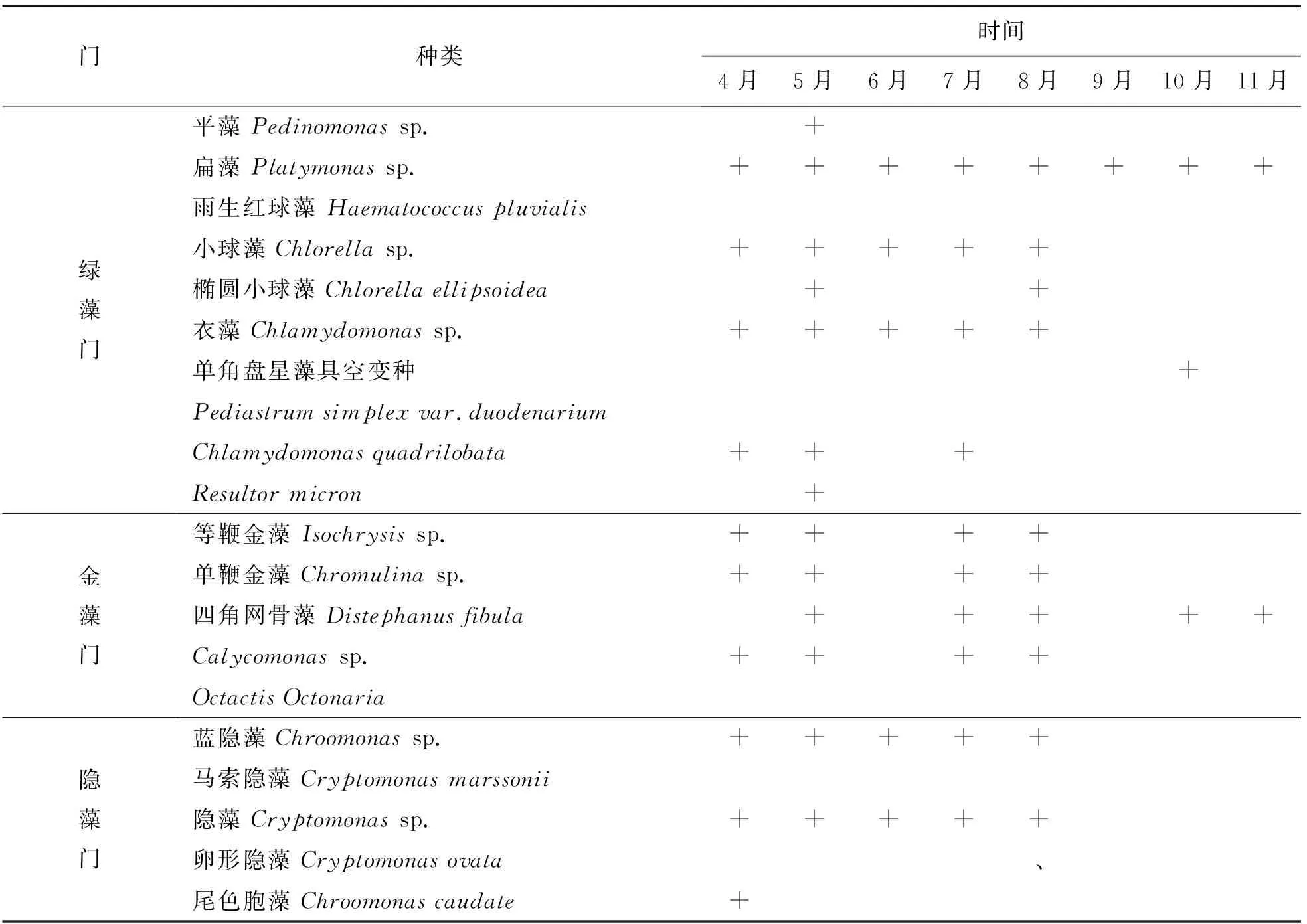
表1(续)
2.4.2 浮游植物密度与物种量变化 莱州湾8个扇贝养殖区4—11月浮游植物密度变化如图2A所示,变化范围为0.49×104~112.04×104cell/L,变化趋势基本一致,均存在明显的季节差异性,其中6月和9月出现峰值,分别为(62.11±49.93)×104cell/L和(19.56±17.24)×104cell/L,其他月份密度相当.8个养殖区中,L1养殖区月际差异最大,6月份其密度出现全年最高值,为112.04×104cell/L,11月份密度最小,仅为0.98×104cell/L,L2养殖区浮游植物密度月际差异最小,且一直处于较低水平,平均密度为5.26×104cell/L.
莱州湾8个扇贝养殖区浮游植物物种量的变化如图2B所示,每个养殖区浮游植物物种变化大致相同,4—9月呈“N”形波动,后2个月明显下降,变化范围为6~39种,不同养殖区同一月份浮游植物物种数较为接近,但同一养殖区不同月份相差较大,呈现出明显的季节差异性,与浮游植物密度变化趋势并不一致.

图2 不同扇贝养殖区浮游植物密度与物种量变化Fig.2 The intermonthly variation in density and species of phytoplankton in different scallop culture areas
2.4.3 浮游植物多样性变化 莱州湾8个扇贝养殖区浮游植物群落多样性指数(H′)、均匀度指数(J)以及丰富度指数(D)变化趋势分别如图3A、3B和3C.由图3可知,每个养殖区浮游植物群落多样性指数 (H′) 和均匀度指数 (J) 的变化趋势较一致,在6月(L1和L2养殖区)或9月(L3和L4养殖区)出现最低值,其他月份指数相当,整体变化范围分别为1.06~3.92和0.26~0.96.物种丰富度指数的变化范围为2.09~4.89, 同一养殖区不同月份以
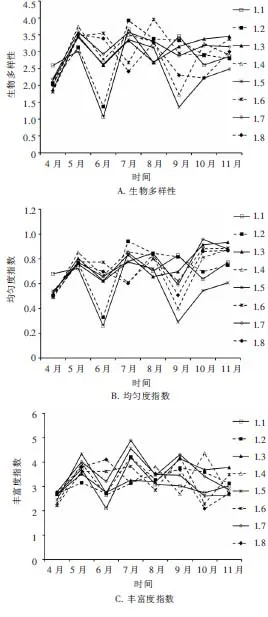
图3 不同扇贝养殖区浮游植物多样性变化Fig.3 The variation of phytoplankton diversity in different-scallop culture areas
及不同养殖区同一月份之间的差异较小,均在一定范围内波动,说明不同月份8个养殖区浮游植物物种数分布较为均匀.
2.5 浮游植物群落结构与环境因子的相关性
莱州湾8个扇贝养殖区浮游植物群密度、物种数与水温、pH值以及营养盐等环境因子的相关性如表2所示.由表2可知水温在春、夏和秋3个季节中对浮游植物密度和物种数的影响最大,DIN和NO3-N在夏、秋季对浮游植物密度和物种数的影响较大,其余环境因子在秋季对浮游植物密度和物种数的影响较大,在春、夏季的影响较小.
3 讨 论
3.1 水温对浮游植物的影响
水温是影响浮游植物群落结构季节变化的重要环境因子,其值的改变对浮游植物物种量及其优势种的演替产生着重要作用[14].本研究海域中硅藻门在浮游植物结构组成上占绝对优势(在种类和数量上均占60%以上),据研究硅藻喜低温,其最佳生长温度很少超过25 ℃[15-16],最适合的温度通常低于18 ℃[17].8个养殖区水温在4—11月的变化范围为10.69~28.71 ℃,其中8月份水温最高,超过25 ℃,较不利于硅藻的生长,这解释了硅藻密度在8月份降低的原因.水温与浮游植物密度和物种数的相关性分析表明,春季水温与浮游植物密度呈正相关,但不显著,与浮游植物物种数呈极显著正相关(P< 0.01);夏季水温与浮游植物密度和物种数均呈极显著负相关(P< 0.01);而冬季水温与浮游植物密度和物种数均呈极显著正相关(P< 0.01);说明在一定的温度范围内,水温的增加有利于浮游植物的生长,但超过这个范围,水温的增加会对浮游植物生长产生抑制作用,这与沈国英[18]、刘杰等[19]的研究结果较一致.
3.2 pH值对浮游植物的影响
水体的pH值是海洋生态环境另一重要的影响因子,其数值的变化幅度过大会对浮游植物产生环境胁迫[20].本研究实验表明.夏季海水的pH值的变化幅度比春、秋季的变化幅度大.相关性分析表明,在春季和秋季,pH值与浮游植物密度和物种数无明显相关性,而在夏季,pH与浮游植物密度和物种数呈显著正相关(P< 0.05),说明夏季海水pH值下降对浮游植物密度和物种数也许有一定的抑制作用.
3.3 盐度对浮游植物的影响
海水盐度是海洋生态的基础环境因子,它的变化对海洋生态与气温变化对陆地生态一样有着深层次的巨大影响[21].盐度可以影响浮游植物的渗透压,对浮游植物的季节性分布有着一定的制约作用[22].相关性分析表明,在春季,盐度与浮游植物物种数呈极显著负相关(P< 0.01),在夏季,盐度与浮游植物物种数呈极显著正相关(P< 0.01),秋季,盐度与浮游植物物种数呈负相关性,但相关性极差.而盐度与浮游植物密度在这3个季节中均无明显相关性,说明盐度的变化对浮游植物物种数的影响较大,而对浮游植物密度几乎无影响.原因可能为该研究海域检出的浮游植物绝大多数为广盐性浮游植物,盐度的微小波动对其生长发育的影响较小,而对一些耐盐能力较差的浮游植物物种有影响.
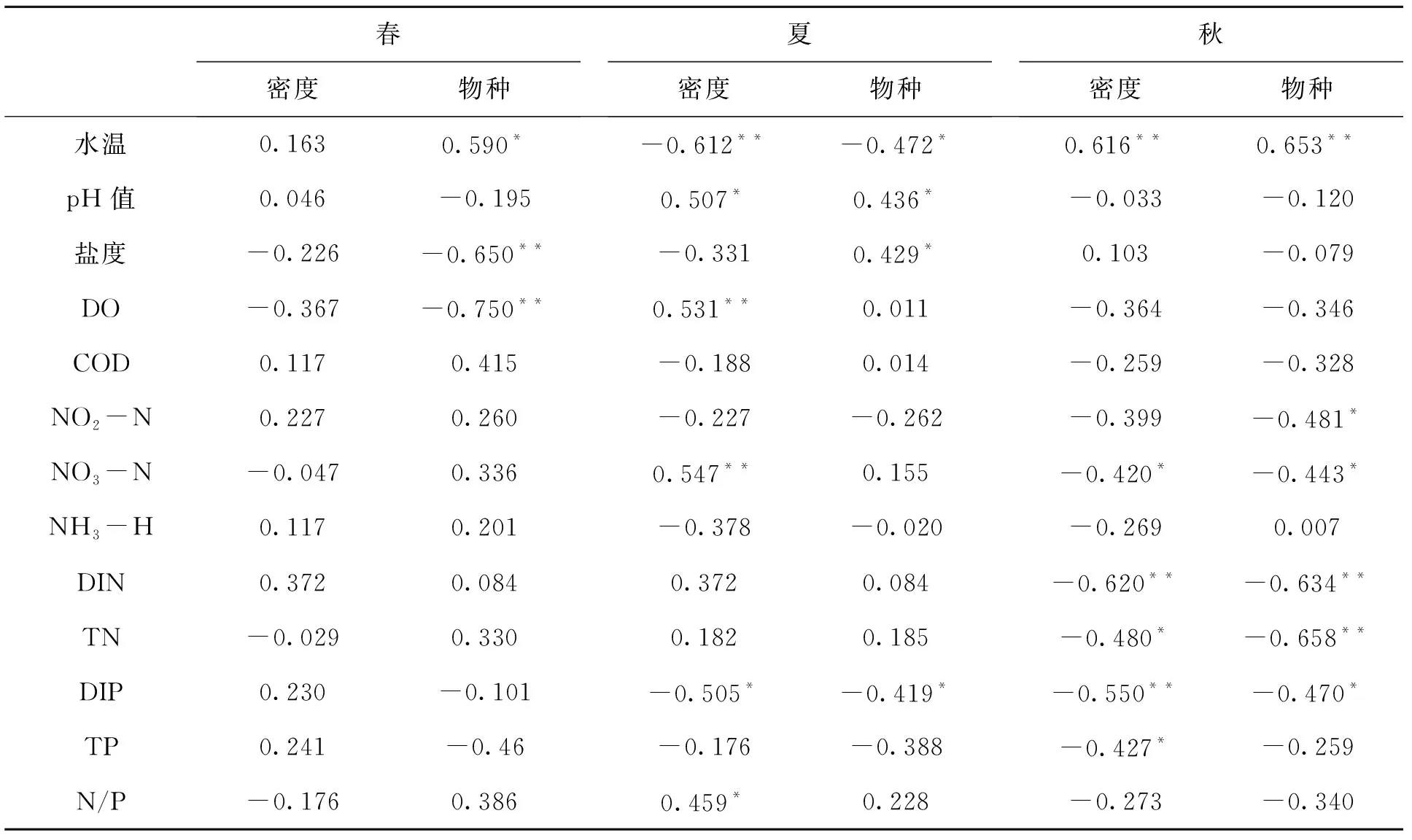
表2 莱州湾扇贝养殖区浮游植物群落结构与环境因子的相关性Tab.2 Pearson correlation between the phytoplankton community and environmental factors in the scallop culture area of Laizhou Bay
3.4 DO对浮游植物的影响
DO是水生生物生理代谢的限制因子之一,其值的高、低可表征水生生物生长状况和水体污染程度[23].在浮游植物丰富的水体中,DO浓度除了受到浮游植物光合作用的影响,还受到水生生物呼吸作用的控制,在两者的相互作用下呈现一定周期性变化,当浮游植物的数量增加到一定的数量级时,DO的浓度主要受控于浮游植物数量的多少及其生命活动的旺盛程度[24].本研究结果表明,在春、秋季,DO与浮游植物物密度和种数呈负相关(P<0.01),但不显著,在夏季,与浮游植物密度呈显著正相关(P< 0.05),与浮游植物物种数几乎无相关性,说明不同季节DO对浮游植物的影响不同,且影响力较小.
3.5 营养盐对浮游植物的影响
氮、磷营养盐是海洋环境中浮游植物自然种群生长的主要限制因子,对浮游植物群落结构发挥着重要的作用.对于氮营养盐,能被浮游植物直接利用的是DIN,其中NH3-N最易被浮游植物利用,但利用程度取决于浮游植物种类[25],同时NH3-N对生物还会产生直接或协同的毒性效应,因此NH3-N的浓度需要在一定的控制范围内;NO3-N也能被浮游植物直接利用,但其利用程度受NH3-N含量的控制,且利用率远小于NH3-N[26];NO2-N几乎不能被浮游植物利用,并且对鱼、虾以及贝类等经济动物有一定的毒害作用,所以要严格控制N02-N的含量,避免不必要的经济损失.对于磷酸盐,能被浮游植物直接利用的是DIP,有机磷几乎不能被利用.王俊[27]指出浮游植物对DIN和DIP需求的最适浓度下限5.71 μmol/L(约0.080 mg/L)和0.58 μmol/L(约0.018 mg/L),JUSTIC等[28]提出当海水中DIN的浓度小于1 μmol/L(约0.014 mg/L)时,浮游植物会受到绝对氮限制,当海水中DIP的浓度小于0.1 μmol/L(约0.003 mg/L)时,浮游植物受到绝对磷限制.本研究实验表明8个养殖区均未受到绝对氮限制,但6—10月个别养殖区DIN未能达到浮游植物的最适浓度需求;对于DIP,6月份L2、L4、L5和L6养殖区出现绝对磷限制,绝大多数养殖区在4—11月未能达到浮游植物的最适浓度需求.
相关分析表明,春季氮、磷营养盐与浮游植物密度和物种数的相关性均不明显,夏季NO3-N与浮游植物密度呈显著正相关(P< 0.05),DIP与浮游植物密度和物种数呈显著负相关,秋季氮、磷营养盐大部分均与浮游植物密度和物种数呈显著负相关或极显著负相关.总体上看,与氮营养盐与浮游植物的相关性相比,磷营养盐(特别是DIP)的相关性更加显著,表明该海域浮游植物生长对于磷营养盐的响应要优于氮营养盐,磷营养盐对于浮游植物生长的控制作用要更明显.

