二化螟APN1的原核表达及其与Cry2Aa蛋白的结合特性研究
刘 慧, 李 博, 牛 林, 邱 林, 王 永*
1湖北工程学院生命科学技术学院/特色果蔬质量安全控制湖北省重点实验,湖北 孝感 432000; 2华中农业 大学植物科学技术学院/昆虫资源利用与害虫可持续治理湖北省重点实验室,湖北 武汉 430070; 3广州 海关隶属南沙海关,广东 广州 511400; 4中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南 安阳 455000; 5湖南农业大学植物保护学院,湖南 长沙 410128
苏云金芽孢杆菌(Bacillusthuringiensis,Bt)属革兰氏阳性菌,在芽孢形成时会产生具有杀虫活性的伴孢晶体蛋白,主要分为Cry蛋白和Cyt蛋白2类(Crickmoreetal.,1998),其中Cry蛋白是最常见的杀虫蛋白。由于Bt杀虫蛋白具有比较好的高效性和专一性,被认为是良好的化学农药替代物,表达Bt蛋白的转基因作物和微生物杀虫剂也被广泛应用于害虫防治(Bravoetal.,2011)。由于20世纪90年代初期棉铃虫Helicoverpaarmigera(Hübner)大暴发,对我国棉花产业造成严重损失,对棉铃虫具有高效杀虫活性的转基因棉花(主要表达Cry1Ac)首先在我国广泛种植。转基因作物的种植面积不断扩大,由1997年的170万hm2增加至2016年的1.85亿hm2,其中抗虫转基因作物高达41% (ISAAA,2016; Wangetal.,2018))。然而,单一、大面积种植转基因作物增加了棉铃虫等靶标害虫的抗性风险,成为Cry蛋白在害虫防治中可持续利用的重大威胁(Hagenbucheretal.,2017; Von Kaneletal.,2016)。因此,明确Bt杀虫蛋白的杀虫机制和靶标害虫的抗性机理,对于可持续利用Bt蛋白防治害虫具有重要意义。
Bt蛋白发挥杀虫活性的重要前提是Cry蛋白能够与昆虫中肠上皮细胞刷状缘膜囊(brush border membrane vesicle,BBMVs)上的受体蛋白结合(Jurat-Fuentes & Crickmore,2017)。目前已报道的Cry杀虫蛋白受体主要包括钙黏蛋白(cadherin,CAD)、氨肽酶(aminopeptidase N,APN)和碱性磷酸酶(alkaline phosphatase,ALP)(Pardo-Lopezetal.,2013; Soberonetal.,2009)。此外,研究发现,V-ATP合成酶亚基A/B、ABC转运蛋白(ABCC2、ABCC3、ABCG1、ABCA2)和钠溶质转运体可与Cry蛋白结合,可能是潜在的Cry受体蛋白(Chenetal.,2010; Contrerasetal.,2013; Qiuetal.,2017b)。其中,APN作为Cry蛋白的受体功能已在烟草天蛾ManducasextaL.、烟芽夜蛾Heliothisvirescens(Fabricius)、小菜蛾PlutellaxylostellaL.等鳞翅目昆虫中得到鉴定(Contrerasetal.,2013; Luoetal.,1997; Wangetal.,2017a)。
当前已报道的Cry基因超过500种,根据其结构特点和杀虫活性大致被分为67类 (Crickmoreetal.,2014)。由于不同类别的Bt杀虫蛋白存在杀虫特异性,不同杀虫蛋白对同一靶标害虫的杀虫效果不尽相同,同一昆虫体内也可能存在不同的受体蛋白(Frankenhuyzen,2009)。二化螟Chilosuppressalis(Walker)是水稻上的重要害虫之一(Duetal.,2013)。由于水稻品种更新、气候变化、水稻耕作技术发展以及二化螟抗药性产生等因素的影响,二化螟在我国的危害程度持续上升(陈波等,2012)。目前,Cry2A类蛋白的受体鉴定和作用机制相关报道较少,因此,本文在前期获得二化螟APN1基因的基础上,分析其与Cry2Aa蛋白的结合能力,为二化螟APN蛋白的受体功能研究奠定基础。
1 材料与方法
1.1 供试昆虫
二化螟为本实验室内以人工饲料(不含Bt蛋白)连续饲养多代的敏感种群,未接触任何杀虫剂。待幼虫生长至4龄,将其放置冰上切取中肠,去除内含物,用预冷的0.7%NaCl溶液冲洗并用吸水纸将其吸干,立即放入液氮中冷冻,收集的中肠样品放入-80 ℃保存备用。
1.2 主要试剂
表达载体pET-28a-(+)、克隆感受态细胞Trans l-T1 Phage Resistant为实验室前期保存。反转录cDNA合成试剂盒和限制性内切酶(EcoRⅠ和NotⅠ)(Fermentas公司),RNA提取试剂和DNA聚合酶(PrimeSTAR®Max DNA Polymerase)(Takara公司),T载体peasy-blunt和感受态细胞Trans BL21(DE3)(全式金公司),质粒提试剂盒和X-gal[天根生化科技(北京)有限公司],DNA T4连接酶(Promega公司)、Cry2Aa活化蛋白(美国一龙公司Envirologix Inc.)。菌体破碎时使用的溶菌酶,PMSF,DNaseI,蛋白纯化时使用的填料(康为世纪生物科技有限公司);PTG,硫酸卡那霉素胰蛋白胨,酵母提取物,氯化钠(武汉鼎国生物技术有限公司)。PCR引物合成和DNA测序由生工生物工程(上海)股份有限公司完成。蛋白纯化所用的inclusion bingding buffer、inclusion elution buffer为自己配制,其余试剂均为国产分析纯。
1.3 二化螟中肠RNA的提取及cDNA模板的合成
取10头二化螟4龄幼虫的中肠,放入无RNAase的1.5 mL离心管中,加入1000 μL的 Trizol reagent充分匀浆,用Takara公司的RNAiso Plus试剂盒进行总RNA的提取,将提取的RNA按照Thermo Scientific cDNA第一链合成试剂盒说明书合成cDNA。
1.4 APN1基因片段的克隆
1.4.1 引物设计 根据GenBank中二化螟APN1(JQ747494.1)的序列,在Cry2Aa蛋白结合区设计引物:APN1正向引物5′-AGGAATTCATGGACGGGATTGCCAAATC-3′,反向引物5′-AGGCGGCCGCTTTCAACATCAAAGCGATCATTGTTG-3′,为了便于将目的基因克隆到表达载体上,在正向、反向引物中分别设计了EcoRⅠ、NotⅠ酶切位点(用下划线表示)。
1.4.2 PCR产物的克隆和鉴定 以合成的cDNA第一链为模板,按照说明书配制Prime STAR Max的PCR体系,1%琼脂糖凝胶电泳检测,回收目的片段。将回收的目的片段连接到克隆载体peasy-blunt中,然后转化大肠杆菌DH5α,蓝白斑挑选,挑取白色单菌落,培养后进行菌液PCR鉴定,将鉴定的阳性克隆进行测序鉴定。
1.5 APN1基因原核表达载体的构建及鉴定
1.5.1 质粒提取 对测序正确的单菌落菌液,1∶100加入10 mL带kana抗性的LB液体培养基过夜培养,采用TIANprep Mini Plasmid Kit进行质粒提取。
1.5.2 重组表达载体的构建 将重组的质粒peasy-blunt/APN1和原核表达载体pET-30a-(+)经EcoRⅠ和NotⅠ双酶切后,分别切胶回收1600、5000 bp左右的片段。在T4连接酶的作用下,将APN1片段与原核表达载体pET-30a-(+)于16 ℃过夜孵育。接着转化大肠杆菌DH5α,过夜培养,然后进行菌液PCR的鉴定及重组质粒的测序鉴定。
1.6 APN1多肽片段诱导表达并纯化
1.6.1 APN1多肽片段诱导表达 提取经鉴定正确的质粒,转化大肠杆菌BL21(DE3)感受态细胞,涂平板,过夜培养。挑取单菌落进行PCR验证,取阳性结果对应的菌液100 μL加入到10 mL Kana+LB液体培养基中,37 ℃、200 r·min-1振荡培养4 h,再转入1 L Kana+LB液体培养基中,D600 nm值达到0.5~0.8时,加IPTG至终浓度为1.0 mmol·L-1, 37 ℃恒温振荡培养6 h,12000g离心1 min,弃上清,所得沉淀为总蛋白,用于SDS-PAGE电泳及纯化。
1.6.2 APN1多肽片段纯化 将IPTG诱导后的蛋白加入LE buffer(100 mmol·L-1NaH2PO4,10 mmol·L-1Tris-HCl,8 mmol·L-1urea,pH8.0)溶解,4 ℃ 18000 r·min-1离心30 min,取上清至His-tag亲和层析柱,wash buffer(100 mmol·L-1NaH2PO4,10 mmol·L-11 Tris-HCl,10 mmol·L-1Imidazole,8 mmol·L-1urea,pH8.0)冲洗柱子。elution buffer(100 mmol·L-1NaH2PO4,10 mmol·L-1Tris-HCl,500 mmol·L-1Imidazole,8 mmol·L-1urea,pH8.0)洗脱目的蛋白。收集的纯化蛋白经SDS-PAGE电泳检测。
1.7 ligand bloting分析
将提取纯化的APN1片段进行SDS-PAGE分析,用Bio-Rad标准半干法转膜装置将蛋白转移至PVDF膜上,用PBST稀释的5%脱脂奶粉封闭2 h,与活化的Cry2Aa杀虫蛋白(0.3 μg·mL-1)孵育2 h;PBST洗膜10 min,重复3次;与Cry2Aa的抗体(1∶3500)孵育2 h;PBST洗膜10 min,重复3次;辣根过氧化物酶标记的二抗(1∶3500)孵育2 h;ECL化学发光显色,记录图片。
2 结果与分析
2.1 APN1在大肠杆菌表达纯化结果
结合GenBank已收录的APN1的全长,经过表达载体构建将目的基因构建到pET-30a-(+)表达载体上,转化BL21(DE3)感受态细胞以后,用终浓度1 mmol·L-1的IPTG诱导蛋白表达并纯化。如图1所示,在体外获得了二化螟APN1蛋白,诱导表达和纯化得到的蛋白大小一致,约70 Ku,与预测的蛋白大小相一致。纯化后的多肽条带单一,纯度较好,可以用于蛋白杂交实验。
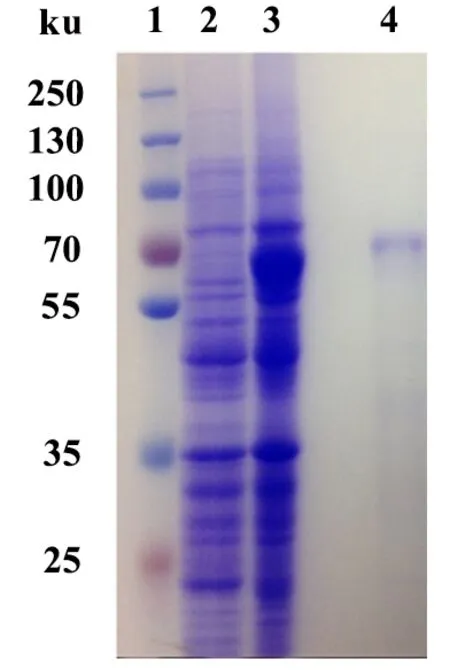
图1 二化螟APN1的原核表达和纯化Fig.1 Prokaryotic expression and purification of C. suppressalis APN11:Marker; 2:未添加IPTG诱导的总蛋白;3:IPTG诱导的总蛋白;4:Ni2+柱纯化的蛋白。1: Marker; 2: No IPTG-induced total protein; 3: IPTG-induced total protein; 4: Purified protein by Ni2+ column.
2.2 Cry2Aa蛋白与APN1多肽片段的结合分析
将纯化后的APN1进行SDS-PAGE电泳后,采用ligand bloting技术,检验APN1片段和Cry2Aa的结合能力,结果如图2所示,表达的二化螟APN1多肽片段可以与活化的Cry2Aa杀虫蛋白结合,且结合条带随着重组蛋白上样量的降低而减弱。
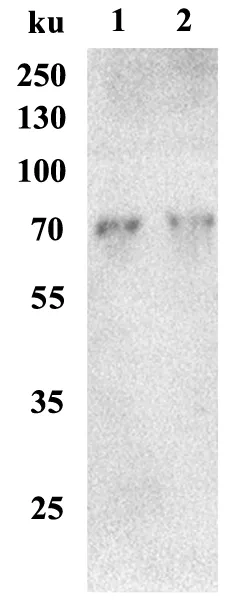
图2 二化螟APN1蛋白与Cry2Aa蛋白的结合Fig.2 The binding of APN1 protein to Cry2Aa protein in C. suppressalis1:10 μL二化螟APN1蛋白;2:5 μL二化螟APN1蛋白。1: 10 μL of C. suppressalis APN1 protein; 2: 5 μL of C. suppressalis APN1 protein.
3 讨论
有关Cry蛋白的作用机制,普遍认为Cry蛋白被靶标昆虫取食后,在昆虫中肠碱性环境条件下溶解,原蛋白在中肠酶的作用下水解为活化的杀虫蛋白,活化的杀虫蛋白与昆虫中肠上皮细胞BBMVs上的特异性受体相结合后,经过复杂的相互作用插入到昆虫细胞膜的脂筏中,导致细胞内外离子通透性和渗透压改变,引起细胞裂解和幼虫死亡(Adangetal.,2014; Bravoetal.,2011; Qiuetal.,2017b)。
Cry蛋白发挥作用的前提是其能够与昆虫体内的特异性蛋白受体相结合,这也是Bt蛋白发挥作用非常关键的一步(Jurat-Fuentes & Crickmore,2017)。目前已报道可以与Cry蛋白结合的蛋白中,其中一些已确认为Cry蛋白的受体蛋白,一部分可能是潜在的受体蛋白。1995年发现昆虫APN为Cry蛋白的结合蛋白,现已在超过20多种鳞翅目昆虫中得到证实(Qiuetal.,2017a)。APN1作为Cry1类蛋白受体已经在粉纹夜蛾Trichoplusisni(Hübner)、烟草天蛾、棉铃虫和二化螟中得到证实(Flores-Escobaretal.,2013; Tiewsiri & Wang,2011; Weietal.,2016; Zhangetal.,2009)。Wangetal. (2017b)发现RNAi敲除APN1基因能降低二化螟对Cry1Ac的敏感性。但由于不同类型的杀虫蛋白可能存在不同的受体蛋白,Cry2A与Cry1A类杀虫蛋白具有不同的作用机制(Weietal.,2015)。
蛋白质结合是Bt蛋白发挥杀虫活性的前提,但结合并不意味着就是蛋白受体。谷实夜蛾中APN1是Cry1Ac的受体蛋白,但不是Cry2Ab的受体(Weietal.,2016)。Cry1Ac和Cry2Aa蛋白能够与南方小花蝽OriussimilisZheng成虫体内的热激蛋白70相结合,但实验确认为非特异性结合(Wangetal.,2018)。肌动蛋白actin作为Cry1Ac蛋白的结合蛋白在烟草天蛾和棉铃虫蛋白质组中得到鉴定,在埃及伊蚊Aedesaegypti(L.)中也可作为Cry4Ba的结合蛋白(Bayyareddyetal.,2009)。肌动蛋白与Cry蛋白的结合有可能破坏细胞骨架的正常功能(Chenetal.,2010; McNall & Adang,2003),但肌动蛋白是否为Cry的受体蛋白至今还未明确。Qiuetal. (2017a)利用RNAi敲除2个氨基肽酶N基因(APN1和APN2)导致二化螟对Bt水稻品系TT51(Cry1Ab和Cry1Ac融合基因)和T1C-19(Cry1Ca基因)的敏感性降低,但对T2A-1品系(Cry2Aa基因)的敏感性无显著变化。本研究发现,Cry2Aa杀虫蛋白可以与原核表达的二化螟中肠APN1多肽片段结合,其与Cry2Aa之间的互作关系仍需进一步研究。

