人外周血淋巴细胞染色体制备中的影响因素分析
杨梦迪 王如刚
人外周血淋巴细胞染色体畸变检测是放射工作人员职业健康体检的重要检查项目,不仅能早期发现辐射效应,而且还能对受照个体进行生物剂量估算[1]。染色体畸变分析被誉为电离辐射致人体损伤程度判断的“金牌指标”[2],能否成功制备出供核型分析的染色体片是关键,但每个实验室条件和实验员操作手法不尽相同,因此总结出一套适合本单位实验室条件的制备方法尤为重要。由于该技术要求细胞培养时间较长,因而易受培养时间、植物凝血素(phytohemagglutinin,PHA)浓度、秋水仙素(colchicne)浓度、滴片等影响而导致实验失败。现对1 089 例人外周血染色体制备后的 4 356张染色体的标本进行观察记录并总结分析,结果报道如下。
1 材料与方法
1.1对象 2016年2月-2017年7月参加职业健康体检的放射作业人员1 089例。其中男性621名,女性468名,年龄21~65岁。
1.2仪器与试剂 隔水式电热恒温培养箱、超净工作台、离心机、显微镜。RPMI1640培养液(含20%小牛血清及PHA,青岛莱佛生物工程研究所制备,产品备案号:鲁青械备20160093)、肝素抗凝管、0.075 mol/L氯化钾(KCL)、10 μg/mL秋水仙素(终浓度0.04 μg/mL,青岛莱佛生物工程研究所制备)、甲醇、冰醋酸、吉姆萨(Giemsa)染色液。
1.3外周血淋巴细胞染色体标本制备质量控制 根据王喜爱等[3]的研究结论,将制作效果分为 6 级:A级,淋巴细胞数量多,分布均匀、密度适中; 染色清晰、胞浆完整、体浆分明、透明度好; 能有效提高染色体畸变的检出率和阅片效率。B级,淋巴细胞数量少,分布不均、密度稀疏; 其他与 A 级相同。C级,淋巴细胞数量多,分布均匀、密度适中; 染色清晰、胞浆较厚、染色体粘连在一块、透明度模糊; 较能有效提高染色体畸变的检出率和阅片效率。D 级淋巴细胞数量特多,分布成团状、密度过密; 染色清晰、染色体粘连在一块、胞浆较厚、透明度模糊; 不能有效提高染色体畸变的检出率和阅片效率。E 级淋巴细胞数量少,分布成不均、密度稀疏; 染色清晰、体浆分离, 染色体单个分散、透明度模糊; 不能有效提高染色体畸变的检出率和阅片效率。F 级淋巴细胞数量特多,分布成团状、密度过密; 染色清晰、染色体粘连在一块。
1.4方法 按照常规人外周血全血培养与染色体制备技术的基本操作要点,采用微量全血培养法制片[4],每人接种2瓶,每例滴片2张(滴片:根据细胞浓度加入适量的固定液,混匀,滴在湿冷的载玻片上3-4滴,气干法制片),Giemsa染色,显微镜高倍镜(10×40倍)、油镜(10×100倍)镜检100个染色体数目为46±1,染色体分散良好,长短适中,形态清晰的中期细胞[5],计数染色体畸变细胞数,计算畸变率,结果经2人复核后确认。
1.5外周血淋巴细胞染色体标本制备 在无菌条件下,将800 μL肝素抗凝全血接种于1 640培养液中,充分混匀后置37 ℃培养箱放置48~56 h。收获前5 h加入秋水仙素,终浓度0.04 μg/mL。常规收获,制片,吉姆萨染色(表1)。

表1 人外周血淋巴细胞染色体操作要点
2 结果
2.1成功率 1 089例放射工作人员外周血淋巴细胞染色体标本中,1次检测成功1 077例,另有12例检测未能完成,经采取补救措施检测成功,成功率100%。常规人外周血全血培养与染色体制备技术能够保证绝大部分实验结果和对失败的原因分析和处理方式正确。
2.2影响标本质量的原因及其应对措施 镜下核型分析结果显示,12例检测失败的样本中主要表现为分裂相少、染色体分散及形态差等,其影响因素主要为培养时间、低渗、秋水仙素作用时间等(表 2)。

表2 影响标本质量的原因及应对措施
2.3质量较差的样本镜下核型分析结果 由于培养时间短或受检者年龄偏大导致分裂相少;秋水仙素作用时间长导致染色体形态短粗;低渗液打散不充分导致细胞带胞浆,染色体分散差;以及菌落数增多(图1,2)。
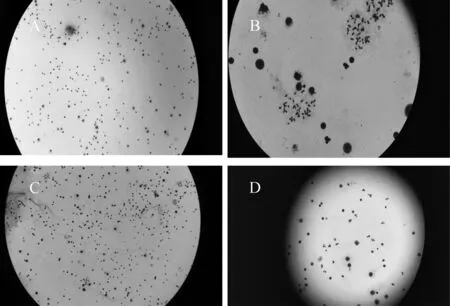
注:A为分裂相较少;B为染色体形态较为粗短;C为细胞带胞浆,染色体分散差;D为细菌的菌落数较多。图1 质量较差的核型分析结果
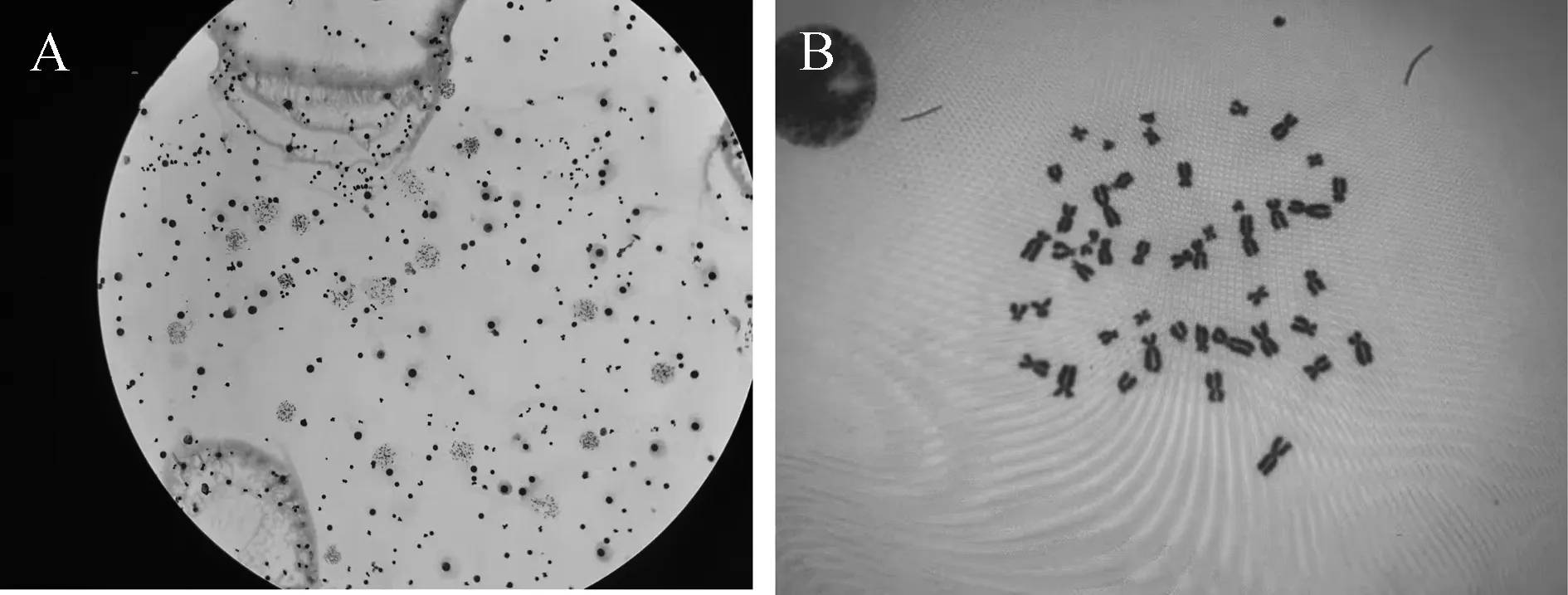
注:A为显微镜高倍镜(10×40倍);B为油镜(10×100倍)。图2 正常核型分析结果
3 讨论
3.1细胞增殖周期随年龄增长而延长[6],淋巴细胞对PHA刺激的反应性减弱,细胞培养的时间需要适当延长。由于中老年人的淋巴细胞分裂周期比青年后延,导致分裂相不多,因此,年龄每增加10岁,培养时间可以从48 h再延长1 h收获[2]。如用真空采血管采血,必须选用肝素抗凝管,其他抗凝剂会导致细胞死亡。
3.2PHA是常用的从菜豆中提取的淋巴细胞有丝分裂原,其中所含粘多糖有刺激淋巴细胞分裂的作用,能促使处于间期(G0)的淋巴细胞转化为原淋巴细胞,重新进入增殖周期进行有丝分裂;在PHA的作用下,大多数淋巴细胞处于生长活跃期,在培养终止前数小时,加入适量秋水仙素,可使细胞分裂停止在最适于观察染色体形态的分裂中期。细胞只有在PHA的作用下才能进入有丝分裂,只要充分混匀,使淋巴细胞都能充分接触到PHA,细胞即可正常分裂。
3.3低渗过程也是染色体制备中的重要环节,加入低渗液后,应立即吹打,冲散细胞团块,用力轻柔,避免细胞破碎。低渗时间一般控制在15~20 min,当低渗处理时间过长时,可引起细胞膜破碎,导致染色体丢失;低渗处理时间不足时,细胞膨胀不够,则染色体分散不佳,呈团状,难以进行染色体计数分析[7]。经过低渗处理的细胞因已膨胀,容易过早破裂,造成分裂细胞丢失,所以低渗后操作应注意力度一定要轻。低渗处理适当,所得染色体轮廓清晰,利于染色。
3.4收获细胞前所有步骤都要保证无菌操作,防止细菌和病毒的污染。体外培养的细胞由于缺乏机体的免疫等机制从而失去对微生物的防御能力,若发生细菌等微生物的污染,将会导致细胞死亡,因此接种时一定要在生物安全柜中操作,使用无菌注射器接种时,要用酒精消毒培养瓶的瓶塞。
3.5秋水仙素一方面能阻止微管 (纺锤丝) 形成,或使已形成的微管解聚;另一方面,秋水仙素的作用又能促使DNA的复制和有关蛋白质合成[8],可使细胞分裂停止在最适于观察染色体形态的分裂中期,还可使染色体缩短变粗,便于观察。秋水仙素的浓度越高,作用时间越长,染色体形态越短粗,因此,在血细胞培养时,加入秋水仙素的剂量及处理时间与中期分裂相的多少和染色体长短有密切的关系。为了获得适宜的染色体形态,需要严格控制秋水仙素的浓度和作用时间[9]。
3.6滴片的距离、滴加量多少、制片的方式都会影响染色体分期效果[10]。选用病理级玻片,冰冻4 h以上,即为冰片,如果冷冻不够,细胞难以贴附在玻片上,会影响染色体分散效果。滴片时,先用吸管吸取少量细胞悬液以20~30 cm高的距离滴在玻片上,每片3~4滴,然后在酒精灯外焰过火,最后在空气中继续晾干[11]。滴片后加热温度不足,细胞带包浆,染色体分散差;滴片后加热时间太长、温度太高,可导致染色体形态发毛,不清晰,分裂相不完整,染色体散在。
辐射诱发染色体畸变,即对辐射的高度敏感性和诱发染色体非稳定性畸变的特异性和畸变在体内保存时间的相对持续性,以及染色体畸变与某些肿瘤和遗传性疾病的相关性,将染色体畸变作为评估受小剂量照射人群辐射损伤的首选指标[12]。在外周血淋巴细胞染色体制备过程中,影响标本制备的因素有很多,实验人员需具备丰富的操作经验,不能轻视每一个步骤,才能保证染色体标本制备的成功率。

