腹膜透析相关性腹膜炎的细菌谱及耐药性分析
杨 丽 龚妮容 刘宏发 蒋建平
腹膜透析(PD)是治疗终末期肾病的常用方法,具有较好地保护残肾功能、操作方便、居家治疗等优势[1]。腹膜透析相关性腹膜炎(peritoneal dialysis associated peritonitis,PDAP)是导致PD失败最主要的原因,也是患者死亡的主要原因之一。由于抗生素的广泛使用,PDAP的致病菌谱及耐药性也不断发生变化,复发性腹膜炎、难治性腹膜炎呈上升趋势[2]。国际腹膜透析学会(International Society for Peritoneal Dialysis,ISPD)发布的2016版腹膜炎指南推荐,标准的PD中心应定期监测PDAP的致病菌及耐药情况,根据药物敏感性使用抗生素[3]。本文回顾了南方医科大学南方医院肾内科2015年1月至2017年12月期间共1 432例的PD患者,总结其中203例次PDAP患者的临床资料,分析病原菌和耐药情况,了解引发PDAP的致病菌种属分布和耐药状况,为指导临床合理用药,提高PDAP的治愈率提供依据。
对象和方法
病例选择收集南方医院肾内科2015年1月至2017年12月期间的持续不卧床腹膜透析(CAPD)中发生PDAP的患者。纳入标准(参照2016ISPD指南关于PDAP的诊断标准):(1)透出液混浊和(或)腹痛和(或)发热;(2)透出液白细胞计数≥100×106/L,其中多核细胞≥ 50%;(3)透出液培养阳性;三项中满足两项即可诊断为PDAP。治愈标准:经治疗后症状完全缓解,无需拔除Tenckhoff导管,无需抗生素治疗,30d内无复发。退出标准:患者因腹膜炎所致Tenckhoff导管拔除、转血液透析或死亡。所有患者均知情同意。
病原菌株分离鉴定及药敏试验留取PDAP患者透出液进行常规检查;并在无菌操作下将其接种于血培养需氧瓶和厌氧瓶中,均置于法国生物梅里埃公司Bact/ALERTT 3D 240型全自动细菌培养仪进行细菌培养。若培养皿内有菌生长,则按照规范对细菌进行分离鉴别,细菌和真菌鉴定采用法国生物梅里埃公司的ATB Express半自动细菌鉴定仪测定。对分离鉴别出的致病菌分别进行药敏试验。药敏试验采用纸片扩散法(K-B法)测定,药敏纸片由英国Oxoid公司提供。药敏试验结果按美国临床实验室标准化研究所(Clinical and Laboratory Standards institute,CLSI) 2013年标准判读。
治疗方法和治愈标准依据ISPD制订的指南,经验用药使用第1代头孢(头孢唑啉等)治疗革兰阳性菌感染,和第3代头孢(头孢曲松等)治疗革兰阴性菌感染。间断腹腔内加药(药物推荐剂量每天夜间留腹1次),待培养和药敏的结果后,再调整抗生素,治疗总疗程2~3周。治愈标准:非真菌感染患者治疗后症状、体征完全缓解,无需抗生素治疗,无需拔除透析管,腹水白细胞<100/mm3,透析液变清,多核白细胞<50%,连续3次病原学检查结果均为阴性,30d内无复发为治愈;确诊为真菌性腹膜炎者,要马上拔管,给予抗真菌药物治疗10d。退出标准:治疗后症状及透析液无好转,导致透析管拔除,转血液透析或死亡。
统计学方法所有数据采用统计软件SPSS 20.0进行分析处理,数据表示使用均数±标准差,组间比较采用卡方检验,P<0.05为差异有统计学意义。
结 果
一般资料共1 432例CAPD患者,其中171例患者发生了203例次PDAP,分别为2015年69例次、2016年74例次、2017年60例次。其中男80例,女91例;年龄13~84岁,平均年龄(46.27±15.51)岁,平均透析龄(22.59±22.02)个月。原发疾病:慢性肾小球肾炎67例,高血压肾病50例,糖尿病肾病21例,梗阻性肾病5例,结缔组织病11例,原发病不详17例。
PDAP病原菌分布203例次感染的腹膜透出液病原菌培养阳性159例次,阳性率78.33%,培养阴性44例次。共检出47株致病菌株,革兰阳性致病菌有金黄色葡萄球菌、表皮葡萄球菌、肺炎链球菌、考克氏球菌等共19株,占40.43%;革兰阴性菌有大肠埃希菌、铜绿假单胞菌、肺炎克雷伯杆菌、产气肠杆菌等共15株,占31.91%;真菌(白色念珠菌和假丝酵母菌)4株,占8.51%;其他致病菌9株,占19.15%。
透出液培养阳性患者中,革兰阳性菌感染患者83例次(52.20%),其中表皮葡萄球菌3年合计检出30例次(18.88%),其次是金黄色葡萄球菌合计21例次(13.21%);革兰氏阴性菌67例次(42.14%),其中大肠埃希菌3年合计检出27例次(16.98%)为最高,其次为肺炎克雷伯菌合计17例次(占10.69%);多重感染患者4例次(占2.52%),均为1次透出液同时培养出2种以上致病菌;真菌感染5例次(占3.14%),包括白色念珠菌3例次,假丝酵母菌2例次。具体培养结果见表1。

表1 PDAP患者透出液培养的主要致病菌分布[例次(%)]
PDAP:腹膜透析相关性腹膜炎
PDAP致病菌耐药及敏感性分析83例次革兰阳性菌感染的患者,对抗生素青霉素、克林霉素、头孢唑林的耐药率分别为75.00%、71.43%、67.65%,对万古霉素、利福平、左氧氟沙星敏感率分别为94.87%、88.89%、76.47%(图1);67例次革兰阴性菌感染患者,对头孢曲松、哌拉西林、头孢噻肟的耐药率分别为60.00%、57.89%、50.00%,对亚胺培南、阿米卡星、头孢他啶的敏感率分别为96.15%、93.33%、92.00%(图2)。另外5例次真菌感染患者拔管后均治愈,对伊曲康唑、伏立康唑全敏感,2例次对氟康唑、氟胞嘧啶和两性霉素B耐药。
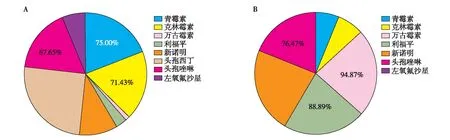
图1 革兰阳性菌对抗生素的耐药率(A)和敏感率(B)

图2 革兰阴性菌对抗生素的耐药率(A)和敏感率分析(B)
PDAP患者的预后203例次患者经治疗后162例次治愈(79.80%),37例次(18.22%)拔管转血液透析,4例次(1.97%)死亡。其中83例次革兰阳性菌感染的患者中,治愈76例次(91.57%),拔管6例次,死亡1例次,退出率8.43%(7/83),67例次革兰阴性菌感染患者,治愈49例次(73.14%),拔管15例次,死亡3例次,退出率26.87%(18/67);革兰阳性菌感染的患者治愈率高于革兰阴性菌感染者,退出率也低于革兰阴性菌患者(P<0.05)。多重感染的患者退出率高达75%,显著高于革兰氏阳性菌感染者(P<0.05)(表2)。

表2 各种致病菌致PDAP的转归
PDAP:腹膜透析相关性腹膜炎;a:与革兰氏阳性菌感染退出率相比,P<0.05
讨 论
PD是慢性肾衰竭患者常采取的治疗方法之一,可部分替代肾脏解毒功能,延长患者生存期[4]。PDAP是患者在PD过程中因接触感染、消化道炎症、导管相关性感染和医源性操作等原因,导致相关致病菌侵入腹腔而引起的急性感染性腹膜炎症。尽管近年来PD技术及相关设备得到了突飞猛进的发展,但是PDAP依然是PD最为严重的并发症之一,我中心3年的感染发生率0.12~0.16例次/患者·年,与国内报道的比例相近[5]。PDAP的发生可导致患者退出透析及增加住院率,直接影响透析治疗的效果,甚至引起患者死亡[6]。
本中心研究显示,PDAP患者透出液细菌培养阳性率为78.33%,略低于ISPD指南的培养阳性率(80%)[3],与国内一些大型PD中心的培养阳性率相近[7],可能标本留取方法、时间、培养技术方面存在差异造成。
由于地域、人群、生活习惯等不同,病原菌的分布也不尽相同。有研究表明革兰阳性球菌是PDAP的主要致病菌[8],我中心159例次培养阳性患者中,致病菌47株,革兰阳性菌中表皮葡萄球菌最多(检出率23.26%),其次是金黄色葡萄球菌(13.21%),与国内外报道的PDAP病原菌分布基本一致[9]。这两种细菌感染多为皮肤接触污染、手消毒不规范或无菌操作不严格造成,在临床过程中需加强对患者的宣教。治疗仍首选万古霉素、利福平、左氧氟沙星等敏感药物。另外我中心检出的革兰阴性菌中,以大肠埃希菌为主(16.98%),其次为肺炎克雷伯菌(10.69%)和产气肠杆菌(8.81%)。革兰阴性菌引起的PDAP患者主要考虑为肠道感染所致,因此,临床应重视有腹泻症状的患者,及时治疗,避免继发PDAP。本研究中,PD患者发生真菌性腹膜炎较少(5例次),检出率仅3.14%,主要是由于患者来我院前已使用广谱抗生素药物。真菌性PDAP往往症状重、预后差,有临床研究报道,使用抗生素治疗的同时,给予抗真菌药物治疗能够有效降低PDAP发生,一旦确诊为真菌感染的腹膜炎,根据2016年ISPD指南建议,应立即拔管[10]。
另外本研究中多重致病菌感染4例次,退出率高达75%,提示多重细菌感染患者预后差,因此选择恰当的治疗方案,避免盲目滥用抗生素,同时规范化培训患者,对减少多重感染的发生率显得尤为重要。本研究的药敏结果显示,革兰阳性球菌对万古霉素的耐药率为5.13%,革兰氏阴性致病菌对亚胺培南的耐药率为3.85%,说明万古霉素和亚胺培南仍可作为一线有效的抗菌药物。
综上所述,PD患者发生感染性腹膜炎的病原菌,因不同透析中心呈现出不同的分布谱,通过定期对PDAP病例进行致病菌谱及耐药性进行分析,可提高临床医师对该类并发症预防和治疗时用药的准确性,有效提高治疗的针对性。

