超声下经皮血管成形术治疗人工血管内瘘狭窄的疗效
杨世峰 李大庆 解立怡 刘 超 路万虹
维持性血液透析患者常用的血管通路有自体动静脉内瘘(arteriovenous fistula,AVF)、人工血管内瘘(arteriovenous graft,AVG)和中心静脉导管。K-DOQI指南建议AVF仍是最佳的血管通路[1]。然而建立AVF需要患者有较好的自体血管。近年来随着高龄和合并高血压、糖尿病透析患者的增加,越来越多的患者因自体血管条件差无法建立AVF,而常常需要建立AVG作为透析通路。
AVG最常见的并发症是狭窄,早期狭窄引起血流量降低或者静脉压升高,晚期发展至严重狭窄引起AVG血栓形成,是导致AVG失功的主要原因[2]。经皮血管成形术(percutaneous transluminal angioplasty,PTA)是一种重要的血管腔内治疗方法,其创伤小、恢复快、可反复进行,并且能最大限度地保留血管资源[3]。近几年超声监视下的PTA技术被应用于AVG狭窄的治疗。超声监视具有操作简单、无辐射伤害、无造影剂损害和设备场所要求低等优点[4]。现将我科室应用超声监视下PTA术治疗AVG狭窄的应用体会及治疗效果报道如下。
对象和方法
患者资料对2016年2月至2018年2月在西安交通大学第一附属医院肾内科接受PTA术的112例AVG狭窄患者进行回顾性分析,收集其年龄、原发病、透析龄、AVG部位和检验指标等数据。
手术指征超声下测量AVG局部狭窄的程度(图1)。对于AVG血栓形成的患者行取栓术后再评估狭窄程度。对于存在上肢肿胀或胸壁静脉曲张的患者行造影排除中心静脉狭窄。PTA治疗的指征为:(1)超声显示管腔狭窄超过正常管径的50%,伴有泵控血流量不达标或静脉压升高等临床症状。(2)超声下显示AVG血栓形成伴管腔狭窄。

图1 超声下人工血管内瘘狭窄图像A:静脉吻合口狭窄;B:动脉吻合口狭窄;C:人工血管狭窄
手术方法(1)在人工血管直行段上穿刺,朝着狭窄处进针,局麻后置入5F-6F血管鞘。(2)通过血管鞘置入0.035导丝(Terumo,Japan),导丝通过狭窄后跟随置入GladiaterTM高压球囊导管(Boston Scientific,American)。球囊直径根据病变部位选择,吻合口或人工血管狭窄选用6 mm,回流静脉狭窄选用6 mm或7 mm。(3)在超声监视下将球囊定位于病变部位,加压使球囊完全张开,记录压力,维持1 min后撤除压力,如此再重复扩张一次,测量病变部位内径并计算残余狭窄率。(4)治疗结束后用3-0丝线荷包缝合穿刺点。术中通过血管鞘推注肝素2 000U。(5)如果AVG血栓形成则先清除血栓,然后再对狭窄病变进行PTA。清除血栓的方法为:在靠近两个吻合口的人工血管上对向穿刺,置入两个7F血管鞘,用两个注射器分别接血管鞘,向AVG内推注肝素盐水将血栓抽吸出来。如果血栓块较大不容易从血管鞘吸出,则向AVG内注入尿激酶溶栓后再抽吸,或者用高压球囊将血栓压碎后再抽吸。
随访所有患者术后每个月随访,内容包括:(1)临床表现:有无血流量不足、静脉压升高、止血时间延长等症状。(2)AVG各个部位的震颤和杂音是否减弱。对可疑有狭窄的患者用超声评估狭窄程度。
统计学方法用SPSS 18.0统计软件处理数据,计量资料用均数±标准差表示,两组间计量资料比较用t检验。计数资料的比较用卡方检验或Fisher精确法。术后初级通畅率定义为PTA后至再次腔内治疗(病变部位再狭窄>50%)或者血栓形成之间的间隔。通畅率采用生存曲线分析。P<0.05为差异有统计学意义。
结 果
一般资料112例患者(男性59例,女性53例)平均年龄57.6±10.5岁,收缩压131±15.8 mmHg,舒张压77±10.5 mmHg,血红蛋白浓度103±10.6 g/L。原发病统计如下:糖尿病肾病59例,慢性肾小球肾炎22例,高血压肾损害20例,其他疾病11例。患者的透析龄为24.8±10.1个月,AVG建立的时间为15.3±6.25个月。AVG的部位如下:肱动脉-贵要静脉前臂U形袢35例,肱动脉-头静脉前臂U形袢29例,肱动脉-肘正中静脉前臂U形袢33例,肱动脉-肱静脉前臂U形袢6例,肱动脉-腋静脉上臂C形袢9例。
狭窄部位112例患者共有144处狭窄病变,狭窄部位及所占比例见表1。人工血管狭窄多发生在反复穿刺部位;引流静脉狭窄多发生在上臂头静脉和上臂贵要静脉,尤其是贵要静脉汇入腋静脉处。112例患者中82例(73.2%)为单一狭窄病变;30例(26.8%)为两处及两处以上狭窄病变(多为吻合口狭窄合并人工血管或引流静脉狭窄)。

表1 人工血管内瘘狭窄部位和经皮血管成形术所需扩张压力
*:与静脉吻合口组比较,P<0.01
狭窄程度112例患者中77例(68.8%)为狭窄合并血栓形成,35例(31.3%)为单纯狭窄(见表2)。合并血栓患者的狭窄程度(75%~95%,平均87.1%±6.2%)明显高于单纯狭窄患者(60%~85%,平均71.0%±7.4%,P<0.01)(如果有两处以上狭窄则取最窄部位的数值)。分别统计两组患者的狭窄部位,经检验两组患者在狭窄部位的构成上无显著性差异。合并血栓的患者中有23例(29.9%)近期有血压降低病史(收缩压<100 mmHg或较平日血压降低20 mmHg以上),并且其收缩压低于单纯狭窄患者(P<0.05),但两组患者舒张压差异无统计学意义。合并血栓患者的血红蛋白水平高于单纯狭窄患者(P<0.05)。

表2 合并血栓和单纯狭窄患者比较
手术成功率手术成功率96.5%。5例失败,均为静脉吻合口狭窄合并血栓形成患者,由于导丝无法通过狭窄部位导致手术失败。导丝通过狭窄后扩张效果满意,球囊扩张技术成功率100%,术后残余狭窄均小于30%,无血管破裂和出血等并发症。手术成功者术后均能使用AVG顺利透析,流量充足且静脉压正常。
扩张压力所有狭窄病变在球囊达到爆破压(24 atm)之前均能被开,70%以上的狭窄需要用14 atm以上的压力,13.8%的狭窄需要18 atm以上的压力。各狭窄部位所需扩张压力见表1。人工血管狭窄所需扩张压力高于静脉吻合口(P<0.01),而静脉吻合口狭窄所需扩张压力高于动脉吻合口和引流静脉(P<0.01)。
随访结果术后有8例患者死于其他并发症(死亡时AVG均通畅),15例患者失访。随访时间3~18个月,平均12.4±4.1月。术后6个月和12个月AVG的初级通畅率为分别为68.8%±5.0%和25.3%±4.2%。术后再次发生狭窄的患者中去除失访、死亡、人工血管重建、改其他血管通路和改腹膜透析者,有45例患者再次接受PTA术,其中44例手术成功,术后AVG恢复通畅并正常使用,1例因导丝无法通过手术失败。将再次接受PTA术的患者纳入生存率分析,术后6个月和12个月的次级通畅率分别为98.6%±1.7%和80.2%±6.3%(图2)。
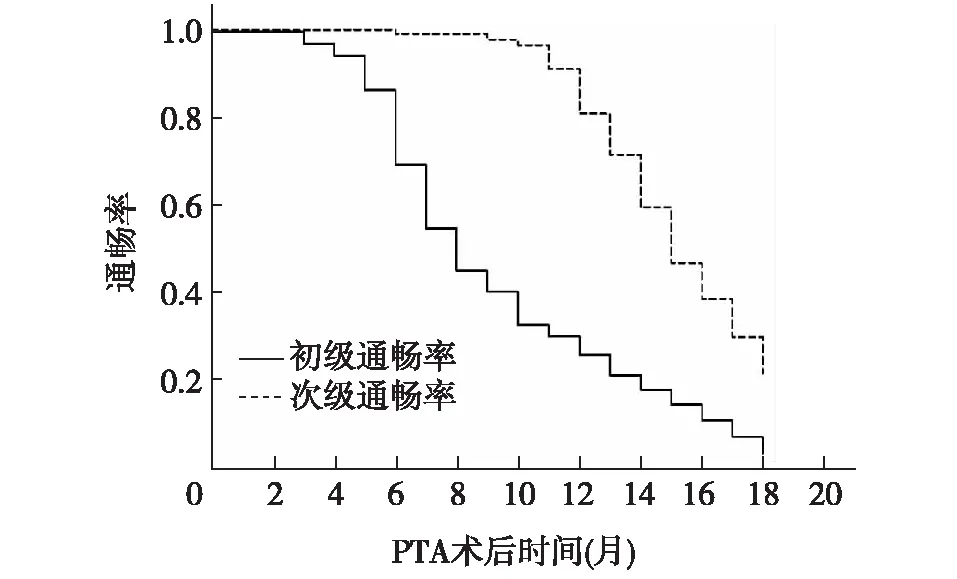
图2 经皮血管成形术(PTA)术后通畅率
讨 论
AVG吻合口狭窄最典型的组织学表现是血管内膜增生[5],表现为血管平滑肌细胞增生和细胞外基质增加,引起血管内膜进行性增厚导致血管狭窄。血管内膜增生是血管损伤后的一种病理性修复,血管损伤引起局部炎症细胞浸润和细胞因子过度表达,进而刺激血管内膜过度增生[6]。而血管损伤的原因主要有手术创伤、尿毒症毒素、缺血缺氧状态、炎症反应和血流剪切力等[7]。其中局部血流剪切力起了主要作用,因此狭窄常常发生在AVG容易形成湍流的部位。本研究结果中静脉吻合口狭窄所占比例最高,静脉吻合口是人工血管和静脉的连接处,是湍流最明显的部位,因此是血管内膜增生最早和最活跃的部位。本研究显示动脉吻合口狭窄占13.2%,远远低于静脉吻合口狭窄比例。分析其原因动脉吻合口虽然也是湍流明显的部位,但是由于动脉吻合口血流是由自体血管流入人工血管,血流剪切力主要作用在人工血管壁上,人工血管没有内膜因此无法增生。人工血管狭窄的机制与吻合口狭窄不同,主要是由于纤维素和脂质在人工血管壁沉积的结果[8]。本研究中人工血管狭窄部位多发生在反复穿刺处,推测其原因还与反复穿刺导致人工血管破损,纤维组织通过穿刺针眼长入腔内有关。引流静脉狭窄的部位变化较大,常发生于静脉瓣处。AVG建立后引流静脉血流量增加,静脉瓣处产生湍流从而引起该部位血管内膜增生。本研究中引流静脉狭窄多发生在贵要静脉汇入腋静脉处,也与此处容易形成湍流有关[9]。此外,静脉瓣本身出现肥厚病变也是导致狭窄的原因[10],表现为静脉瓣变窄、活动受限、呈环形等。头静脉弓狭窄常发生于用上臂头静脉作为引流静脉的AVG,其原因也是头静脉弓处血管角度大而且有静脉瓣,容易产生湍流。
狭窄导致血流阻力增加和血流减少,是导致血栓形成的主要原因[11]。本研究中单纯狭窄患者只占少数,而大部分患者都是狭窄合并血栓形成,追问其病史多数患者术前几个月就已经出现血流量不足或静脉压升高等症状,说明这些患者早期就已经出现狭窄,这提示及时处理狭窄是预防AVG血栓形成的关键[12]。本研究显示合并血栓的患者其狭窄程度明显高于不合并血栓的患者,而两组患者在狭窄部位的构成上却无显著性差异,提示AVG血栓形成与狭窄的部位关系不大,而主要取决于狭窄的程度。即使狭窄没有发展到十分严重的程度,狭窄的存在也增加了血栓形成的风险,一旦有低血压、高凝状态等诱因出现则会形成血栓[13]。本研究中合并血栓的患者中有29.9%近期有血压降低病史,并且合并血栓患者的收缩压低于单纯狭窄患者,提示低血压是AVG血栓形成一个重要的诱因。此外,不恰当的使用促红素,使血红蛋白水平过高导致高凝状态也是AVG血栓形成的一个诱因。本研究中合并血栓患者的血红蛋白水平稍高单纯狭窄患者,但两组的血红蛋白水平均没有达标,因此认为本研究中AVG血栓形成与血红蛋白水平间的关系并不密切。
本研究PTA手术的成功率96.5%,无血管破裂和出血等并发症,提示PTA是处理AVG狭窄的一种安全有效的方法。AVG狭窄病变往往比较坚硬,这是由于增生的血管内膜纤维化和周围组织的瘢痕黏连,因此难以用普通压力的球囊扩开[14]。本研究中70%的狭窄需要用14 atm以上的压力,13.8%的狭窄需要18 atm以上的压力,提示在AVG狭窄病变的治疗中选择高压球囊是必要的。
AVG特定的解剖结构和血流动力学决定了其吻合口等部位不可避免会形成湍流和容易发生狭窄,导致AVG的初级通畅率较低。有文献报道AVG 1年的初级通畅率在40%~50%,2年的初级通畅率约25%[15]。本研究PTA术后AVG的初级通畅率也比较低,但再次PTA后AVG的次级通畅率却能达到比较高的水平,这提示虽然AVG的血流动力学决定了其初级通畅率较低,但可以通过重复PTA治疗获得较高的次级通畅率,因此应该重视对AVG进行更好的维护以提高其次级通畅率,延长其使用寿命。
传统的PTA是在造影监视下进行,超声监视下PTA是近几年出现的一种方法。超声监视的缺点是不能显示躯干部位的深部血管,其次是观察视野较小,单个画面只能显示很短一部分血管的图像。AVG大多数都位于四肢,位置比较表浅,超声下可以清楚显示。因此,大部分AVG的PTA可在超声监视下进行。超声监视也有其自身的优点,除了设备和场所要求低,没有射线伤害和造影剂损害外[4],超声监视最大的优点在于对于血栓形成和闭塞性病变,造影剂无法通过则造影下无法显影,而超声则不受限制。本研究中68.7%的患者为狭窄合并血栓形成,在超声下可以清楚地观察到血管的走形和管腔内的血栓,能引导导丝和球囊到达病变部位,并且获得了较高的手术成功率。因此,对于上肢血管通路的PTA治疗,用超声监视是一个很好的选择。
本文也存在一定的局限性,由于AVG狭窄和血栓形成的首选治疗方法为PTA,开放手术已经很少使用,故本研究缺少和其他手术方法进行比较。本研究主要涉及血管通路手术技巧的问题,难以用RCT的方法来研究和展示,加上本研究是一项回顾性分析,没有前瞻性设计,因此限制了本研究的质量。
综上所述,AVG狭窄最常见的部位是静脉吻合口。狭窄是引起AVG血栓形成最主要的原因,及时处理狭窄是预防AVG血栓形成的关键。AVG血栓形成与狭窄部位的关系不大,而主要取决于狭窄的程度。超声监视下PTA术是治疗AVG狭窄安全有效的方法。AVG的血流动力学决定了其特定部位好发狭窄和初级通畅率较低,但可通过重复PTA治疗获得较高的次级通畅率。

