DMS-CO2技术监测人工气道气囊密闭性的实验研究
黄 桃,向 军
(1.重庆医科大学附属第一医院重症医学科,重庆 400016;2.重庆医科大学附属第一医院设备处,重庆 400016)
0 引言
人工气道是保证气道通畅和呼吸支持的重要技术手段,在急危重症患者抢救、治疗过程中发挥了极其重要的作用,是急重症医学研究的重点和难点之一。人工气道气囊(artificial airway cuff,AAC)最基本的作用则是保证气道密闭性,确保有效通气量;防止AAC上方的气道分泌物、胃食道反流物等滞留物误入下呼吸道。现行AAC密闭性监测方法包括压力表测量法[1]、触摸判断法[2]及一次性压力传感器监测法等,均通过监测AAC压力来间接反映AAC密闭性程度,并以多项指南[3-4]推荐的经验性AAC 压力值 25~30 cmH2O(1 cmH2O=98.06 Pa)作为AAC密闭性的调控依据。以上方法存在明显局限性,不能个体化、精细化控制适宜的AAC压力。究其原因是缺乏AAC密闭性的客观、准确的动态监测方法。为此,本文联合应用临床医学和生物医学工程技术,创新性提出通过动态监测声门与AAC之间腔隙内CO2体积分数(dynamic monitor of subglottic carbon dioxidelevels,DMS-CO2)技术,实时监测 AAC密闭性,以期为AAC压力的个体化调控提供指导依据。
1 方法
1.1 AAC体外实验模型的建立
AAC体外实验模型由机械通气系统、AAC压力监测调控系统和DMS-CO2监测系统组成。AAC体外实验模型的系统整体结构如图1所示。
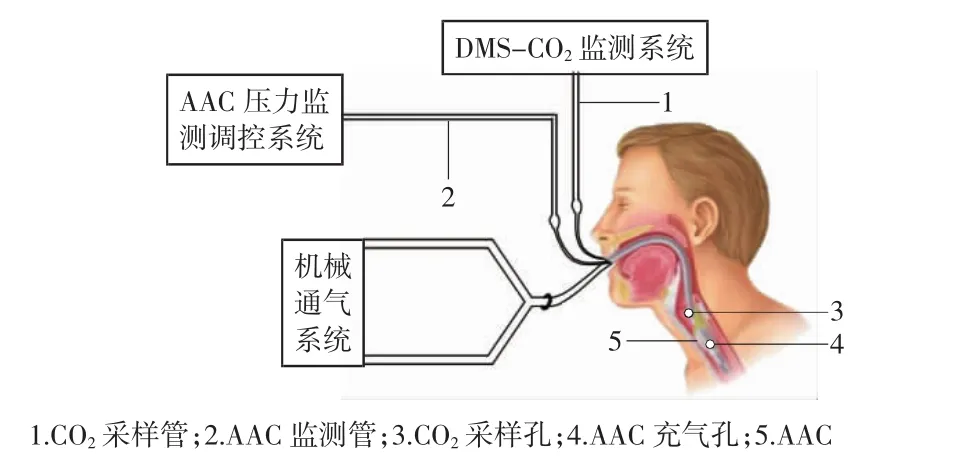
图1 AAC体外实验模型的系统整体结构示意图

图2 AAC压力监测调控系统
(1)机械通气系统:实验通气模型采用挪威Laerdal公司生产的SimMan 3G高智能模拟人,并用以色列CURATIVE公司生产的AnapnoGuard气管导管ETT(拥有AAC充气通道、CO2监测/冲洗通道、用于吸除AAC上方滞留物的吸引通道)对模拟人进行气管插管,应用Dräger Evita4呼吸机行机械通气。
(2)AAC压力监测调控系统(如图2所示):AAC充气管连接三通,一端连接Philips MP60监护仪压力传感器持续监测AnapnoGuard ETT气囊压力,另一端连接德国VBM气囊测压表以调控AAC压力。
(3)DMS-CO2监测系统:SimMan 3G模拟人具有CO2气体外接输入口,压力为45 mmHg(1 mmHg=133.322 Pa)的CO2经此气体外接口持续输入。将迈瑞Beneview T1监护仪CO2旁流模块连接AnapnoGuardETT的CO2监测管,以测量声门下CO2体积分数(以CO2分压表示)。同时,利用Philips MP60监护仪主流法监测呼吸机回路Y型接头处呼出的CO2体积分数。
呼吸机、监护仪等设备参数均录入Philips重症信息系统(如图3所示),并通过系统持续动态储存、抓取相关数据。

图3 Philips重症信息系统示意图
1.2 AAC密闭性监测的实验方法
通过AAC体外实验模型进行机械通气。将压力为45mmHg的CO2经SimMan 3G模拟人的CO2气体外接口持续输入。呼吸机参数如下:压力控制通气模式(pressure controlled ventilation,PCV),呼吸频率(respiratory rate,RR)15次/min、吸气压力(inspiratorypressure,Pi)30cmH2O、吸气时间(inspiratory time,Ti)1.6 s、呼气末正压(positive end expiratory pressure,PEEP)5 cmH2O。AAC 压力从0 cmH2O开始,以2 cmH2O的幅度逐渐增加至30 cmH2O,以上每个步骤均运行10 min。同时,在每个AAC压力水平均将1 ml美蓝和4 ml注射用水混匀稀释后经AnapnoGuard ETT冲洗通道注入至声门与AAC之间腔隙内,3 min后通过AnapnoGuard ETT腔内吸取SimMan 3G模拟人肺部美蓝稀释液引流量(即AAC渗漏量)。通过Philips重症信息系统抓取声门与AAC之间腔隙内CO2体积分数值、AAC压力值并手动记录美蓝稀释液引流量。以上实验操作重复进行20次。
1.3 统计描述
统计学分析均采用SPSS 18.0统计学软件。计量资料成正态分布的采用均数±标准差(x¯±s)表示,非正态分布资料以中位数表示,用四分位数间距描述其变异度。
2 结果
2.1 AAC体外实验模型测试结果
AAC体外实验模型的呼吸回路Y型接头处呼出CO2描记波形与人体典型CO2描记图波形一致,如图4、5所示;机械通气中,Vt、Pi及PEEP等设置参数与监测参数基本一致,如图6所示。

图4 典型CO2描记图波形

图5 实验中CO2描记图波形

图6 AAC体外实验模型实验中呼吸机参数显示界面
2.2 声门、AAC之间腔隙内CO2体积分数与AAC密闭性的关系
在一定范围内声门、AAC之间腔隙内CO2体积分数与AAC压力呈负相关(多项式趋势线R2=0.984 4,如图7所示),与美蓝稀释液引流量呈正相关。因此,在一定范围内声门、AAC之间腔隙内CO2体积分数与AAC密闭性呈负相关。
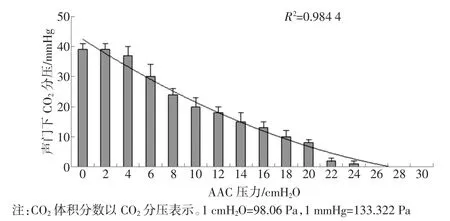
图7 声门下CO2体积分数与AAC压力的关系
3 讨论
如果AAC对气道密闭不严,AAC上方滞留物将沿AAC与气道缝隙渗漏至下呼吸道(即误吸),引起呼吸机相关性肺炎(ventilator associated pneumonia,VAP),导致其死亡率增高、住院时间和住院费用显著增加[5]。AAC上方滞留物是VAP病原菌的重要来源,误吸使细菌逆向定植,是目前公认的VAP发病机制。如果AAC压力过高,将引起AAC压迫区气道黏膜损伤。Payne等[6]研究显示,当AAC内压为25 cmH2O时,黏膜灌注血流开始受阻;内压为30cmH2O时,黏膜灌注血流被部分阻断,灌注压下降30%~60%;内压为40 cmH2O时,黏膜灌注血流明显减少,黏膜苍白,导致黏膜损伤。当AAC内压超过50 cmH2O时,黏膜灌注完全被阻断[7]。气道黏膜损伤随AAC压迫时间的延长而加重,气道黏膜受压超过一定时间时将导致气道黏膜缺血性损伤甚至坏死,严重时可发生气管食管瘘[8]。因此,如何以最适宜的AAC压力实现有效的AAC密闭是人工气道应用中预防误吸、VAP及气道黏膜损伤等高危并发症的关键。
AAC密闭性受AAC压力、AAC形状及材质[9]、气管插管型号[10]、负压吸引[11]、体位[12]、机械通气模式及其参数[13]等诸多因素影响且呈持续动态变化。因此,连续动态监测AAC密闭性在指导AAC压力调控中可发挥重要作用,但此问题目前未得到有效解决,仍缺乏AAC密闭性的动态监测和AAC压力的个体化控制。
AAC对气道封闭不严,将导致人体组织细胞新陈代谢过程中产生的高体积分数CO2经AAC与气道的缝隙泄漏至声门下。因此,理论上声门下CO2体积分数与AAC密闭性密切相关。在AAC体外实验模型中,通过SimMan 3G模拟人的CO2气体外接输入口,将压力为45 mmHg的CO2气体经外接口持续输入,以模拟人体肺部CO2体积分数。AAC体外实验模型的实验结果表明,其呼吸回路Y型接头处呼出CO2描记波形与人体典型CO2描记图波形一致,说明AAC体外实验模型能有效模拟机械通气患者排出CO2的过程;机械通气中,Vt、Pi及PEEP等设置参数与监测参数基本一致,表明AAC体外实验模型能有效模拟患者机械通气。因此,可利用AAC体外实验模型进行DMS-CO2技术的可行性实验研究。通过AAC体外模型实验结果显示,在一定范围内声门、AAC之间腔隙内CO2体积分数与AAC压力呈负相关,与美蓝稀释液引流量呈正相关。由此可知,在一定范围内声门、AAC之间腔隙内CO2体积分数与AAC密闭性呈负相关,从而验证了DMS-CO2技术作为AAC密闭性监测手段的可行性和有效性。
4 结语
本文通过AAC体外模型实验研究表明,DMSCO2技术可实现AAC密闭性的动态、准确监测,为指导适宜的AAC压力调控提供客观依据,从而实现以最适宜的AAC压力达到有效的AAC密闭。同时,DMS-CO2技术是利用监护仪CO2旁流法实现AAC密闭性监测,是现有技术在创新领域的拓展应用,具有实用性强、操作简单等优点。本文有关DMS-CO2技术的体外模型实验成果将为后续动物实验和临床研究打下坚实的基础,最终为实现AAC密闭性的个体化、精细化管理提供新思路和新途径,具有较好的应用前景。

