金属纳米材料对不同微生物聚集体的毒性研究进展
苗令占,王沛芳,侯 俊,王 超,姚 羽
(1.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏南京 210098;2.河海大学环境学院,江苏南京 210098)
人工纳米材料(engineered nanomaterials,ENMs)是指在三维空间中至少有一维处于纳米级尺度(1~100nm)内,或由纳米尺度作为基本单元构成的材料。纳米材料的发展已引起全球范围内生物、物理、化学等领域以及工农业方面的重大变革,并将对人类社会产生深远的影响[1-3]。纳米材料具有独特的理化特性,广泛应用于人类生产与生活各个领域。其中,金属类纳米材料(metallic nanomaterials,MNMs)相关产品是目前使用最为广泛的纳米产品,包括纳米 Ag、TiO2、SiO2、ZnO,CeO2、CuO 等[4-5]。 截至2015年,现有的纳米材料应用产品种类已达1900多种。然而,人工纳米材料可通过生产-运输-使用-处理处置、污水处理尾水排放、地表径流等途径直接或间接地释放到水环境中,经分散-团聚-沉降、生物摄取-累积放大等一系列的变化,最终对水生生物和生态系统产生毒性胁迫[6-9]。
微生物在水生态系统物质循环和能量流动中发挥着重要作用[10]。虽然目前已有研究证明部分纳米材料对微生物存在毒性效应,但这些研究主要以特定(单一)菌种或浮游生物为研究对象,而有关纳米材料对环境中复杂的微生物群落的潜在影响尚缺乏全面而系统的研究。水环境中,绝大部分的微生物都是以聚集体的形式存在(如活性污泥、生物膜、表层沉积物微生物群落等),并在污水生物处理、水生态系统平衡和水环境演变中扮演着非常重要的角色,对水体水质改善和生态修复具有重要作用[11]。然而,越来越多的纳米材料被释放到环境中,可能与微生物聚集体相互作用,影响聚集体的代谢活性和功能特性,进而对生态系统产生潜在威胁。
1 金属纳米材料在水环境中的传输
随着对纳米材料的需求和含纳米材料产品的不断增加,纳米材料在生产、消耗、处理过程中不可避免地释放到环境中。环境中人工纳米材料主要种类和来源见图1[12]。环境中纳米材料的种类主要为金属纳米材料及金属氧化物纳米材料,如纳米Ag、纳米TiO2等,主要来源于电子工业与光学产业、涂料及颜料和个人护理产品等。

图1 环境中人工纳米材料种类和主要来源
一般而言,金属纳米材料污染物先由市政管网系统传输到污水处理厂,而后通过污水处理厂尾水排放、地表径流侵蚀输送或以大气传输沉降等方式进入自然水生态系统[13]。根据 Musee等[14]的计算结果,洗漱用品中95%的纳米材料最终会通过污水排放、垃圾渗漏等多种途径进入废水处理系统。Peijnenburg等[15]也确定了日常生活中若是清洗含有人工纳米材料的衣物或纺织品,会有一定量的纳米银随废水排入污水处理系统或是直接进入水环境。目前环境中赋存的人工纳米材料浓度比较低,对水生生物不会产生明显的毒性影响。但多数的纳米材料不能被生物降解,水生生物可通过直接接触、吞食和摄取等途径吸收水体中的人工纳米材料。由于生物体清除纳米材料速率慢,纳米材料具有亲脂性和小尺寸效应等,纳米材料在生物体内长期累积,并可通过食物链或食物网进行传递或生物放大,导致高营养级生物的毒性效应,最终对整个水生态系统和人类造成严重影响[6-20]。同时,水中的理化条件(如离子强度、pH值及天然有机质等)也会影响纳米材料在水环境的团聚、沉降和溶解等,纳米颗粒会与其他污染物相互作用导致协同污染,最终对饮用水源带来威胁[21-23]。
2 金属纳米材料在水环境中的浓度分布
2.1 在污水处理系统中的浓度分布
城市污水处理厂是污染物重要的集中处理地,也是纳米材料最有可能发生累积的场所[24-25]。金属纳米材料进入污水处理厂的潜在途径及污染途径见图2[26]。最近一份调查显示,在亚洲、欧洲以及北美分别大约有10% ~30%,3% ~17%和4% ~19%的纳米材料被释放到水体中,污水处理厂污水中纳米材料的质量浓度达到 mg/L级别[27]。Westerhoff等[28]对10座具有代表性的污水处理厂进水和出水中的纳米材料质量浓度和种类进行了跟踪监测,结果显示,以纳米TiO2为例,其在污水处理厂入水中的质量浓度范围是181~1233 μg/L(平均质量浓度为321 μg/L),经污水处理厂处理后出水中质量浓度小于25 μg/L。污水生物处理系统对纳米TiO2的去除率达到98%,其中绝大部分纳米材料被截留在污泥中。对于多数种类的纳米颗粒(如Ag,TiO,Cu等),污水处理厂对它们的去除率能达到90% 以上,主要去除机制有污泥絮体的吸附、生物摄取以及物理沉降等[28]。污水处理厂尾水中的纳米材料质量浓度一般都低于μg/L的量级[24,27],污水处理厂成为纳米材料主要积累的场所。因此,关于纳米材料对污水处理效率的潜在影响及其对功能微生物毒性作用的研究显得尤为迫切。
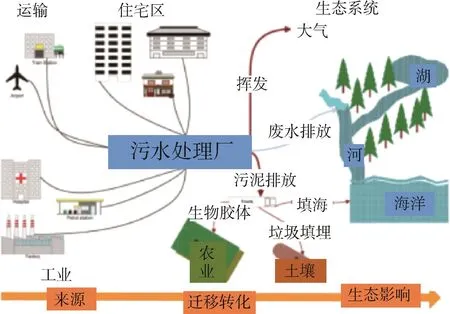
图2 金属纳米材料进入污水处理厂的可能途径及污染途径
2.2 在自然水生态系统中的浓度分布
纳米材料一旦排入水环境中,会有分散-团聚、沉降及迁移等过程,也可通过食物链在水生生物体内累积,或随水流运动而迁移扩散[29-30]。此外,纳米材料的高比表面积可作为水中其他污染物的吸附载体,促进污染物在地下水等环境中的长距离运输,造成污染带的大幅扩散[31-32]。近期,国内外学者纷纷尝试通过数学模拟来预测环境中的纳米材料浓度,但由于研究区域的差异以及模拟的精确度等问题,纳米材料的环境浓度还没有一个明确的数量级范围。而在实际生活中,可能会发生纳米泄漏事件而导致局部纳米材料浓度过高,从而增加生物暴露风险。Liu等[33]以纳米TiO2为例,利用年平均纳米产品的使用量预测纳米材料在不同环境介质中的浓度分布,发现释放到水环境中的纳米材料主要分布在自然水体和沉积物中,自然水体中的纳米材料质量浓度值已达到100 ng/L,如此高浓度的纳米材料将对水生生物构成潜在的威胁。但关于金属纳米材料在自然水体中的实际浓度仍需进一步研究。
3 金属纳米材料对微生物聚集体的毒性
3.1 对污水处理系统中活性污泥和生物膜的毒性作用
目前,有关纳米材料对污水处理系统中活性污泥毒性影响的研究已取得不少进展。这些研究主要关注纳米材料对活性污泥污水中N和P等的处理效率的影响、对微生物生长活性的抑制以及对微生物群落结构的改变等[34-37]。表1~2列出几种常见的纳米材料对污水处理厂营养物质去除及微生物群落结构的影响和因素表征。从表1~2可知,纳米材料的种类、暴露浓度和作用时间均是对污水N、P去除和微生物群落结构变化至关重要的因素,影响作用主要表现在纳米材料对活性污泥絮体中微生物细胞胞体产生破坏、对功能菌群的毒性作用以及对N、P去除过程相关酶活性的抑制作用。
大多数金属或金属氧化物纳米颗粒对活性污泥工艺的脱氮效果都存在不同程度的抑制作用。低浓度的纳米SiO2(1mg/L)无论是短期(1d)暴露还是长期(70d)暴露,对活性污泥生存能力和生物脱氮除磷效果并没有产生明显的影响。然而,当污泥长期暴露于高浓度(50mg/L)的纳米SiO2后,出水硝酸盐浓度增大,TN的去除率从79.6%下降到51.6%,但废水中TP的去除率并没有明显变化[38]。Zheng等[39]研究表明,在厌氧-缺氧系统中,经过 10 mg/L和50 mg/L ZnO纳米粒子短期暴露0.33 d后,TN去除率由初始的81.5%分别降到75.6%和70.8%。进一步的毒性机理研究表明TN去除率降低主要是由于ZnO纳米粒子释放出的Zn2+和产生的过量的活性氧自由基(ROS)抑制了硝酸还原酶的活性。此外,Chen等[40]研究了Cu纳米粒子对活性污泥脱氮处理效果及N2O产生量的影响,表明质量浓度为0.1~10 mg/L的Cu纳米粒子不仅可提高TN的去除率,而且会降低反硝化过程中N2O的产生量,主要原因是Cu纳米粒子溶解释放的Cu2+增加了反硝化菌的丰度,降低了亚硝酸盐的含量。Ag纳米粒子会降低微生物群落中变形菌门和拟杆菌门的丰度,而这两种菌门中含有许多与污泥絮体形成及有机物降解有关的细菌[41]。加入10 mg/L ZnO纳米粒子提高了活性污泥对COD的降解效率,而20、50和100 mg/L ZnO纳米粒子则分别使COD降解效率降低了 8.05%、19.46%和 27.74%[42]。

表1 不同类型的纳米材料对污水N/P营养物质去除的影响

表2 不同类型的纳米材料对微生物群落的影响
除活性污泥法之外,好氧生物膜法也是污水处理常用的工艺。相比于传统的活性污泥,好氧生物膜具有致密、稳定的结构,对冲击负荷和有毒有害物质具有较高的耐受能力[50-51]。由生物膜内微生物分泌的胞外聚合物通过架桥作用将膜内微生物群体连接形成三维微生物聚合体结构,因此与悬浮的活性污泥絮体相比,生物膜这种稳定的三维结构可能会导致其在应对外界污染物时的响应机制与活性污泥絮体不同[51]。然而,目前关于纳米材料对生物膜毒性作用的研究还不多见,Sheng等[52]研究发现,纳米银对污水生物膜的微生物群落有着短期的毒性影响,可抑制异样微生物的生长代谢,并对生物膜整体结构也存在负面影响。Hou等[53]利用溶解氧微电极系统研究发现高浓度(50 mg/L)的纳米氧化锌会抑制生物膜表层微生物的氧呼吸活性,通过监测纳米氧化锌在污水中的溶解情况,并结合二价锌离子对照试验,得出纳米氧化锌对生物膜的毒性作用主要是由其溶解释放的锌离子而产生的结论。Miao等[54]研究发现暴露于纳米氧化铜的生物膜会分泌更多的胞外聚合物,从而抑制纳米颗粒的毒性。Miao等[54]还分析了纳米氧化铜对生物膜微生物群落结构和组成的影响。但是,由于生物膜复杂的群落组成和结构特性复杂,对生物膜的毒性作用及相关机制仍需进一步研究。
3.2 对自然水生态系统中生物膜的毒性作用
自然水体生物膜是一种普遍存在于自然水生态系统中的微生物聚集体,多生在江河湖海水体中各种载体如石块、水生植物茎叶、表层沉积物等[55]的表面上。生物膜是一种复杂的微生态系统,主要包括藻类、细菌、真菌、原生动物及后生动物等。由微生物分泌的胞外聚合物所包裹,构成了稳定的三维结构和复杂的微生物群落组成[56]。自然生物膜对驱动水体多种重要生源要素的生物地球化学循环至关重要,它们几乎能参与水-沉积物界面中所有的生物化学反应,包括生态系统物质循环过程中不可或缺的碳循环、氮循环、磷循环等。生物膜这些生态功能特性及强弱很大程度上取决于微生物的群落结构,同时,微生物群落结构变化在指示水体环境变化上有重大作用[55]。
目前关于金属纳米材料对自然水体生物膜的毒性研究极少。Gil-Allue等[57]通过试验证明,河流固着生物的呼吸作用、光合作用以及β-葡萄糖苷酶、亮氨酸氨肽酶会对纳米银产生毒性响应而受到不同程度的抑制,但其碱性磷酸酶的活性在不同程度纳米银暴露下不受抑制或刺激;Liu等[58]通过室内暴露试验发现,当暴露于TiO2纳米颗粒(5mg/L)中5d后,生物膜中微生物群落结构发现了明显的变化,但生物膜的光合作用和代谢功能仍保持稳定。Tang等[59]研究发现5mg/L的Fe2O3纳米颗粒能够引起生物膜内叶绿素含量的升高,抑制了膜内总的抗氧化酶活性,同时改变了生物膜微生物的群落结构。纳米材料对自然水体微生物聚集体表毒性的研究才刚刚开始。鉴于微生物聚集体对水生态系统的重要作用,在人工纳米材料归于水生态系统后,关于人工纳米材料和生物膜群落结构之间相互作用的研究是必不可少的。
4 研究展望
截至目前,虽然金属纳米材料对污水处理系统中微生物聚集体的毒性研究已经取得了一定进展,但关于金属纳米材料对活性污泥和生物膜的毒性作用机制及其对水处理系统的影响研究还不够全面。纳米材料经污水处理厂尾水排放到水环境中后在自然水体中的迁移转化和对微生物影响的有关研究才刚刚起步,尤其关于纳米材料对自然水生态系统中的微生物聚集体影响的研究十分缺乏。同时,大多数研究采用的是室内短期暴露试验,且纳米材料的浓度远高于环境中的实际浓度,缺乏野外现场的长期监测试验研究,因而不能够准确地反映纳米材料对水生态系统的负面影响。
未来的研究方向可以包括以下几个方面:
a.污水处理系统中生物膜的结构比活性污泥更加复杂,其对金属纳米材料的毒性响应可能与活性污泥不同,因此,可研究金属纳米材料对生物膜的生物活性和微生物群落结构的影响,解析其中的毒性作用机制,进一步明确纳米材料对水处理系统的潜在影响。
b.自然水体生物膜作为一种常见的环境介质,富集水体中众多的污染物质,因此,亟须开展金属纳米材料与自然水体生物膜的相互作用研究,并通过长期的连续监测,解析其对自然生物膜群落结构的影响。
c.自然生物膜广泛参与水生态系统的物质循环和能量流动,金属纳米材料可能会对生物膜中的微生物群落产生毒性作用,进而影响其生态功能,因此,关于金属纳米材料对自然生物膜水体净化功能,尤其是对特定物质循环(碳、氮、磷循环)所涉及的迁移转化及其功能菌群的研究将是未来的研究重点,这对探明纳米材料的环境效应与生态安全具有重要的理论和现实意义。

