连作栽培对露地草莓根际土壤真菌群落结构的影响
李星月, 肖连康, 李其勇, 曹坳程, 洪 杰, 朱从桦, 符慧娟, 张 鸿*
(1.四川省农业科学院植物保护研究所 农业部西南作物有害生物综合治理重点实验室,四川 成都 610066;2.凉山州植物检疫站,四川 西昌 615000;3.中国农业科学院植物保护研究所,北京 100193)
【研究意义】草莓(FragariaananassaDuch)作为一种兼具营养和经济价值的水果,在我国主要经济作物中占有重要地位,长期保持着大规模的种植水平,并呈现出稳定增长的趋势[1-2]。作为我国草莓的主要产地之一,四川省的草莓种植历史悠久,目前全省栽培面积和产量全国第一。草莓生长的极限温度为-5 ℃,而凉山州德昌县由于地处低纬度高原的亚热带季风气候区,冬春两季的光热资源丰富,最冷月平均温度在10 ℃以上,是难得的高山露天草莓生产区,草莓生产中仅需地膜覆盖即可安全越冬[3]。德昌草莓种植始于1986年,初期以适应本地种植的“宝交”早生品种为露地主栽品种,自20世纪90年代初农户自主引进“丰香”之后,随着农业产业结构调整和草莓种植效益提升,德昌开展一系列草莓引进新品种试验,筛选出的主栽品种“甜查理”占种植面积的90 %以上[4]。【前人研究进展】露地草莓与温室草莓一样,都主要采用一年一栽的栽培模式,由于耕地限制等客观条件,露地草莓的连作栽培现象也普遍存在。连作栽培容易造成草莓生产中的土传病害加剧、土壤养分失衡、土壤理化性状劣变、土壤酶活性下降,加上化感物质不断积累、土壤酸化等连作效应发生,后茬草莓植株生长发育受阻、产量与品质下降,严重阻碍了露地草莓生产的可持续发展[5-7]。此外,根际是植物生态系统和土壤生态系统交叉形成的特殊区域,农作物连作障碍与根际土壤的微生物群落结构密切相关,作物连作打破了根际土壤微生物生态平衡,进而导致有益微生物减少和病原微生物的积累[8-10]。真菌是土壤微生物的重要成员,推动着土壤生态系统能量流动和物质循环,在土壤中发挥着重要的分解作用[8]。目前,高通量测序技术在微生物生态学研究中具有很大优势,可以直接测定环境样品中的基因组片段,具有测序通量高,效率高和重复性好的特点[10]。【本研究切入点】本研究运用Illumina高通量测序技术研究非连作栽培露地草莓、连作栽培未发生连作障碍露地草莓和发生连作障碍露地草莓的根际土壤的真菌群落结构,探讨连作栽培对露地草莓根际土壤真菌群落结构的影响。【拟解决的关键问题】为改善连作土壤生态环境、解决露地草莓连作障碍提供理论基础。
1 材料与方法
1.1 样品采集
土壤样品采集于四川省凉山州德昌县小高乡露地草莓栽培基地(27°35′N,102°28′E,海拔1295 m),种植品种为“甜查理(Sweet Charlie)”,在草莓初果期(12月20日),随机选取非连作栽培露地草莓(S0_Fu)、连作栽培(10年)未发生连作障碍露地草莓(S1_Fu)和连作栽培(10年)发生连作障碍露地草莓(S2_Fu)的各1块地,用抖落法分别取每块地6处样地根际0~20 cm处土壤均匀混合,将混合土样装入无菌EP 管,用冰盒保存,立即带回微生物实验室4 ℃保存。
1.2 主要试剂和仪器
美国Omega土壤DNA 提取试剂盒(E.Z.N.A.®Soil DNA Kit),北京华越洋生物科技有限公司;胶回收试剂盒(DP209-02),北京华越洋生物科技有限公司;引物合成,生工生物工程(上海)股份有限公司;Q5®High-Fidelity DNA Polymerase (MO491L),北京NEB 有限公司。2700 型PCR 扩增仪,美国ABI公司;DYY-6C 电泳仪,北京六一生物科技有限公司;MiSeq PE300 测序平台,美国Illumina 公司。
1.3 土壤总DNA 的提取及16S rRNA 基因的PCR 扩增
土壤总DNA 基因组采用DNA 提取试剂盒进行提取。真菌菌群用ITS(Internal transcribed spacer)序列高通量测定,遵循Illumina 测序仪文库构建方法,以ITS3-4 为目标DNA区域,采用扩增引物为:ITS1:(5′-TCC GTT GGT GAA CCA GCG G-3′),ITS4 :(5′-TCC TCC GCT TAT TGA TAT GC-3′)。PCR结束后,PCR产物进行琼脂糖电泳检测。真菌PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍的磁珠(Agencourt AMPure XP)处理,真菌PCR产物和其他扩增片段小于400 bp的PCR产物,选用0.8倍的磁珠处理。利用Qubit3.0 DNA检测试剂盒对回收的DNA精确定量,以方便按照1∶1的等量混合后测序。等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol。将样品送至生工生物工程(上海)股份有限公司在Illumina MiSeq 平台进行高通量测序。
1.4 数据分析
基于对reads数据的拼接、过滤、去嵌合及非特异性扩增序列的数据前处理,采用Mothur 软件进行真菌样品的Alpha多样性分析,包括Chao1指数、ACE指数、Simpson指数和Shannon指数。使用R软件对属进行基于Bray-Curtis的样本聚类分析,对丰度前50位的种进行聚类分析并绘制热图。
2 结果与分析
2.1 测序序列长度分析
质量控制后,各处理的剩余序列都在20 000条以上,其中连作栽培未发生连作障碍露地草莓(S1_Fu)的剩余序列最多,为26 226条。非连作栽培露地草莓(S0_Fu)中嵌合体数目最多,为33个。连作栽培发生连作障碍露地草莓(S2_Fu)处理后序列平均长度最长,为380.25 bp(表1)。
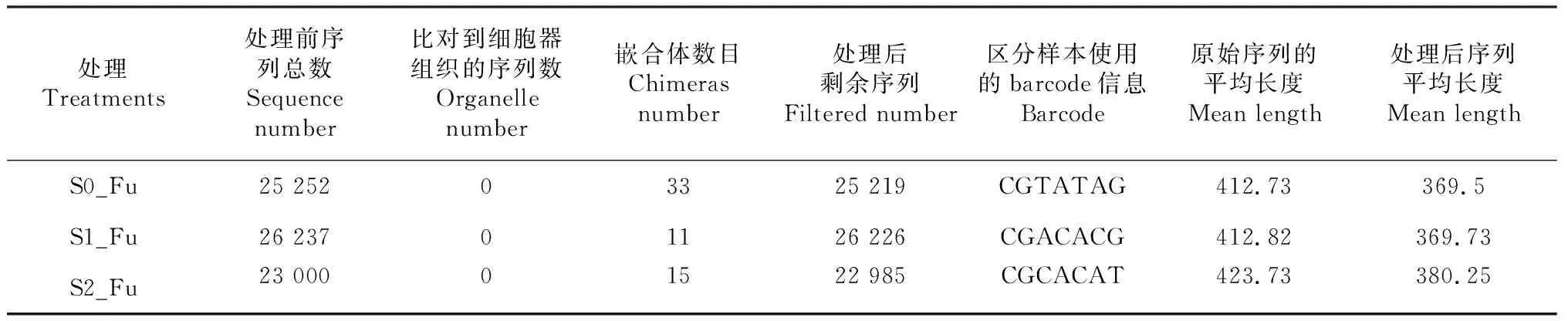
表1 测序数据处理统计
2.2 真菌多样性分析
从表2可以看出,各样品文库的覆盖率的值为0.98左右,表明样本中序列没有被测出的概率越低,本次测序结果基本代表样本的真实情况。在97 %的相似水平下,进行OTU进行生物信息统计分析,共计比对2311个OTUs。其中,S0_Fu根际土有1088个OUTs,S1_Fu根际土有877个OUTs,S2_Fu根际土有833个OUTs,且3个处理根际土壤内真菌种类存在显著的差异,其共有OTUs仅为111个,而多为独有的OTUs。
样品的Alpha 多样性指数结果表明,非连作栽培露地草莓(S0_Fu)根际土的真菌丰富度明显高于连作露地草莓根际土,连作栽培发生连作障碍露地草莓(S2_Fu)根际土中的真菌OTU 数比连作栽培未发生连作障碍露地草莓(S1_Fu)的根际土中多。非连作栽培露地草莓(S0_Fu)根际土的Chao1 指数和ACE指数显著高于连作栽培露地草莓根际土,其中发生连作障碍的Chao1 指数和ACE 指数均小于未发生连作障碍的露地草莓根际土。综合考虑了真菌群落的丰富度和均匀度,非连作栽培的Shannon指数显著大于连作栽培的露地草莓根际土,连作栽培未发生连作障碍的根际土Simpson 指数小于发生连作障碍的根际土,说明非连作栽培的露地草莓根际土中真菌多样性最高,发生连作障碍比未发生连作障碍的连作根际土真菌多样性更低。
表3为各处理在门和科2 个分类水平上真菌菌群的比例。由表1 可知,门分类水平上构成露地草莓初果期根际土壤的优势真菌群落为接合菌门(Zygomycota),分别占全部群落的52.35 %、56.74 %和69.98 %,其他依次为担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota),而其他杂菌分别占14.96 %、18.42 %和18.75 %。与非连作栽培(S0_Fu)相比,连作栽培(S1_Fu和S2_Fu)可显著提高接合菌门的真菌丰度和比例,并显著降低了担子菌门、子囊菌门、壶菌门和球囊菌门真菌群落的丰度和比例。连作栽培的条件下,发生连作障碍(S2_Fu)的根际土中接合菌门丰度和比例都比未发生连作障碍(S1_Fu)的大,而发生连作障碍(S2_Fu)的根际土中担子菌门、子囊菌门、壶菌门和球囊菌门的真菌群落丰度和所占比例都比未发生连作障碍(S1_Fu)的小。
科分类水平上构成露地草莓初果期根际土壤优势群落依次为接合菌门被孢霉科(Mortierellaceae)、担子菌门粪伞科(Bolbitiaceae)、担子菌门鬼伞科(Psathyrellaceae)、担子菌门未分类或未识别科(unclassified_Basidiomycota)、担子菌门球盖菇科(Strophariaceae)、接合菌门未分类或未识别科(unclassified Zygomycota)。其中,接合菌门被孢霉科(Mortierellaceae)的丰度和比例:(S2_Fu)>(S1_Fu)>(S0_Fu),而担子菌门粪伞科(Bolbitiaceae)、担子菌门鬼伞科(Psathyrellaceae)、担子菌门未分类或未识别科(unclassified_Basidiomycota)、担子菌门球盖菇科(Strophariaceae)、接合菌门未分类或未识别科(unclassified Zygomycota)的丰度和比例:(S2_Fu)<(S1_Fu)<(S0_Fu)。
由图1(见封三)可知,未分类的被孢霉属(unclassifiedMortierellaceae)为样本中真菌微生物的绝对优势类别,在S0_Fu、S1_Fu和S2_Fu根际土壤中的相对丰度为50.54 %、55.12 %和68.77 %,测序过程中reads数目分别为12 745、14 457和15 806。与连作栽培相比,非连作栽培的露地草莓根际土壤中红酵母属(Rhodotorula)的丰度和相对丰度明显较低,而未分类的粪锈伞属(unclassifiedBolbitiaceae)、鬼伞属(Coprinellus)的丰度和相对丰度明显较高。在连作栽培条件下,红酵母属(Rhodotorula)、原球盖菇属(Protostropharia)和未分类的无梗囊霉属(unclassifiedAcaulosporaceae)的丰度在发生连作障碍(S2_Fu)的根际土中明显低于未发生连作障碍(S1_Fu)的根际土中,而未分类的粪锈伞属(unclassifiedBolbitiaceae)和未分类的伞菌属(unclassifiedAgaricomycetes)的丰度在发生连作障碍(S2_Fu)的根际土中明显高于未发生连作障碍(S1_Fu)的根际土中。
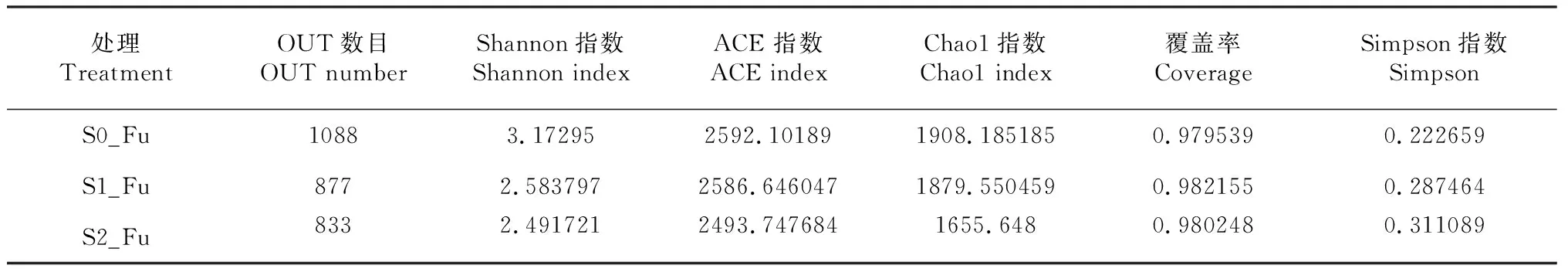
表2 根际真菌Alpha 多样性指数
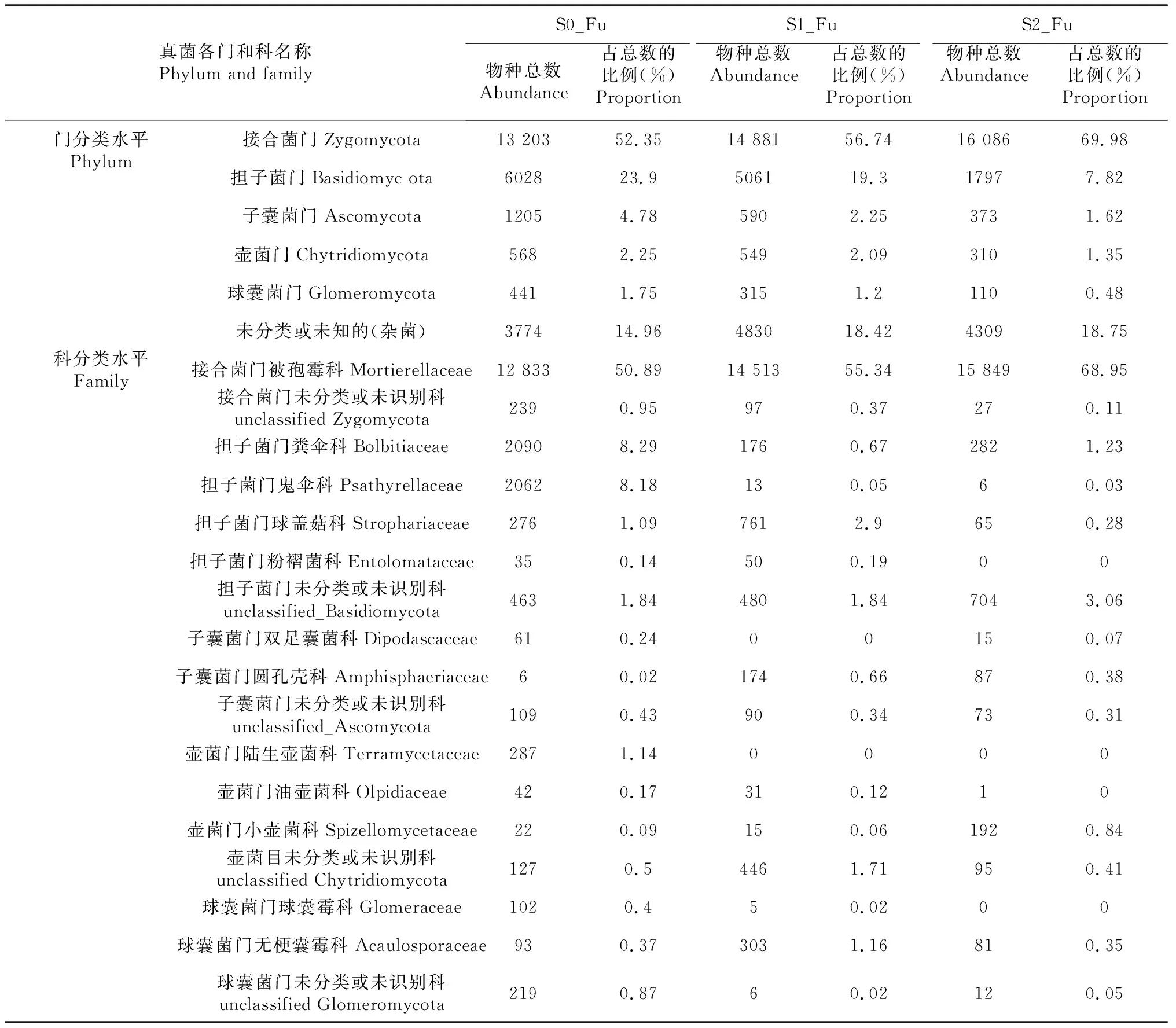
表3 根际真菌在门和科分类水平的丰度比较
物种丰度热图,用物种丰度矩阵绘制,颜色块代表相对物种丰度值,颜色越红表示相对丰度越高,颜色越蓝反之。热图对样本做了聚类,样本菌群分布越类似则样本距离越近,在图上方聚类树中的位置越靠近。由图2(见封三)可以看出,总体上连作栽培的2个土样中真菌种群更为相似,而与非连作栽培相比有较大差异,但各优势类群种在S1_Fu和S2_Fu根际土壤中的丰度和比例也有一定差异,可见连作栽培以及连作障碍的发生对露地草莓根际土壤的优势真菌种群产生了一定的影响。其中,粪锈伞科的Bolbitiaceaesp.和鬼伞属的Coprinellusmarculentus在非连作栽培(S0_Fu)的根际土壤中丰度分别为1979(占比7.85 %)和2046(占比8.11 %),显著高于连作栽培的2个土样(S1_Fu和S2_Fu),而棒孢拟盘多毛孢(Neopestalotiopsisclavispora)的丰度显著低于连作栽培的2个土样(S1_Fu和S2_Fu),且相对丰度相差均超过10倍。粘红酵母(Rhodotorulaglutinis)在连作栽培未发生连作障碍(S1_Fu)的根际土中丰度为2800(占比10.68 %),显著高于发生连作障碍(S2_Fu)的根际土中的丰度460(占比2.00 %),原球盖菇属的Protostrophariaalcis、无梗囊霉科的Acaulosporaceaesp.和壶菌目的Chytridialessp.在S1_Fu根际土中的丰度与占比都显著高于S2_Fu。此外,多个真菌种在连作栽培中丰度有所降低,而在连作障碍发生的降低程度更为显著。
3 讨 论
土壤根际微生态系统的失衡是连作障碍的发生的重要因素,连作栽培导致土壤根际微生物群落结构和功能多样性改变,降低有益微生物数量,增加土传病菌数量,从而引起作物减产[10-12]。采用可培养方法观察到的微生物不到微生物群落的1 %,无法全面反映微生物的真实状况,而本研究采用IlluminaMiSeq 测序技术,且各样品测序的稀释曲线都趋于平缓,各样品文库的覆盖率的值较高,真实全面地反映了连作障碍发生对露地草莓根际中真菌群落结构组成的影响。
实验结果中检测出共有OTUs较少,根际真菌在门、科、属、种4个分类水平的丰度差异大,说明连作栽培以及连作障碍的发生对露地草莓根际土壤的真菌种群结构产生了显著的影响。Alpha 多样性指数结果表明,非连作栽培露地草莓根际土的真菌丰富度明显高于连作露地草莓根际土,连作栽培可导致露地草莓根际土中真菌多样性降低,且发生连作障碍比未发生连作障碍的根际土真菌多样性降低效应更为明显。本研究结果发现,接合菌门的被孢霉科(Mortierellaceae)是科分类水平上构成露地草莓初果期根际土壤优势群落,该菌主要参与分解土壤中的糖类和简单多糖物质,是参与草莓土壤的养分循环的主要真菌。从测序过程中的reads种类和数目结果中发现连作栽培导致草莓的致病真菌增多,主要是棒孢拟盘多毛孢(Neopestalotiopsisclavispora)种群显著提高,由于该菌可引起草莓根腐病、叶斑病[12-13],严重影响草莓长势和产量,推测该菌是导致露地草莓连作障碍的重要因素之一,是以后解决连作障碍问题的重要防治靶标。此外,没有发现灰霉病菌(Botrytiscinerea)、胶孢炭疽菌(Colletotrichumgloeosporioides)、立枯丝核菌(Rhizoctoniasolani)、镰刀菌(Fusariumsp.)等其他的草莓致病真菌。
粘红酵母(Rhodotorulaglutinis)作为一种用于生物防治的拮抗菌,具有拮抗效果好,不产生毒素,可以分泌胞外水解酶(几丁酶,β-1,3-葡聚糖酶等)分解病原菌细胞壁,从而抑制病原菌的生长[14]。前期研究还发现了粘红酵母所产生的酶能分解了灰葡萄孢(Botrytiscinerea)的孢子细胞壁,对草莓采后灰霉病有较好抑制效果[15]。本研究结果显示粘红酵母(Rhodotorulaglutinis)在连作栽培未发生连作障碍(S1_Fu)的根际土中丰度是发生连作障碍(S2_Fu)的根际土中丰度的40多倍,推测粘红酵母(Rhodotorulaglutinis)是在防止连作障碍发生上扮演了重要的角色,该菌不仅能有效地利用贫乏营养快速增殖,并且能耐受低温等不良环境,拮抗效果好,从而降低了草莓真菌病害发生率。
无梗囊霉科(Acaulosporaceae)作为丛枝菌根真菌(Arbuscular Mycorrhizal Fungi,AMF)的重要成员,是一类非常重要的与植物根系共生的土壤微生物,与植物有密切的互惠共生关系[16]。本研究结果发现,无梗囊霉科真菌Acaulosporaceae sp.在未发生连作障碍的连作栽培根际土中的丰度与占比都显著高于发生连作障碍的连作栽培根际土,由此推断无梗囊霉科真菌是阻碍露地草莓连作障碍发生的重要真菌种群,不仅可以促进草莓植株对矿质元素的吸收,还能增强宿主植物的抗逆性和抗病性,进而缓解了连作障碍的发生。
4 小 结
本文从土壤微生物群落结构的角度对3种种植状态下的露地草莓根际土壤样品进行测序分析,探究了影响露地草莓健康生长的真菌群落关键因子,对以往草莓连作障碍的研究进行了补充,研究结果从微生物生态学的角度进一步表明,连作栽培的问题不仅体现在土壤理化性状劣变、土壤养分失衡等,连作障碍的发生还与土壤微生物真菌群落多样性下降、关键的有益真菌(粘红酵母、无梗囊霉等)大幅减少,以及病原真菌(棒孢拟盘多毛孢)显著增多相关,该结果为今后改善连作土壤生态环境、治理露地草莓连作障碍提供了理论基础。

