LED绿光对生菜生长和品质的影响*
王晓晶陈晓丽郭文忠李海平李灵芝**
LED绿光对生菜生长和品质的影响*
王晓晶1,2,陈晓丽2,郭文忠2,李海平1,李灵芝1**
(1.山西农业大学园艺学院,太谷 030801;2.北京农业智能装备技术研究中心,北京 100097)
在全人工光型植物工厂内以水培奶油生菜(L.)为试验材料,运用光质及光强可调节的LED植物生长灯,以8:00−24:00照射强度为200μmol·m−2·s−1的白光为基础光(对照W),依次以强度为50(WG50)、100(WG100)、150μmol·m−2·s−1(WG150)的绿光取代相等强度的白光照射生菜,并测定生菜叶片生物量、形态、叶片数以及叶绿素、硝态氮、维生素C、可溶性糖、粗纤维和淀粉的含量,以探究绿光对生菜生长及品质的影响,为LED绿光的供光策略提供参考。结果表明:(1)在50μmol·m−2·s−1的绿光处理下,生菜地上部叶绿素含量显著高于对照,地上部干重较对照提高3.69%。(2)随着绿光强度的增加和基础白光强度的减弱,生菜地上部可溶性糖和维生素C含量均呈现先升高后降低的趋势,二者均在WG50处理下达到最高,并显著高于对照(P<0.05),而在WG150处理下达到最低,并显著低于对照(P<0.05)。(3)与对照相比,绿光处理均降低了生菜叶片中淀粉、粗纤维以及硝酸盐的含量,其中硝酸盐含量在WG50处理下达到最低。说明50μmol·m−2·s−1强度的绿光有促进生菜干物质积累以及提升生菜品质的作用。
植物工厂;LED;绿光;白光;生菜
生菜(L)是叶用莴苣的俗称,属菊科莴苣属,为1~2a生草本植物,营养价值丰富。近年来,随着人们生活水平的不断提高,对高品质蔬菜的需求日益增加[1],因此,建立高产优质的蔬菜生产体系十分重要。而植物工厂作为设施农业发展的最高阶段,具有产量高、品质好、病虫害少、空间利用率高及安全无污染的优点,为蔬菜生产提供了一个优良的生长环境[2−4]。
光在植物光合作用、生长发育以及光形态建成等方面起着至关重要的作用[5]。发光二极管(LED)作为第三代新型光源,较荧光灯、高压钠灯和金属卤化物灯而言,具有波段窄、波谱可调节、产热小及寿命长等优点[6−7],已被广泛应用于设施园艺尤其是密闭植物工厂的生产和研究中[4,8−10]。一般认为,植物的叶片之所以呈现绿色是因为可见光中的绿色波段大部分被植物叶片反射所致,因此,认为绿光对植物生长是无用的[11]。如蒲高斌等[12]研究了不同光质对番茄幼苗生长和生理特性的影响,发现绿光下植株的光合速率、单株干重、果实产量等都有所下降。然而,也有研究表明,绿光在提高可溶性糖含量及改善蔬菜品质方面有一定的潜力[13]。如Chen等[14]在白光的基础上,分别以LED红外光、红光、黄光、绿光以及蓝光作为补充光照射生菜,结果发现,补充绿光的处理中生菜可溶性糖含量较其它处理高出38%~142%。伍洁等[15]在红蓝光质配比为6﹕4的基础上添加10%、20%、40%的绿光照射生菜,发现生菜可溶性糖含量随着绿光比例的升高而增加。陈晓丽等[11]研究了不同绿光补光模式对生菜生长和品质的影响,结果发现补充绿光的处理均提高了生菜可溶性糖、粗蛋白以及维生素C含量,同时降低了硝酸盐含量,其中,生菜可溶性糖、粗蛋白以及维生素C含量随着绿光补光强度的升高而增加,且低强度的绿光更有利于生菜生长及生物量的积累。Son等[16]的研究也表明在红、蓝光基础上补充绿光能够改善生菜的生长。有研究认为绿光对植物生长的促进作用是由于绿光能够更好地穿透植物冠层,而透射的绿光促进了下层叶片的光合作用,从而促进了植物整体水平上的生长,但过量的绿光则会抑制植物的生长[17−23]。Johkan等[24]研究表明,高强度的短波长绿光能够促进植株的生长,Kim等[25−26]的研究表明,在总光强为150μmol·m−2·s−1的基础上,补充占总光强24%的绿光,生菜的地上部干重提高了46.7%,然而,随着绿光比例的增加,绿光照射的植株生长量减少。
已有研究表明绿光对园艺作物的生长及品质形成可能存在一定的有益作用。目前,设施光环境的调控和光配方优化主要以LED白光及红、蓝光为主[27−28],但对于补充绿光的研究报道较少,而以绿光取代背景光的研究鲜见报道。本研究在确保生菜正常生长的前提下,以白光为基础光,以峰值波长为520nm的不同强度的绿光取代相等强度的白光照射生菜,测定生菜生物量、形态、叶片数以及叶绿素、硝态氮、维生素C、可溶性糖、粗纤维和淀粉的含量。在不增加电能消耗的基础上,探究不同强度的绿光对生菜生长和品质的影响,及在同等耗电量条件下使绿光发挥最大效用的光强,以期为设施作物生产中光环境的精准调控及优化以及生产能效的提升提供一定的理论依据。
1 材料与方法
1.1 光源参数
使用北京某研究中心研制的可调LED植物生长光源,运行白光(W)和绿光(G)两个光通路,每种光质的强度及供光时间可以独立设定和调节。其中,绿光峰值波长为520nm,白、绿光光谱见图1。光照强度的测定采用Li-250A光量子计(LI-COR,美国),白、绿光光谱的测定采用USB-650型光谱仪(Ocean Optical,美国)。
1.2 试验设计
试验在全人工光型植物工厂中进行,试验材料为奶油生菜。将生菜种子直接播种在湿润的海绵块中进行育苗,15d后生菜幼苗生长至两叶一心时,选取株高株幅相近的幼苗定植到栽培槽内(80cm×80cm),每个栽培槽种植25株生菜,株距为16cm,定植当天开始进行不同的光环境处理。植物工厂内温度设定为23℃左右,空气湿度65%,CO2浓度400μmol·mol−1,营养液采用霍格兰配方,pH、EC分别保持在6.0和1.25mS·cm−1左右,营养液每7d更换一次,从播种日起至第39天(即定植后第24天)收获生菜并测定相关指标,试验设3次重复。
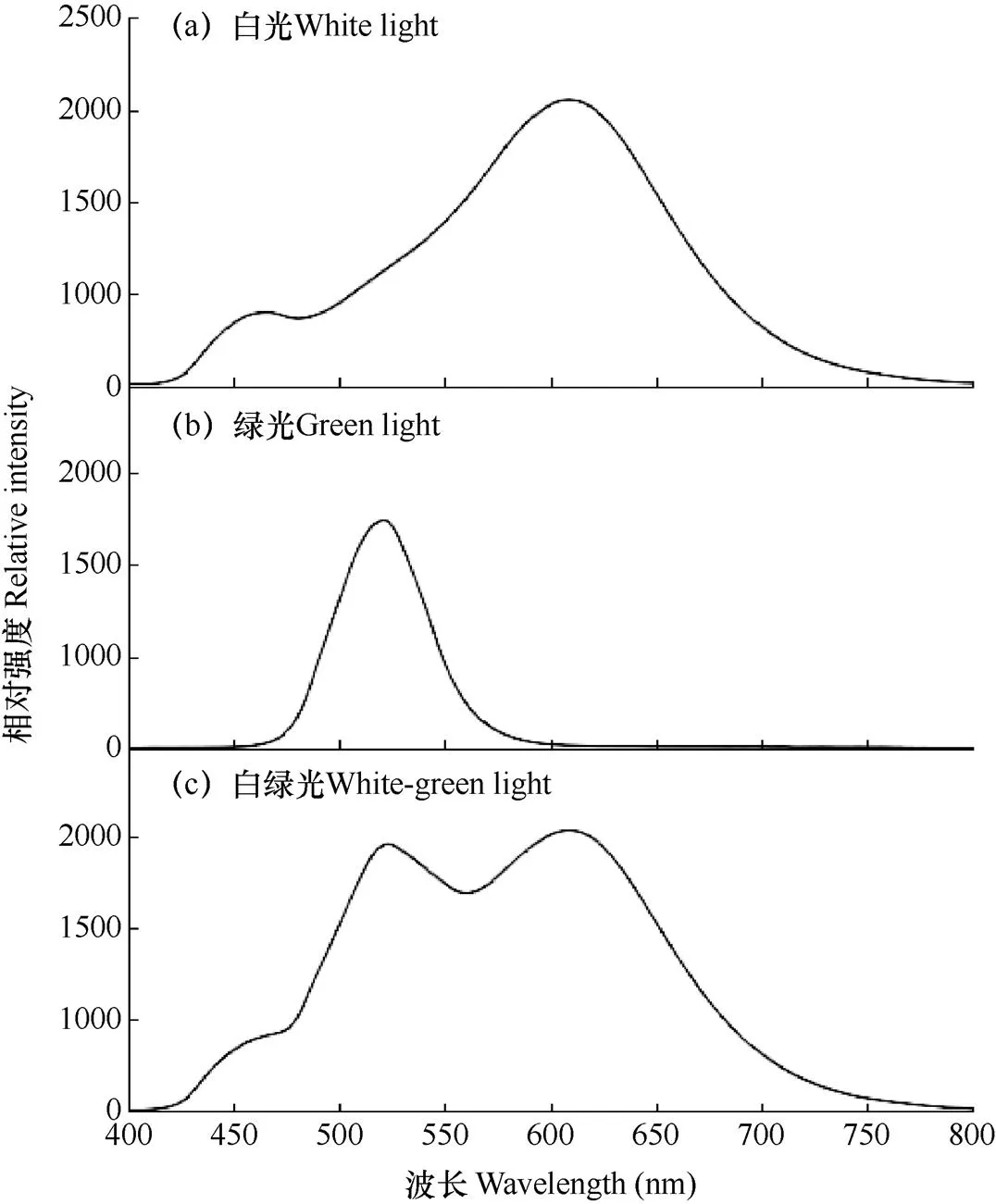
图1 白绿光源光谱图
试验共设置4个光照处理,以纯白光为对照(W),根据前期研究基础以及已有的试验结果,其它处理在白光基础上以3种不同强度的绿光(50、100和150μmol·m−2·s−1)取代等强度的白光,分别记作处理WG50、WG100和WG150,各处理的光源位于栽培板正上方30cm处,距离栽培板15cm高度处的总光强均为200μmol·m−2·s−1,每日光照时间为16h(8:00− 24:00),具体见表1。
1.3 取样与指标测定
在生菜定植后第24天(即播种后第39天)进行收获,每个处理随机选取3株生菜,用直尺测量生菜的株高(茎基部到最高点的距离)和株幅(植株最宽处的宽度),并记录每株的叶片数;用电子天平称量植株地上部的鲜重和根鲜重,在烘箱中105℃杀青30min,之后85℃烘干至恒重后分别称量生菜地上部和根的干重;计算生菜地上部含水率;叶绿素和类胡萝卜素含量的测定采用分光光度法[29];硝酸盐含量测定采用分光光度法[30];维生素C含量测定采用钼蓝比色法[31];可溶性糖含量测定采用蒽酮比色法[30];粗纤维含量测定采用酸碱乙醚洗涤法[32];淀粉含量测定采用蒽酮比色法[29]。
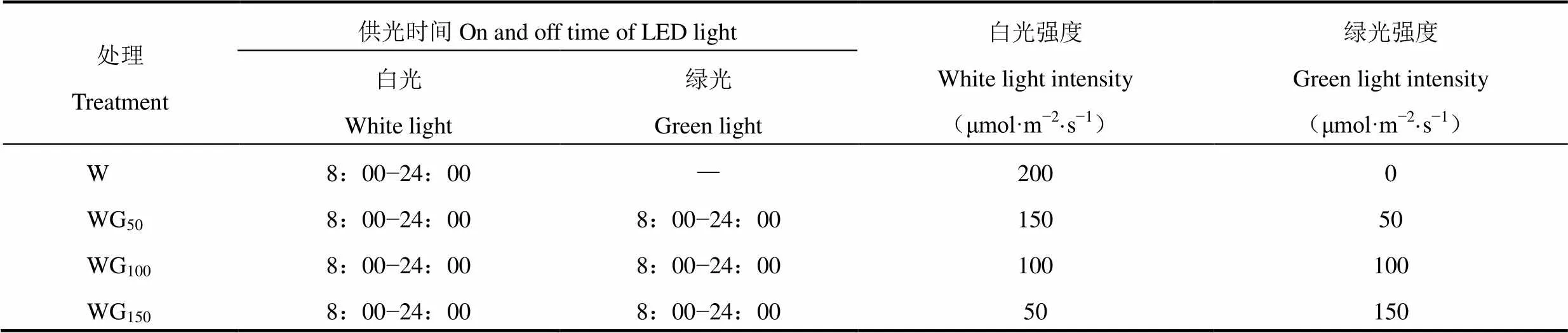
表1 各处理绿光强度的设置
1.4 数据统计与分析
采用Microsoft Excel 2016进行数据整理,采用SPSS 22.0进行显著性差异分析。
2 结果与分析
2.1 LED绿光处理对生菜物质积累的影响
由表2可见,绿光处理对植株株高、株幅以及叶片生长状况的影响不大,而对植株干物质积累的影响较大。表中显示,与白光处理相比,绿光处理均显著降低了生菜地上部鲜重,且在保持总光照强度(200μmol·m−2·s−1)不变的情况下,随着绿光强度的升高和白光强度的降低,生菜地上部鲜重逐渐降低;地下部鲜重的变化则不同,白光(W)处理下生菜地下部鲜重最小,WG50处理中地下部鲜重最大,且随着绿光强度的升高逐渐降低,但各绿光处理间差异不显著;然而生菜地上部干重则随着绿光强度的增加呈现先升高后降低的趋势,地上部干重在50μmol·m−2·s−1的绿光处理下达到最高,最高值较对照增加了3.7%,且该处理下生菜地上部的含水率在处理间最低,说明绿光对生菜植株体内的水分利用情况可能有一定的调节作用。进一步分析地上、地下部干重的变化可见,WG50处理中地上、地下部干物质质量均最大,但随着绿光强度的升高均逐渐降低,由此可见,白光(W)处理下植株地上部鲜重大、含水率高,但干物质的积累水平并不高,而一定强度的绿光促进生菜植株中干物质的积累,但绿光强度持续增加则会抑制干物质积累,降低生菜产量。
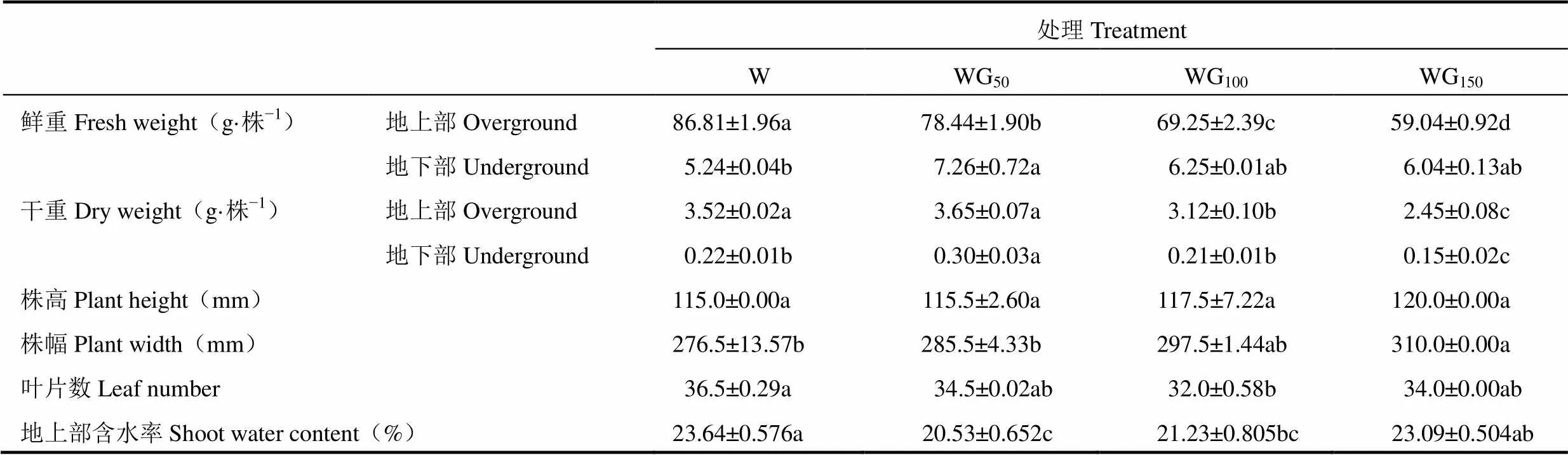
表2 不同光处理24d后生菜生长指标的比较(平均值±标准误,n=3)
注:同一行小写字母表示处理间在0.05水平上的差异显著性。下同。
Note:Lowercases in same line indicate the difference significance among treatments at 0.05 level. The same as below.
2.2 LED绿光处理对生菜叶片光合色素含量的影响
光合色素可以吸收、传递和转换光能,是植物进行光合作用的基础,其含量高低直接影响叶片的光合速率[33]。由表3可知,各绿光处理对生菜叶片中叶绿素及类胡萝卜素含量的影响较大,与对照相比,均显著提高了生菜叶片中叶绿素及类胡萝卜素含量(P<0.05),其中,叶绿素含量较对照提高35.76%~45.86%,类胡萝卜素含量提高28.57%~41.35%,二者均在WG150处理下达到最高,分别为0.881mg·g−1FW和0.188mg·g−1FW,说明绿光有助于光合色素在生菜叶片中的合成。
2.3 LED绿光处理对生菜营养品质的影响
2.3.1 碳水化合物
碳水化合物是光合作用的产物,其含量的高低能够反映同化源的强弱。由图2可见,绿光处理对生菜叶片中粗纤维、可溶性糖及淀粉的影响显著。如图2a所示,生菜叶片中粗纤维含量在白光(W)处理下最高,且在保持总光照强度(200μmol·m−2·s−1)不变的情况下,随着绿光强度的升高而降低,绿光处理下生菜叶片中粗纤维含量较对照分别降低2.69%、12.90%和14.67%,说明绿光抑制粗纤维在生菜叶片中的积累,且该抑制作用随着绿光强度的升高而增强。由图2b可知,生菜叶片中可溶性糖含量随着绿光强度的增加呈现先升高后降低的趋势,即在50μmol·m−2·s−1的绿光处理下生菜叶片中可溶性糖含量显著高于对照(P<0.05),较对照提高了5.74%,但随着绿光强度的继续增加,可溶性糖含量则显著降低,表明一定强度的绿光能够促进生菜叶片中可溶性糖的积累,但随着绿光强度的继续增加则会导致可溶性糖含量的降低。由图2c可知,白光(W)处理下生菜叶片中淀粉含量最高,而所有绿光处理均显著降低了生菜叶片中淀粉含量,降低幅度为5.34%~6.79%,表明绿光不利于淀粉在生菜叶片中的积累或同化物向淀粉的转化。
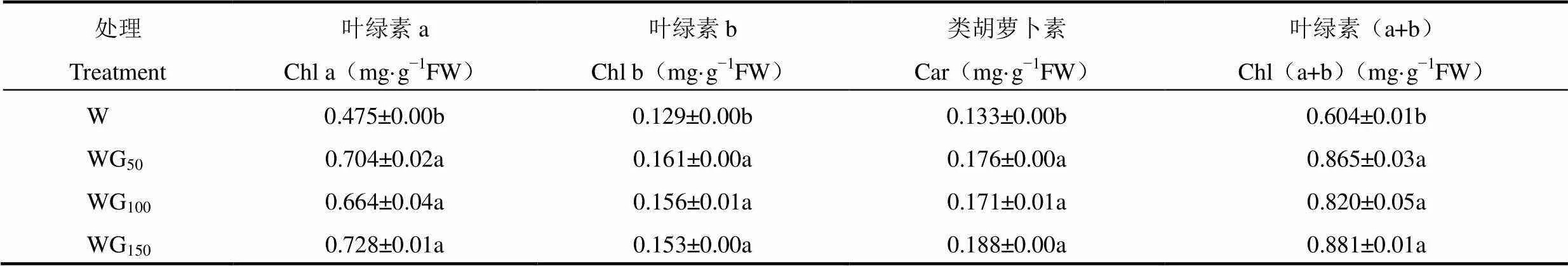
表3 不同光处理24d后生菜叶片中叶绿素和类胡萝卜素含量的比较(平均值±标准误,n=3)
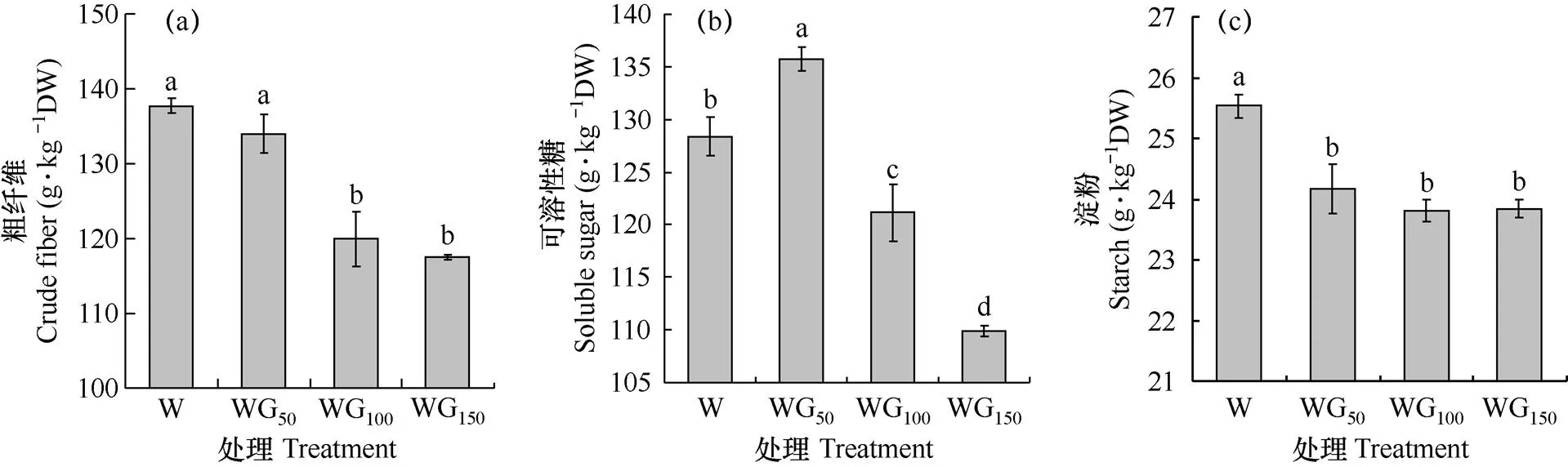
图2 不同光处理下生菜叶片中碳水化合物含量的比较
2.3.2 维生素C含量
由图3可知,绿光处理对生菜叶片中维生素C含量的影响较大,与白光(W)处理相比,随着绿光强度的增加,生菜叶片中维生素C含量呈现与可溶性糖相同的变化趋势,即随着绿光强度的增加,生菜叶片中维生素C含量呈先升高后降低的趋势,维生素C含量在WG50处理下达到最高,为371mg·kg−1,较对照增加30.4%。表明一定强度的绿光有利于促进生菜叶片中维生素C的合成和积累,但绿光强度过大则会抑制维生素C的合成。
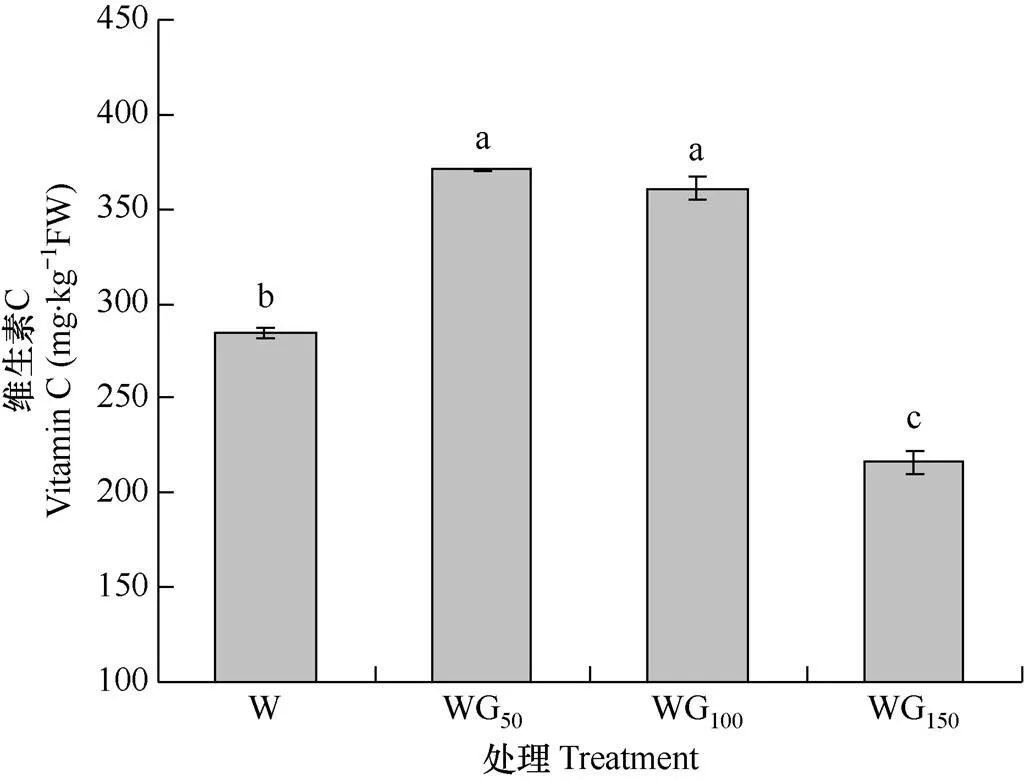
图3 不同光处理下生菜叶片中维生素C含量的比较
2.3.3 硝酸盐含量
由图4可知,与对照相比,不同强度的绿光处理均显著降低了生菜叶片中硝酸盐含量(P<0.05),降幅为4.06%~11.31%。在3个不同绿光强度的处理中,硝酸盐含量差异显著,表现为WG50 图4 不同光处理下生菜叶片中硝酸盐含量的比较 前人研究表明,绿光能更好地穿透植物冠层,增强下层叶片的光合作用,从而促进植物整体水平的生长。Kim等[25]研究了全光谱条件下绿光占比对生菜生长的影响,在总光照强度为150μmol·m−2·s−1的基础上,设置绿光占比分别为0、24%、51%和86%的4个处理,其结果表明绿光占比为24%的处理增强了生菜植株的生长,但随着绿光比例的增加生菜的生长受到抑制。本试验与之类似,在本试验中,设置了3种不同强度的绿光处理,结果显示,随着绿光强度的增加,生菜地上部鲜重呈下降趋势,表现为绿光强度越大鲜重下降也越快,说明绿光强度过大会抑制生菜的生长;同时,生菜植株地上部干重随着绿光强度的增加呈现先升高后降低的趋势,且WG150处理的干重显著低于W(白光)处理(P<0.05),表明一定强度(50μmol·m−2·s−1)的绿光对生菜中干物质的积累有促进作用。Folta等[20]研究发现,补充一定的绿光能降低生菜叶片中叶绿素的分解,促进生菜生长;赵飞等[21]研究发现,在红蓝组合光的基础上补充绿光能有效增加黄瓜叶片中的叶绿素含量,增强黄瓜的光合能力。本试验中,不同强度的绿光处理均显著增加了生菜叶片中叶绿素和类胡萝卜素的含量,具体的影响机制有待进一步研究。 可溶性糖和粗纤维是影响生菜口感的两个因素,一般认为,可溶性糖含量越高、粗纤维含量越低,生食性的生菜口感越甜、脆[13,34]。Chen等[14−15]的研究都表明补充绿光可以提高生菜叶片中可溶性糖的含量。本试验中,当绿光强度为50μmol·m−2·s−1时,可溶性糖含量最高,较对照提高了5.74%,但随着绿光强度的继续增加,可溶性糖含量则显著降低,说明一定光量的绿光能够促进生菜叶片中可溶性糖的积累,而过量的绿光则会对可溶性糖的积累造成抑制。绿光对生菜叶片中可溶性糖积累的促进作用可能是通过调控蔗糖代谢相关酶活性以及酶基因的表达实现的[11]。本试验中,绿光处理均不同程度降低了生菜叶片中粗纤维的含量,且在绿光的3个处理中,粗纤维含量随绿光强度的升高而降低。由此表明,一定量的绿光能够通过提高生菜叶片中可溶性糖的含量以及降低粗纤维的含量提升生菜的口感。本研究结果还显示,所有绿光处理均显著降低了生菜叶片中淀粉含量,表明绿光不利于淀粉在生菜叶片中的积累或同化物向淀粉的转化。 蒲高斌等[12]研究表明,绿光照射下番茄果实中维生素C含量最低,认为绿光对维生素C合成有一定的抑制作用。在本试验中,与白光对照相比,一定量的绿光(50μmol·m−2·s−1和100μmol·m−2·s−1)显著增加了生菜叶片中维生素C的含量,而当绿光强度为150μmol·m−2·s−1时,维生素C含量显著降低。可能由于一定量的绿光可以增强半乳糖酸内脂脱氢酶(GLDH)的活性,从而促进维生素C的合成,而150μmol·m−2·s−1的绿光处理下维生素C含量显著降低,可能是由于高强度的绿光降低了半乳糖酸内酯脱氢酶(GLDH)的活性所致。硝酸盐作为衡量生菜品质安全的重要指标,其含量受硝酸还原酶的影响。Samuolienė等[35]的研究表明,在日光温室中补充绿光能降低生菜叶片中硝酸盐的含量。本试验中得到相似的结果,生菜叶片中硝酸盐含量随着绿光强度的增加呈现先升高后降低的趋势,且在绿光强度为50μmol·m−2·s−1时,硝酸盐含量达到最低,各处理间差异显著,绿光对硝酸盐的作用可能是通过提高硝酸还原酶的活性实现的[36]。由此说明绿光可以通过降低硝酸盐含量从而提高生菜的品质。 本研究结果表明,一定强度的绿光能够提高生菜地上部干物质积累量,与此同时,绿光显著促进了生菜叶片中可溶性糖、维生素C的积累,以及硝酸盐的分解,从而提升了生菜的口感和品质。因此,实际生产中,绿光有潜力作为光环境优化的光因子之一,本研究结果可为作物供光策略优化和供光模型的建立提供一定的理论依据。 [1] 闻婧,鲍顺淑,杨其长,等.LED光源R/B对叶用莴苣生理性状及品质的影响[J].中国农业气象,2009,30(3):413-416.Wen J,Bao S S,Yang Q C,et al.Influence of R/B ratio in LED lighting on physiology and quality of lettuce[J].Chinese Journal of Agrometeorology,2009,30(3):413-416.(in Chinese) [2] 查凌雁,刘文科.不同光强下红蓝光配比对樱桃萝卜生长与产量的影响[J].中国农业气象,2018,39(3):162-167.Zha L Y,Liu W K.Effects of red/blue light ratio with different light intensity on growth and yield of cherry radish[J].Chinese Agricultural Science Bulletin,2018,39(3):162-167.(in Chinese) [3] Kozai T.Resource use emciency of closed plant production system with artificial light:concept,estimation and application to plant factory[J].Proceedings of the Japan Academy,Ser. B.,Physical and Biological Sciences,2013,89(10):447-461. [4] 马太光,陈晓丽,郭文忠,等.不同红外补光模式对植物工厂生菜生长及品质的影响[J].中国农业气象,2017,38(5):301-307.Ma T G,Chen X L,Guo W Z,et al.Effects of far-red light on the growth and qualities of lettuce in plant factory[J].Chinese Journal of Agrometeorology,2017,38(5):301-307.(in Chinese) [5] 刘文科,杨其长,邱志平,等.LED光质对豌豆苗生长、光合色素和营养品质的影响[J].中国农业气象,2012,33(4):500-504.Liu W K,Yang Q C,Qiu Z P,et al.Effect of LED light quality on growth, photosynthetic pigment and nutrient quality of pea seedlings[J].Chinese Journal of Agrometeorology,2012,33(4):500-504.(in Chinese) [6] 余意,刘文科.弱光条件下光质和光周期对水培生菜生长与品质的影响[J].中国农业气象,2015,36(6):739-745.Yu Y,Liu W K.Influence of light quality and photoperiod on growth and nutritional quality of three leaf-color lettuce cultivars under weak light[J].Chinese Journal of Agrometeo- rology,2015,36(6):739-745.(in Chinese) [7] 杨其长.LED在农业与生物产业的应用与前景展望[J].中国农业科技导报,2008,10(6):42-47.Yang Q C.Application and prospect of Light-Emitting Diode(LED) in agriculture and bio-industry[J].Journal of Agricultural Science and Technology,2008,10(6):42-47.(in Chinese) [8] 余意,杨其长,刘文科.LED红蓝光对三种蔬菜苗期生长和光合色素含量的影响[J].照明工程学报,2015,26(4):107-110.Yu Y,Yang Q C,Liu W K.Effects of LED red and blue light component on growth and photosynthetic pigment contents of two leaf-color lettuce cultivars[J].China Illuminating Engineering Journal,2015,26(4):107-110.(in Chinese) [9] Chen X L,Guo W Z,Xue X Z,et al.Growth and quality responses of ‘Green Oak Leaf’ lettuce as affected by monochromic or mixed radiation provided by fluorescent lamp(FL) and light-emitting diode(LED)[J].Scientia Horticu- lturae,2014,172(172):168-175. [10]闻婧.LED红蓝光波峰及RB对密闭植物工厂作物的影响[D].北京:中国农业科学院,2009.Wen J.Influence of wave crest and R/B of red and blue LED on crop growing in the closed plant factory[D].Beijing:Chinese Agricultural Sciences,2009.(in Chinese) [11]陈晓丽,杨其长,张馨,等.LED绿光补光模式对生菜生长及品质的影响[J].中国农业科学,2017,50(21):4170-4177.Chen X L,Yang Q C,Zhang X,et al.Effects of green LED light on the growth and quality of lettuce[J].Scientia Agricultura Sinica,2017,50(21):4170-4177.(in Chinese) [12]蒲高斌,刘世琦,刘磊,等.不同光质对番茄幼苗生长和生理特性的影响[J].园艺学报,2005,32(3):420-425.Pu G B,Liu S Q,Liu L,et al.Effects of different light qualities on growth and physiological characteristics of tomato seedlings[J].Acta Horticulturae Sinica,2005,32(3):420-425.(in Chinese) [13]Lin K H,Huang M Y,Huang W D,et al.The effects of red,blue,and white light-emitting diodes on the growth,development,and edible quality of hydroponically grown lettuce(,L.var.)[J].Scientia Horticult- urae,2013,150(2):86-91. [14]Chen X L,Xue X Z,Guo W Z,et al.Growth and nutritional properties of lettuce affected by mixed irradiation of white and supplemental light provided by light-emitting diode[J].Scientia Horticulturae,2016,200:111-118. [15]伍洁.光质配比对生菜生长、品质及养分吸收的影响[D].广州:华南农业大学,2016.Wu J.Effects of light quality on the growth,quality and nutrient absorption of lettuce[D].Guangzhou:South China Agricultural University,2016.(in Chinese) [16]Son K H,Oh M M.Growth,photosynthetic and antioxidant parameters of two lettuce cultivars as affected by red,green,and blue light-emitting diodes[J].Horticulture Environment & Biotechnology,2015,56(5):639-653. [17]Talbott L D,Zhu J,Han S W,et al.Phytochrome and blue light-mediated stomatal opening in the orchid,paphiope- dilum[J].Plant & Cell Physiology,2002,43(6):639-646. [18]Folta K M.Green Light stimulates early stem elongation,antagonizing light-mediated growth inhibition[J].Plant Phys- iology,2004,135(3):1407-1416. [19]Bouly J P,Schleicher E,Dionisiosese M,et al.Cryptochrome blue light photoreceptors are activated through interconv- ersion of flavin redox states[J].Journal of Biophysics,2007,282(13):9383-9391. [20]Folta K M,Maruhnich S.Green light:a signal to slow down or stop[J].Journal of Experimental Botany,2007,58(12):3099-3111. [21]赵飞,高志奎.光质对黄瓜幼苗绿色叶片叶绿素荧光的影响[J].中国农学通报,2011,27(10):161-167.Zhao F,Gao Z K.Chlorophyll fluorescence of green leaves by light quality in white cucumber seeding[J].Chinese Agricultural Science Bulletin,2011,27(10):161-167.(in Chinese) [22]Klein R M.Effects of green light on biological systems[J].Biological Reviews of the Cambridge Philosophical Society,1992,67(2):199-284. [23]Nishio J N.Why are higher plants green:evolution of the higher plant photosynthetic pigment complement[J].Plant Cell & Environment,2000,23(6):539-548. [24]Johkan M,Shoji K,Goto F,et al.Effect of green light wavelength and intensity on photomorphogenesis and photosynthesis in[J].Environmental & Exper- imental Botany,2012,75(75):128-133. [25]Kim H H,Goins G D,Wheeler R M,et al.Green-light supplementation for enhanced lettuce growth under red- and blue-light-emitting diodes[J].Hortscience a Publication of the American Society for Horticultural Science,2004,39(7):1617-1622. [26]Kim H,Goins G D,Wheeler R M,et al.Stomatal conductance of lettuce grown under or exposed to different light qualities[J].Annals of Botany,2004,94(5):691-697. [27]Chen X L,Yang Q C.Effects of intermittent light exposure with red and blue light emitting diodes on growth and carbohydrate accumulation of lettuce[J].Scientia Horticul- turae,2018,234:220-226. [28]Chen X L,Yang Q C,Song W P,et al.Growth and nutritional properties of lettuce affected by different alternating intervals of red and blue LED irradiation[J].Scientia Horti- culturae,2017,223:44-52. [29]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.Gao J F.Plant physiology experimental guidance[M].Beijing:Higher Education Press,2006.(in Chinese) [30]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.Wang X K.Principles and techniques of plant physiological and biochemical experiments[M].Beijing:Higher Education Press,2006.(in Chinese) [31]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.Li H S.Principles and techniques of plant physiological and biochemical experiments[M].Beijing:Higher Education Press,2000.(in Chinese) [32]张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2010.Zhang Z L,Qu W J.Plant physiology experimental guidance[M].Beijing:Higher Education Press,2010.(in Chinese) [33]郑洁,胡美君,郭延平.光质对植物光合作用的调控及其机理[J].应用生态学报,2008,19(7):1619-1624.Zheng J,Hu M J,Guo Y P.Regulation of photosynthesis by light quality and its mechanism in plants[J].Chinese Journal of Applied Ecology,2008,19(7):1619-1624.(in Chinese) [34]Fillion L,Kilcast D.Consumer perception of crispness and crunchiness in fruits and vegetables[J].Food Quality & Preference,2002,13(1):23-29. [35]Samuolienė G,Sirtautas R,Brazaitytė A,et al.LED lighting and seasonality effects antioxidant properties of baby leaf lettuce[J].Food Chemistry,2012,134(3):1494-1499. [36]Sun J,Nishio J N,Vogelmann T C.Green light drives CO2 fixation deep within leaves[J].Plant & Cell Physiology,1998,39(10):1020-1026. Effects of LED Green Light on Growth and Quality of Lettuce WANG Xiao-jing1, 2, CHEN Xiao-li2, GUO Wen-zhong2, LI Hai-ping1, LI Ling-zhi1 (1.College of Horticulture, Shanxi Agricultural University, Taigu 030801, China; 2.Beijing Research Center of Intelligent Equipment for Agriculture, Beijing 100097) The experiment was conducted in a closed plant factory with artificial light. Lettuce (L) hydroponically cultured was used as materials, and the light intensity and quality were both adjustable. White light provided at 8:00−24:00 with light intensity of 200μmol·m−2·s−1was regarded as control (W), and green light with light intensity of 50 (WG50), 100 (WG100) and 150μmol·m−2·s−1(WG150) was respectively used instead of equal white light. Lettuce biomass, morphology, leaf number, and the contents of chlorophyll, nitrate nitrogen, vitamin C, soluble sugar, crude fiber and starch were determined, to investigate the effects of green light on the growth and quality of lettuce and explore better supply modes for green light. The results showed that: (1)the WG50treatment significantly increased the chlorophyll content in lettuce shoot and also enhanced the dry weight of lettuce shoot by 3.69% compared with the control. (2) With the increase of green light and the decrease of basic white light, the soluble sugar and vitamin C contents in lettuce shoot rose first and then declined. The highest and lowest content of both the two indices were respectively detected under WG50and WG150treatment, the differences in comparison of the control reaching significant level (P<0.05). (3) Compared with the control, all the treatments with green light reduced the contents of starch, crude fiber and nitrate in lettuce leaves. The lowest nitrate content was observed in lettuce treated with WG50. In summary, green light with the intensity of 50μmol·m−2·s−1might promote the accumulation of dry matter in lettuce and improve the quality of lettuce. Plant factory; LED; Green light; White light; Lettuce 10.3969/j.issn.1000-6362.2019.01.003 收稿日期:2018−07−02 通讯作者。E-mail:lilz008@hotmail.com 北京市自然科学基金项目(6174041);国家重点研发计划(2017YFD0201503) 王晓晶(1993−),女,硕士生,研究方向为蔬菜栽培与生理。E-mail:wangxj0229@163.com 王晓晶,陈晓丽,郭文忠,等.LED绿光对生菜生长和品质的影响[J].中国农业气象,2019,40(1):25−32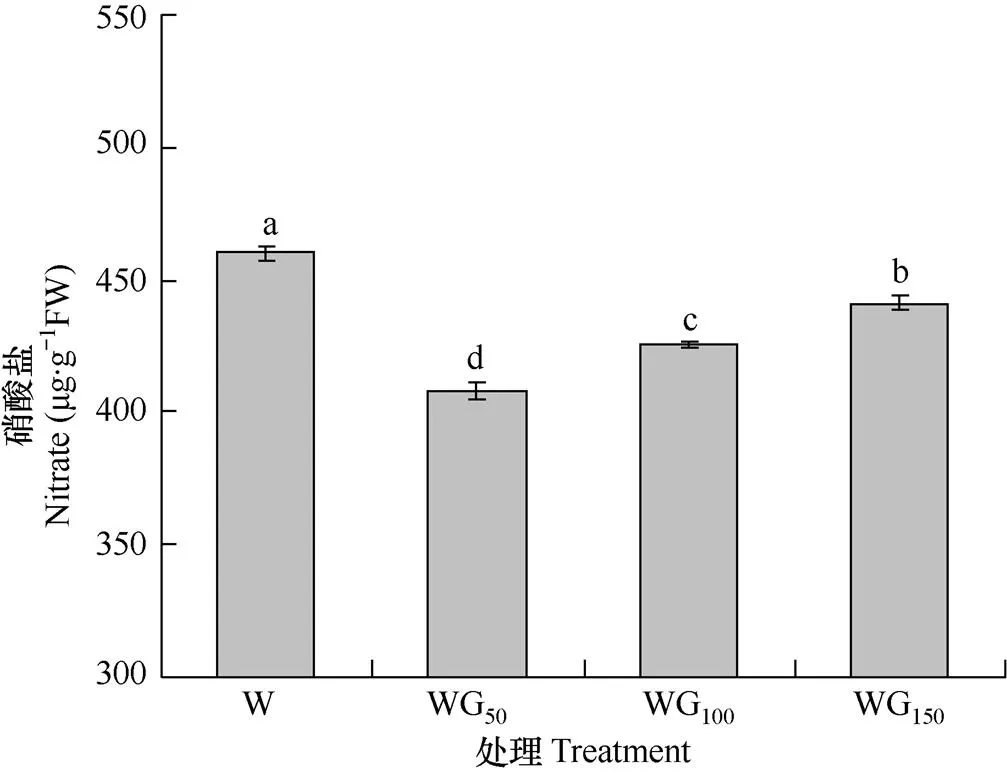
3 结论与讨论

