2018年上半年医疗器械召回情况探讨
张倩,冯靖祎,吕颖莹,孙静,叶秋萍
浙江大学医学院附属第一医院 医学工程与物资部,浙江 杭州 310003
引言
2017年1月25日,国家食品药品监督管理总局局务会议审议通过了《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号,以下简称《办法》),定于2017年5月1日起施行,同时废止《医疗器械召回管理办法(试行)》 (中华人民共和国卫生部令第82号)[1]。《办法》 的出台,标志着我国对医疗器械的管理愈发严格细致,更为注重医疗器械的安全预防与风险监测。对医疗器械进行召回管理,能够进一步加强医疗器械的安全使用监督,完善医疗器械使用保障,从而促进医疗器械安全隐患的消除,保障人体健康和生命安全。同时,其发布也是我国医疗器械行业发展迅速、法律法规日益完善的表现之一。但目前,我国不论是医疗机构还是医疗器械生产/代理企业都对召回方面的关注略有欠缺。本文对2018年上半年国家食品药品监督管理总局发布的医疗器械召回事件进行了种类、召回原因、召回等级等多方面进行了统计,并对得到的结果进行了分析讨论。以期通过本文,一方面提高医疗器械行业相关人员对医疗器械召回的重视;另一方面通过对比国内外医疗器械召回情况,挖掘我国医疗器械行业在服务及负责态度方面与外企的差距,并提出建议。
1 医疗器械召回的定义与分类
《办法》中明确了医疗器械召回的定义,即指医疗器械生产企业按照规定的程序对其已上市销售的某一类别、型号或批次的存在缺陷的医疗器械产品,采取警示、检查、修理、重新标签、修改并完善说明书、软件更新、替换、收回、销毁等方式进行处理的行为[1]。其中,存在缺陷的医疗器械产品包括:① 正常使用情况下存在可能危及人体健康和生命安全的不合理风险的产品;② 不符合强制性标准、经注册或者备案的产品技术要求的产品;③ 不符合医疗器械生产、经营质量管理有关规定导致可能存在不合理风险的产品;④ 其他需要召回的产品。
医疗器械召回事件根据医疗器械缺陷的严重程度主要可分为三个等级,分别为一级召回、二级召回和三级召回。其中,使用该医疗器械可能或者已经引起严重健康危害的事件应归属于一级召回事件;使用该医疗器械可能或者已经引起暂时的或者可逆的健康危害的属于二级召回事件;使用该医疗器械引起危害的可能性较小但仍需要召回的则属于三级召回事件。医疗器械召回事件的级别是医疗器械召回计划拟定的重要依据,也是医疗器械召回时常用的统计分类方法。此外,其他统计分类的方法还包括根据医疗器械种类划分、根据医疗器械生产地划分等。
2 统计方法
在国家食品药品监督管理总局(CFDA)网站[2]上检索2018年1月1日至2018年6月30日间发布的召回事件信息,并对收集到的数据进行人工比对去重,保留信息完整的本年度第一次发布记录。随后,将关键信息整理成表格,模板如表1所示。可以看到,本文选取的关键信息主要有:召回等级、召回原因、召回月份、召回种类(指医疗器械种类)、国产/进口等。其中,召回月份选取的是本年度第一次发布时的月份,以排除事件重复公布的干扰。

表1 召回事件统计表模板(2018.1.1~2018.6.30)
3 结果及讨论
2018年上半年CFDA官网上共发布医疗器械召回事件446条,去重后统计数量为248条,与2017年同期召回情况相比略有上升。下面将根据统计分析方法中涉及的各项对上半年的医疗器械召回情况分别进行分析说明。
3.1 医疗器械召回等级分析
上半年医疗器械一级召回5起,占总召回数量的2%;二级召回58起,占总召回数量的23%(图1)。与2017年全年一级召回8起[3]相比,2018年医疗器械重要召回事件呈上升趋势,可能引起健康危害甚至严重健康危害的事件在半年内发布高达63件。这固然有国家加大医疗器械监督管理的客观因素在,同时也表明了加强医疗器械生产质量监督及医疗器械全生命周期风险管理的必要性。
3.2 根据召回时间统计分析
从召回时间看,召回事件1月份发布最多,高达96起,其他月份均不到其一半(图2)。究其原因,一是因为有一些去年年底提交但未来得及发布的召回事件在年初发布;二是因为我国从去年年底开始逐渐加强了医疗器械飞行检查、监督检查的力度,陆续开展了几次国家医疗器械质量监督抽检行动[3]。行动初期发现的问题较多,尤其是国产医疗器械暴露了很多问题。而后,各企业加强了相关问题的自查自纠,因而问题减少。这种情况表现在时间上即可看到,召回事件数量前期偏高,但后期有所下降,呈稳定趋势。这表明了医疗器械的飞行检查、监督检查力度加强的必要性。
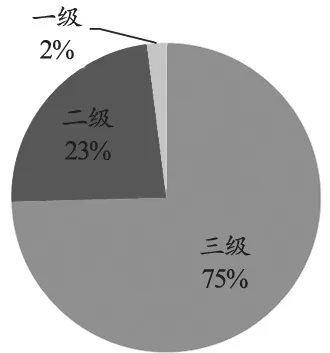
图1 2018年上半年医疗器械召回事件按召回等级统计
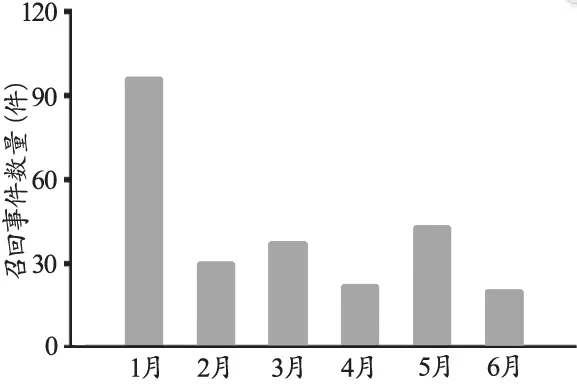
图2 2018年上半年医疗器械每月召回事件统计
3.3 根据召回原因统计分析
医疗器械召回的原因五花八门,本文为了统计方便,将其简要分为质量及设计问题(包括精度不准、原材料质量不好、强度达不到要求等)、标识及说明书问题(包括标签有误、注册证号未更新、说明书增补等)、软件问题(包括软件升级后造成设备不兼容、特定设备软件更新导致准确度下降等)及其他(包括使用错误警示、固件升级客户通知、维修风险客户通知、部分地区注册取消等)四类,以与医疗器械召回的处理方式如警示、检查、修理、重新标签、修改并完善说明书、软件更新等相对应。如图3所示,可以看到,超过一半的医疗器械召回事件都是由质量及设计问题引起的,这直接验证了国家加强医疗器械质量监督管理的正确性。此外,标识及说明不规范、信息有误等问题也是频发问题,尽管很多情况下并不影响用户使用,但是标识及说明书问题对医疗器械的规范化管理影响深远,需要各医疗器械生产企业提高重视。目前涉及的医疗器械软件问题大多为设备配套使用的软件,其很大程度上决定了设备检测结果的准确性,同时会对设备的部分功能产生影响。因此,对软件的及时升级、修正也越来越频繁地出现在医疗器械召回事件中。
3.4 根据召回的医疗器械种类统计分析
为了统计方便,本文将召回的医疗器械种类简单划分为医疗设备召回、试剂耗材召回及其他医疗器械召回三类。其中,医疗设备包括了配套使用的软件;试剂耗材包括试剂与医用耗材;其他医疗器械指常用的手术器械、质控品等。对上述医疗器械召回事件进行召回种类的统计分析,结果如图4所示。其中,医疗设备召回143起,占58%;试剂耗材召回96起,占39%。结合其召回原因分析,本年度医疗设备召回事件频发,标识有误及软件升级为主要原因。但由于医疗设备不像医用耗材出现故障可以快速找到代替物,医疗设备,尤其是大型医疗设备,一旦出现故障或增加潜在风险,不仅会对引起治疗过程的暂停或中止,造成患者及医疗机构时间、精力、费用上的浪费,甚至可能造成医疗机构部分诊疗项目瘫痪,更有甚者会瞬时造成十分恶劣的医疗事故。因此,临床工程师不仅要日常及时关注各种医疗器械,尤其是医疗设备的召回信息,还要合理安排设备维护及日常保养,同时为操作人员做好培训,尽最大可能避免可能的使用风险。
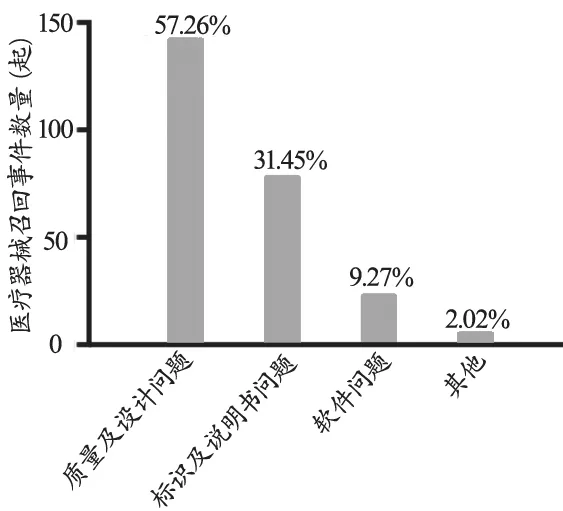
图3 2018年上半年医疗器械召回事件按召回原因统计
3.5 根据产品生产地统计分析
根据产品产地的不同(国产/进口)对上半年医疗器械召回事件进行分析,发现国产产品召回66起,占27%;进口产品召回182起,占73%(图5)。
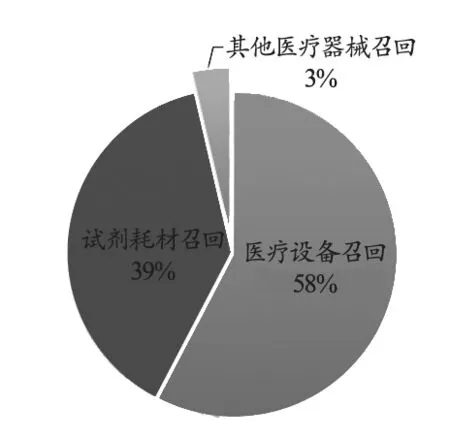
图4 2018年上半年医疗器械召回事件按医疗器械种类统计
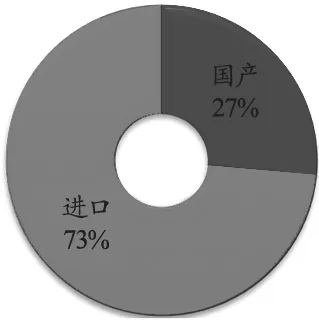
图5 2018年上半年医疗器械召回事件按医疗器械生产地统计
总体而言,国产企业对医疗器械的召回发布偏低。这里体现了国产厂商的一个思维误区:很多国产厂商觉得发布召回事件会对企业的品牌形象产生巨大影响,因此不愿发布召回信息。实际上,召回不单单是指将产品从市场上撤回,而是包含了维护保养注意事项、检测结果准确性判断、客户投诉应对等很多内容。同时,对于成熟的市场而言,召回更像是售后服务的一部分,市场越成熟,越应有强烈的召回意识,这样才会推动企业在产品技术及安全性能上持续改进。这也从侧面体现了国产医疗器械与进口医疗器械在售后服务方面存在的差距——进口产品将召回当做客户投诉的积极处理方式之一,避免其他客户遇到类似情况,达到及时止损的目的,可以减少潜在损失,在可容忍范围内不仅不会影响品牌口碑,反而有促进作用[4]。当然,涉及到真正的大批量产品回收销毁的召回事件,还是会对企业的口碑产生巨大影响,并会让企业产生巨大损失,这是目前大多数国产医疗器械厂商承受不住的,也是国产医疗器械企业不愿发布召回的原因之一。
4 总结与展望
召回事件是不良事件报告的延续性工作,是医疗器械上市后监管的重要措施,能显著消除或减少缺陷医疗器械的风险和危害,以保证医疗安全[5-6]。对召回事件密切关注并进行阶段性分析,可以帮助加强医疗器械上市后监管,提高技术监督支撑能力,保障医疗器械的安全使用[7-8]。本文通过对2018年上半年CFDA公布的医疗器械召回事件从召回等级、召回时间、召回原因、医械种类及国产/进口等方面进行分类统计,初步展示了我国医疗器械召回的阶段性情况。统计结果主要反映了三方面内容。
(1)从召回数量、召回时间、召回原因等方面来看,国家层面对医疗器械生产及使用的监督管理力度日益增强——这是有据可循的。自2015年发布《医疗器械使用质量监督管理办法》(国家食品药品监督管理总局令第18号)[9]到2017年《办法》出台,我国加大了对医疗机构在用医疗器械质量安全的检查力度,同时落实了使用单位的主体责任,以提高医疗器械使用质量的管理水平。《中国医疗器械行业发展报告(2018)》(医疗器械蓝皮书)[3]预测,我国政策合规管控的力度将进一步加大,飞行检查力度持续加大,打击垄断、行政干预、商业贿赂政策持续发力,最终实现行业环境的改善。
(2)国产企业对医疗器械召回的重视度也在逐步增加,但是与外企相比还存在差距。尤其在规范化管理、医疗器械风险管理及医疗器械召回意识方面,本次统计结果反映出的问题很多。如,国产医疗器械标识及说明问题多,表现出国产医疗器械规范化管理不到位。国产召回事件仅占总召回数量的四分之一左右,除了进口产品数量多等客观因素外,也是国产企业对召回的理解不到位,不能把医疗器械召回作为良好售后服务的一部分,不愿承担相应责任义务所致。医疗器械召回作为医疗器械企业对自身产品改进、改正、质量及服务提升的措施之一,是企业愿意主动承担责任,对患者、医师、技师甚至临床工程师的安全负责的一种体现[10-11],建议国产企业在该方面尽早扭转思路,提高召回意识,进一步完善自身的售后服务和召回管理,才能进一步增强使用者对国产品牌的信心。
(3)医疗机构的工程师目前对待医疗器械召回事件还是被动接受企业联系的方式。但根据以往工作经验,虽然绝大部分企业会在CFDA发布前就联系召回产品所涉及的医疗机构开展召回处理,但还是有部分企业连医疗器械召回信息在哪里获取都不了解,这就要求医疗机构作为使用单位,提高自己的主体责任意识,及时跟踪医疗器械召回信息,并主动与相关企业联系,第一时间对相应问题进行处理解决,避免因处理不及时而产生的风险,进一步增强自身对医疗器械的使用监督管理能力。
总体来讲,医疗器械的质量监督管理及风险管理还需进一步增强,这需要国家层面、各层级医疗机构及医疗器械生产企业的共同努力,一起为保障医疗服务质量、推动国产医疗器械行业进步而奋斗。

