霸王岭自然保护区黑桫椤种群结构特征分析
谢春平,赵柏松,刘大伟,方 彦
(1.南京森林警察学院刑事科学技术学院,南京 210023;2.海南省森林资源司法鉴定中心,海口 570203)
关键字:黑桫椤;种群;生命表;霸王岭自然保护区
种群是进化的基本单位,它不仅是一定地质时期和地理空间内分布个体的集合[1],更是具有自己独特的性质结构。种群内的个体间与环境间有密切的关系,它具有自动调节能力,以适应环境在空间上和时间上的变化[2]。因此,通过对种群年龄结构及数量动态的分析可以掌握种群的现状及预测其发展趋势,为种群的管理提供科学参考依据。对于木本植物尤其是濒危物种年龄结构的划分,大多数学者采用径级结构或者高度级结构代替时间顺序关系;通过年龄结构的分布格局反映种群内不同大小个体数量的分布和配置状况,从而体现种群动态及其发展与演变趋势[3]。构建生命表是了解种群结构特征的另一重要途径。生命表不仅可以了解种群的现状及与环境的适应性,还可推测种群过去结构和可能历史干扰,从而能够预测种群未来发展趋势及在特定条件下生存与繁衍的可能性[4]。因此,对珍稀濒危植物种群年龄结构及生命表的研究可客观地揭示种群现状、发展趋势、与环境的适应性等多个方面,为种群保护及恢复措施的制定提供科学依据[5]。
树蕨类(tree fern)因具有树干的特征而与其他蕨类植物明显区别,成为热带和亚热带森林生态系统中重要的树种之一,其中以桫椤科(Cyatheaceae)植物为典型代表。木本蕨类植物是中生代古老孑遗物种,见证了地球的历史变迁[6],作为古地质气候、古环境的演变、古植被演化和蕨类植物系统发育等的研究材料具有重要意义[7-8];此外,它们同时也具有较高的经济利用价值[9]及对森林生物多样性有重要的影响[10]。因此,该类植物已引起了国内外学者的广泛关注。M.M.Silva等对巴西大西洋森林特有种濒危树蕨(Cyathea praecincta(Kunze)Domin)的种群研究中指出,应对其现有的生境进行保护,并通过减少过度采伐森林等行为来降低其局部灭绝的风险[11]。T.Nagano等研究日本屋久岛的桫椤(Cyathea spinulosa Wall)种群结构表明,桫椤具有先锋树种的特征,其较喜分布于路边、溪边、沟谷等开阔地带,因此在人工针叶林中适当地梳理林下灌木有利于该种群的发展[12];这一情况也同样在斐济分布的树蕨种群中有所体现[13]。C.Pattanaik等对印度东高止山脉特有濒危桫椤(Cyathea nilgirensis Holttum)调查后发现该物种仅分布于印度南部的高海拔山区,当前正遭受人类毁灭性的干扰,急需进行保护[14]。R.H.G.Ranil等对斯里兰卡9种树蕨的多样性及分布特征的研究结果表明,岛内树蕨分布范围小、种群数量少,同时遭受着栖息地被非法破坏、生境破碎化和退化、土壤侵蚀、环境污染等外来因素的干扰[15]。我国学者在树蕨方面的研究主要集中对桫椤的研究,如群落学特征[6]、地理分布[7]、种群结构[8,16]、种群分布格局[17]、种群更新[16]等方面。这些研究均对树蕨的种群现状及影响其生存的主要因素进行了分析。结果表明由于受全球气候变暖、生境破坏、森林采伐等外界干扰因素的影响,多数树蕨种群均受到了一定程度的影响。因此加大对此类植物的研究及提出相应的保护策略已显得十分重要。
黑桫椤(Alsophila podophylla Hook.)主要分布在我国华南和西南(云南)地区,同时日本南部、越南、老挝、泰国及柬埔寨也有分布。虽然该种已被列为国家II级重点保护植物,但对其仍缺乏较为系统全面的研究。海南岛的山地热带雨林为黑桫椤的生长提供了良好的环境,但近年来受农业种植和经济林开发等人为干扰的影响,迫使其呈零星状分布于公路两旁、靠近河溪的农田、弃耕地、橡胶林和槟榔林林缘等生境条件退化区域[7];种群数量有减少和衰退的迹象。种群结构特征和数量动态的研究是保护和恢复黑桫椤的基础工作之一,也是相关部门保护和管理该物种的重要科学参考依据。基于此,本文以海南霸王岭国家级自然保护区分布的黑桫椤种群为研究对象,通过对种群年龄结构特征、静态生命表、种群稳定性等的分析,拟解决2个科学问题:(1)研究区内的黑桫椤的种群现状如何,(2)该种群的发展动态及趋势。最后,旨在为该物种的种群恢复策略、种群更新、资源保护等方面提供科学依据。
1 材料和方法
1.1 研究地概况
海南霸王岭国家级自然保护区位于海南岛西南部山区,地理坐标为 18°57'~19°11'N,109°03~109°17'E,总面积 29 980 hm2,核心区面积为 10 540 hm2,缓冲区面积为8 910 hm2,实验区面积为10 530 hm2,属热带季风气候,年均温度 23.6℃,年均降水量1 500~2 000 mm。林区主要山峰的海拔均在1 000 m以上,从山麓到山顶,依次分布着热带低山雨林、沟谷雨林、山地雨林、山地常绿林和山顶苔藓矮林[18]。区域土壤以砖红壤为代表,并随海拔增加逐渐过渡为山地红壤、山地黄壤和山地草甸土等。该区域是海南热带雨林的典型代表,植物种类繁多,有维管束植物220科967属2 213种,其中:包括蕨类植物36科73属131种,裸子植物5科8属13种,被子植物179科886属2 069种[19]。
在黑桫椤存在的群落中,乔木层主要有陆均松(Dacrydium pectinatum)、油丹(Alseodaphne hainanensis)、黄叶树(Xanthophyllum hainanense)、海南韶子(Nephelium topengii)、线枝蒲桃(Syzygium araiocladum)、显脉杜英(Elaeocarpus dubius)、白颜树(Gironniera subaequalis)等。灌木层主要有鱼骨木(Canthium dicoccum)、丛花山矾(Symplocos poilanei)、凸脉冬青(Ilex kobuskiana)、银柴(Aporusa dioica)等。草本层主要有卷柏(Selaginella tamariscina)、黄细心(Boerhavia diffusa)、长叶茅膏菜(Drosera indica)、草豆蔻(Alpinia katsumadai)等。
1.2 样方设置与数据收集
于2017年秋季在海南省霸王岭国家级自然保护区黑桫椤分布的典型群落内设置3个20 m×20 m的样方。对样方内出现的黑桫椤进行每木测量,包括株高、茎粗、冠幅、长势等;对群落内出现的乔木、灌木和草本植物进行记录;对所调查的群落进行环境因子记录,包括海拔、坡向、坡度、郁闭度等。
1.3 分析方法
①种群结构划分。与其他多年生木本植物相比,木本蕨类植物随着生长年限的增加在径级方向的变化几乎处于恒定状态[16],故不能使用胸径代替年龄的方法来对黑桫椤进行年龄结构的划分。与之相似的植物如棕榈类(Phoenix reclinata、Hyphaene coriacea)[20]、苏铁泽米类(Ceratozamia zaragozae、Cycas armstrongii、Dioon purpusii)[21-22]等多采用高度级、叶片长度或叶子生长状况等结构特征替代。结合本研究的实际情况,参考M.M.Silva等[11]和T.Nagano等[12]的方法,利用高度级结构(height)替代年龄级结构来分析种群的年龄结构特征。将黑桫椤植株的高度划分为8个等级,即Ⅰ级为幼苗,叶仅露出地面但并未展开;Ⅱ为幼树:个体高度不大于10 cm,叶子已全部或部分展开;Ⅲ级:10.1~30 cm;此后每 30 cm 划分为一个径级(30.1~60 cm,60.1~90 cm,90.1~120 cm,120.1~150 cm,150.1~200 cm),当 H>200 cm时归入径级Ⅸ。归纳统计每个高度级的个体数,绘制种群年龄结构分布图。
②静态生命表编制。静态生命表通过简洁的数据信息可有效地对种群的生活史和生态过程进行观测,同时对种群规模、龄级动态等进行预测。一般而言,静态生命表中所包含了现存个体数a(0实际观测值),匀滑后的x龄级的存活数 ax,x龄级开始时标准化存活个体数lx([ax/a0)×1 000)],x到x+1龄级间隔期间内标准化死亡数d(xlx-lx+1),x到x+1龄级间隔期间死亡率qx([dx/lx)×100%],x到x+1龄级间隔期间还存活的个体数Lx([lx+lx+1)/2],x龄级到超过x龄级的个体总数T(x),x龄级个体的生命期望或平均期望寿命e(xTx/lx)以及各龄级组致死力K(xlnlxlnlx+1)等若干指标。上述各指标的计算参考金慧等[4]的方法。由于静态生命表所反映的是多个世代重叠的年龄动态历程的一个特定时间[23],因此其编制过程所需的3个理想化假设无法成立[24],因此参考解婷婷[25]的方法对数据进行匀滑处理。
③种群稳定性及动态量化分析。根据各龄级个体数的变化,利用辛普森优势度指数(Simpson index of dominance,S)进行种群稳定性分析[26];同时结合种群年龄结构动态变化指数(Vpi)和未来外部干扰情况下种群的年龄结构变化指数(V'pi)对种群的动态进行量化分析[27]。
2 结果与分析
2.1 种群年龄结构特征
根据黑桫椤植株高度的划分,3个样方的整体种群结构如图1所示。霸王岭黑桫椤种群年龄结构总体上呈现出金字塔型,即Ⅰ和Ⅱ龄级的种群数量占比是各龄级中最多的,分别达到了32.76%和22.55%,这两个龄级的个体数已超过了整体种群数量的50%。在从低龄级向中龄级过度的过程中,龄级Ⅲ~Ⅴ存在一定数量的波动。种群发展至高龄级个体数占比逐渐趋少,而样方B和样方C均存在高龄级个体缺失的现象,仅样方A有超过2 m高的黑桫椤。但整体上,各样方的年龄结构特征均表现出随着高度级的增加个体数逐渐减少的趋势。同时,从具体的各个样方单独的数据可以反映出,样方A的种群结构发育较为完整和存在较长的时间,而样方B和样方C种群的起源时间要短于样方A;出现这种现象与其所处生境有较大的关系。样方A在沟谷内,环境阴湿且上层空间开阔,故其能够存在一定高大的植株;样方B在旅游栈道边上的斜坡,一方面由于栈道的存在使其会受到一定的人为干扰,另一方面坡度也会导致土壤、水分等环境因子要明显不如其他样方;样方C在山脊上,光照较为充足,但水分和土壤条件要比前两个样方差;但综合来看,该区域的黑桫椤种群整体结构稳定,为增长种群。
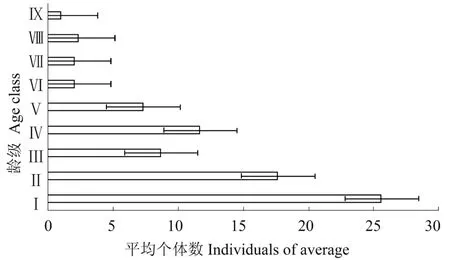
图1 霸王岭自然保护区黑桫椤种群年龄结构Figure 1 Age structure of A.podophylla population in Bawangling Mountain Nature Reserve
2.2 静态生命表
静态生命表无法体现出某一种群的全部生活史,它所体现的是特定时间内多个世代重叠、年龄动态的过程;因此系统误差、死亡率为负的情况在静态生命表中是不可避免的[28]。但负值存在仍能够说明种群并非出于静态,而是增长或衰退中,仍具有生物学意义[27]。经匀滑修正后得出的黑桫椤静态生命表如表1所示。从标准化处理的存活个体数lx数值发现,霸王岭黑桫椤各龄级个体数的分布情况与绝大多数长命木本植物相似,即随着龄级的增加个体数逐渐减少。由于匀滑处理会掩盖种群数量波动中的某些生态现象[29],但结合各龄级的a0数据的结果也基本与匀滑后的数据趋势相一致。死亡率qx和致死率Kx的最大值均出现在龄级Ⅰ向Ⅱ过渡时,但与其他龄级的相比较仍不是很明显。低龄级较低的死亡率和致死率保证了有一定数量的更新苗进入到种群的下一发展阶段,使得种群得以延续发展。此外,从平均期望寿命ex来看,Ⅰ、Ⅱ、Ⅲ龄级值均大于3.00,说明种群在低龄级时波动不大。此外,从小环境看,样方A较其他样方好,沟谷的生境(郁闭度高、潮湿、干扰小、土壤肥沃等)为黑桫椤的繁殖提供了良好的环境;而样方B和样方C分别处于斜坡和山脊,其条件要远不如样方A。因此,在后续对该区域黑桫椤管理时不仅要从保护区的整体上关注种群的发展,更应重点考虑小环境对种群的影响。
2.3 存活曲线
以高度级相对应的龄级为横坐标,以标准化存活个体数lx为纵坐标,绘制出种群存活曲线(图2)。存活曲线是种群动态特征的具体表现,其走势所反映的生存率和死亡率是自然界长期选择的结果。从图2可知,整体种群在低龄级(I~Ⅲ)时有过半的个体数进入到下一龄级。因为3个样方的所处群落均为地带性顶级群落,多数乔木最低分枝在10 m以上,故林下层黑桫椤有足够的空间进行生长。因此,从存活曲线来看整体种群发展过程是相对平稳的。

图2 霸王岭自然保护区黑桫椤种群存活曲线Figure 2 Survival curve of A.podophylla population in Bawangling Mountain Nature Reserve
Deevey将存活曲线分为3种类型,即:Ⅰ型(a型)呈凸型,表示种群的大多数个体均能实现其平均的生理寿命,在达到平均寿命时,几乎同时死亡;Ⅱ型(b型)呈对角线型,表示各龄级死亡率相同;Ⅲ型(c型)呈凹型,表示幼体死亡率高,以后的死亡率低而稳定[30]。除了对存活曲线进行直观观察外,更多的是采取 J.M.Hett&O.L.Loucks[31]的数学模型进行检验,即Deevey-Ⅱ型存活曲线符合指数模型(Nx=N0e-bx)和Deevey-Ⅲ型存活曲线符合幂函数模型(Nx=N0x-b)。根据模型检验结果,霸王岭自然保护区黑桫椤存活曲线在两个数学模型中均为显著(P<0.01),但结合 R2结果显示指数函数模型(0.999)要优于幂函数模型(0.915)。因此,黑桫椤的存活曲线趋近于Deevey-Ⅱ型,这也与它们各龄级死亡率波动不大的结果相一致。
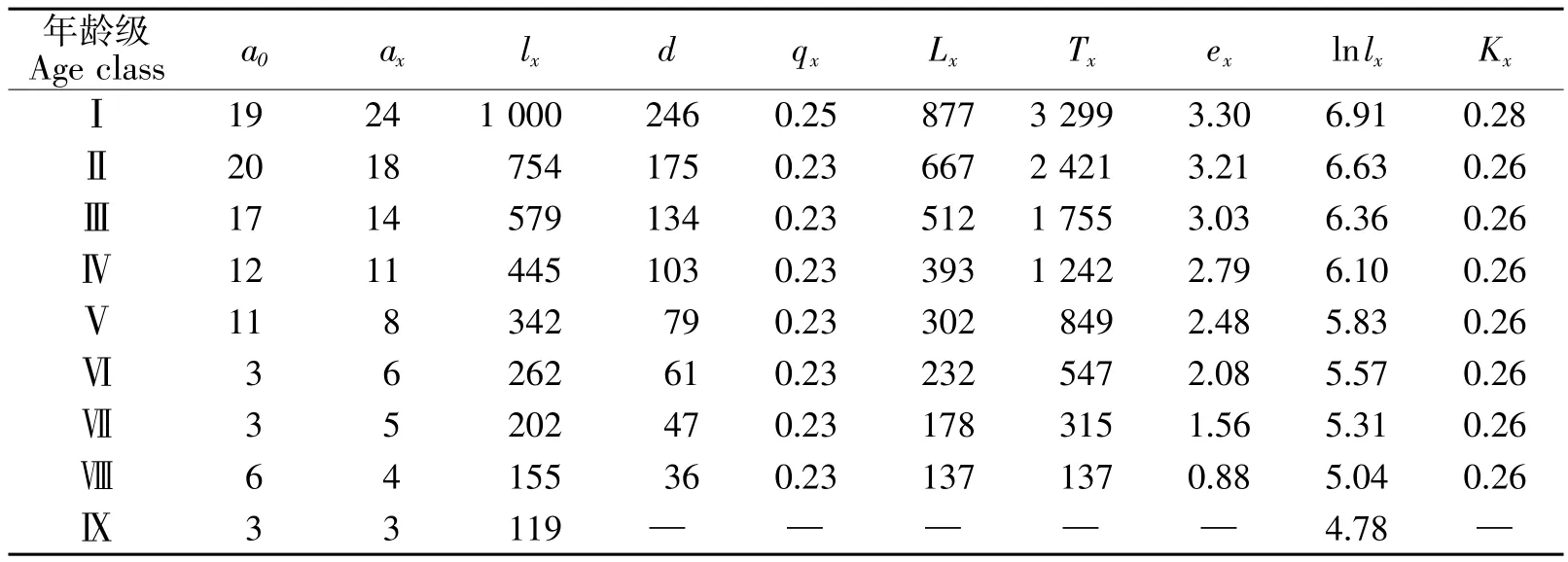
表1 霸王岭自然保护区黑桫椤种群静态生命表Table 1 Stationary life table of A.podophylla population in Bawangling Mountain Nature Reserve
2.4 种群动态及稳定性
种群数量变化动态指数Vn表示种群相邻龄级间数量的变化情况,Vn取正、负、零值反映种群的结构增长、衰退和稳定的关系;Vpi和V'pi取正、负、零值同Vn反映的种群动态一致[32]。从种群动态量化分析的结果来看(表2),动态变化指数Vn呈波动状态,整体及3个样方均有负值出现。其中样方A和样方C的V1均为负值,这说明其幼苗在从龄级Ⅰ向龄级Ⅱ过渡的阶段有一定的损失;其次,种群发展到中龄级时,负值的现象在样方A~C分别出现在V7、V3和V3也出现。在不考虑外界干扰情况下,整体种群值的年龄结构动态变化指数(Vpi)为32.53% , 而 各 样 方 分 别 为 18.67% 、56.21% 和28.47%,均显著大于0,表明在理想环境下为典型的增长种群。但结合外部干扰时,动态变化指数(V'pi)明显减小,尤其是样方A(0.71%)基本趋近于0。干扰敏感度指标P值在各样方依次为样方A(0.14)>样方 B(0.14)>样方 C(0.04)。因此,综合来看 3 个样方的黑桫椤种群均属于增长种群,但对外界干扰较为敏感。

表2 霸王岭保护区黑桫椤种群结构动态变化指数Table 2 Dynamic indices of A.podophylla population in Bawangling Mountain Nature Reserve
利用辛普森优势度指数对种群结构的稳定性进行分析,该指数的数学含义是在同一种群内随机抽取的两个个体来自同一龄级的可能性。因此,当辛普森优势度指数小于0.1时表明种群在各龄级内为均匀分布,而偏离0.1的程度越大则表示种群的稳定性越差[33]。从整体上看,霸王岭保护区的黑桫椤的种群结构稳定性指数值为0.20,偏离0.1的程度较为明显。而各样方的指数值分别为0.15、0.35和0.17;由此不难看出各样方种群的稳定性以样方A最优,其次是样方C和样方B。这一结果与种群年龄结构分布格局相吻合。因此维护黑桫椤种群的稳定性应综合考虑整体格局和各样方的具体实际情况。
3 讨论与结论
3.1 讨论
种群数量动态是种群生存能力与环境因素相互作用的历史结果,其年龄分布格局和更新模式受立地条件、外界干扰、种间种内竞争、病虫害等诸多因素的影响,反映了种群对环境事件的响应及重建史,为种群恢复与管理提供了有效的信息;因此,分析种群的年龄结构对于了解种群长期的生态学过程至关重要[34]。相对于长期追踪调查的方法,虽然种群年龄结构和静态生命表是基于某一特定时间点所构建,但其所展示的结果仍可对近几年或数十年后种群的更新水平、增长率、死亡率等做出有效判断[20]。以种群结构为基础的保护生物学研究已获得了普遍的认可,如P.Saikia等[35]利用径级对印度东北部的农户庭院的马来沉香(Aquilaria malaccensis)种群进行了研究,指出种群更新良好且庭院环境为该物种的保护提供了良好庇护场所;M.Teshome等[36]对埃塞俄比亚乳香树(Boswellia papyrifera)的研究表明该种群结构呈到J型和钟型,因此该地区乳香树种群特殊的更新模式应得到充分的认识和优先保护;I.Katsavou等[37]发现希腊北部哈尔基季基州的英国红豆杉(Taxus baccata)种群幼苗缺乏,提出了就地保护该种群时应创造出适宜的光照环境。本文就霸王岭保护区黑桫椤种群的龄级结构、生命表、种群结构动态、种群稳定性等进行了分析,为该种群的保护与管理提供了可靠的科学参考依据。因此,根据物种特定时期的径级或高度等方法探讨种群结构已成为研究濒危物种的重要手段。
J.Ash对斐济Viti Levu热带森林的树蕨(Cyathea hornei)种群的研究指出,随着龄级的增加种群各龄级的植株数呈不规则的下降趋势,尤其是在70~80龄级阶段的衰退较为明显[13]。福建省瓜溪桫椤自然保护区内不同生境的桫椤种群存在增长型、稳定型、成熟型和衰退型4种类型,甚至某些龄级出现零株数现象[38]。习水长嵌沟童仙溪的桫椤种群年龄结构表现衰退型,即幼龄和老龄个体少,以中龄林为主,种群结构极不稳定[8]。因此,树蕨这一类植物的在不同环境下所表现的种群年龄结构分布格局是多样的,但综合来看环境因子对种群结构分布格局起了主导作用。
在实地调查中发现,海拔、坡向、坡度、温度、湿度、光照等环境因子随着山体位置的改变后,黑桫椤种群内各龄级的个体数也出现了较为明显的变化,如幼苗数大量减少或成年个体数缺失等。黑桫椤孢子萌发、配子体发育及受精、幼孢子体形成及分化等一系列过程中对环境的要求均较为苛刻,尤其是温度和水分;因此,整体来看样方A和样方B的郁闭度明显要高于样方C,故其低龄级个体数较多。低龄级向中龄级过度的过程中,种群个体数量的减少一方面来自于环境的强筛作用,另一方面也有种间和种内竞争的结果。对黑桫椤而言,其幼苗早期对光的需求可能并不高,因此阴湿的环境更有利于幼龄级个体向中龄级过渡。从调查地发现,在低海拔处虽然也有零星个体的黑桫椤分布,但成规模大面积分布的仅在高海拔区域(约850~1 100m);因此,高湿低温的环境也是影响种群结构的另一重要特性。这一特性很好地在样方C有所体现,因为该样方朝东南向,光资源在该样方中较为充足。此外,在样方A中,有近50%的幼苗和幼树,而其他林下草本或木本植物均较为稀少,这也充分说明了沟谷小环境对黑桫椤生长的适宜性。同样的情况出现在日本屋久岛的桫椤种群中,研究发现在郁闭度较高的人工针叶林中的幼苗数要明显多于次生林[12]。
结合种群静态生命表和种群数量变化动态指数发现,黑桫椤种群发展过程中存在一定的波动性。宋萍等人[39]对桫椤种群生命过程及谱分析结果显示,桫椤的数量波动性是大周期内有小周期的、多谐波的叠加;各周期作用大小不同,基本上随周期的缩短而减小,这说明了种群生命过程受其生物学特征的控制较为明显。黑桫椤各龄级间种群动态指数(Vn)大小及正负的变化正是种群波动的具体表现。这种波动性不仅是生物学特性作用的结果,更是来自外界环境影响的结果;由此形成了各龄级间种群数量的变化,种群结构因此呈波浪式向前发展。在森林生态系统的进化过程中,不同的植物种群都有不同的生存对策,以求得在变化的环境中能保持世代的繁衍发展。黑桫椤种群结构始终处于不停的振荡之中,使种群的循环更新得以实现,保证了种群结构自振荡过程中在更大时间和空间尺度上形成极限环的有序的种群结构[27]。
3.2 结论
研究结果表明,霸王岭国家级自然保护区内的黑桫椤种群年龄结构表现为金字塔型,即中低龄级种群个体数占有较大的比例;存活曲线的拟合结果为Deevey-Ⅱ型,与生命表各龄级死亡率近似的结果相一致;种群数量变化动态指数表明各龄级间存在波动性,但其值均大于0表现为稳定种群。因此,综合来看,该区域内的黑桫椤为低增长性的稳定种群。对该种群的保护应以减少干扰,提升幼树幼苗的种群数量为主。
本文仅对霸王岭自然保护区内的黑桫椤种群年龄结构特征进行初步研究,但养分(N、P)对黑桫椤配子体和孢子体发育的影响、种群的构建与形成过程、水热条件对种群的影响、黑桫椤参与的森林养分循环过程、森林演替对黑桫椤种群的影响、种间竞争、物种多样性、生态位等仍有待于进一步深入研究,以便较全面地了解种群特征、种群间相互作用及种群与环境间的关系,为黑桫椤种群的更新、繁育、保护策略的制定等提供更为翔实可靠的科学参考依据。

