脑出血昏迷患者继发多器官功能障碍综合征的危险因素分析
胡淑梅 张利焕 张 爽
荥阳市人民医院神经内科,河南 荥阳 450100
脑出血是临床常见脑血管疾病,具有较高病死率及致残率。近年来,随人口老龄化加剧,脑出血发病率呈不断上升趋势,加重家庭及社会经济负担[1-2]。多器官功能障碍综合征(multi-organ dysfunction syndrome,MODS)是在严重感染、创伤等急性疾病中相继或同时并发的2个及以上器官急性功能衰竭或障碍。脑出血昏迷患者长期卧床,会进一步增加肝、肾功能损害、感染等发生风险,故脑出血昏迷患者是MODS的多发人群[3-5]。掌握脑出血昏迷患者继发MODS的危险因素,早期发现并给予有效治疗与干预是改善脑出血继发MODS患者预后的关键,但目前临床尚无较多关于脑出血昏迷继发MODS危险因素的深入研究[6-7]。本研究选取荥阳市人民医院91例脑出血昏迷患者,探讨年龄、既往糖尿病史与脑出血昏迷患者继发MODS的关联性。
1 资料与方法
1.1一般资料抽取2014-11—2017-01荥阳市人民医院91例脑出血昏迷患者,男47例,女44例,年龄47~79(64.39±11.41)岁。脑出血病因:脑血管畸形致脑出血29例,动脉硬化性脑出血62例。其中34例发生MODS为观察组,未发生MODS的57例脑出血昏迷患者为对照组。MODS诊断要点:在脑出血基础上并发2个及2个以上脏器功能衰竭可诊断为MODS,包括肺功能衰竭、肝功能衰竭、脑功能衰竭、肾衰竭、中枢神经系统功能衰竭、心血管功能衰竭、消化道功能衰竭、凝血机制障碍。
1.2纳入及排除标准(1)纳入标准:符合脑出血相关诊断标准[8],GCS评分≤8分;家属知晓本研究并自愿签署知情同意书;研究符合医学伦理学标准,经医院伦理协会审核同意。(2)排除标准:纳入研究前2周内具有感染史;入院24 h内死亡;合并恶性肿瘤疾病;依从性差难以配合本研究顺利完成。
1.3研究方法(1)收集一般资料:统计2组年龄、性别、出血部位(小脑、丘脑、脑叶)、既往病史(糖尿病、高血压、脑卒中、冠心病);测量2组血压[收缩压(SBP)、舒张压(DBP)]、血肿量。(2)评分:采用格拉斯哥昏迷指数(Glasgow coma scale,GCS)[9]评估2组昏迷情况,分值越低昏迷越严重;以急性生理学和慢性健康状况评分系统(acute physiological and chronic health evaluation,APACHE-Ⅱ)[10]对2组病情严重程度进行评估,分值越高病情越严重。(3)随访3个月,以格拉斯哥预后评分(Glasgow outcome scale,GOS)评估2组预后情况,分恢复良好(5分)、轻中度残疾(4分)、重度残疾(3分)、植物生存(2分)、死亡(1分)5个等级。

2 结果
2.1脑出血昏迷患者继发MODS危险因素单因素分析观察组性别、出血部位、既往高血压史、脑卒中史及血压(SBP、DBP)与对照组比较,差异均无统计学意义(P>0.05),观察组年龄、既往糖尿病史、冠心病史、血肿量及GCS评分、APACHE-Ⅱ评分与对照组比较,差异均有统计学意义(P<0.05)。见表1。
2.2脑出血昏迷患者继发MODS危险因素Logistic多因素回归分析经Logistic多因素回归分析,年龄、糖尿病史、血肿量及GCS评分、APACHE-Ⅱ评分是脑出血昏迷患者继发MODS的重要危险因素(P<0.05)。见表2。
2.3预后随访3个月观察组预后情况较对照组更差,差异有统计学意义(P<0.05)。见表3。
3 讨论
脑出血是临床常见病与多发病,随我国老龄人口增多,脑出血发生率呈不断增长趋势,且受生活方式及饮食习惯改变等因素影响,其发病年龄日渐年轻化,成为威胁中老年群体身心健康的重要疾病[11-12]。脑出血发病突然、病情危重,发病后患者多昏迷不醒,致体液调节及神经调节失常,引起多系统器官发生缺血性水肿,导致功能障碍,最终引发MODS。
脑出血后MODS发生机制尚不明确。本研究中观察组年龄、既往糖尿病史、冠心病史、血肿量及GCS评分、APACHE-Ⅱ评分与对照组均存在明显差异(P<0.05),且Logistic多因素回归分析示,年龄、糖尿病史、血肿量、GCS评分及APACHE-Ⅱ评分是脑出血昏迷患者继发MODS的重要危险因素。年龄是脑出血昏迷患者继发MODS的危险因素之一,年龄越大,患者存在慢性疾病的可能性越大,则机体耐受度越差,在发生脑出血后,机体脏器多处于代偿状态,更易发生MODS,且相关研究发现,老年脑出血患者继发MODS后其病情较年龄较小者更危重,病死率更高[13-14]。有糖尿病史患者多存在不同程度全身免疫功能低下及代谢紊乱,脑出血昏迷后,患者口鼻咽部寄生菌极易侵袭下呼吸道诱发肺部感染,肺部感染可进一步导致呼吸衰竭,机体缺氧后细胞代谢功能损害,成为器官衰竭的基础。一方面,胰岛素分泌及胰岛素抵抗障碍,可促进白细胞介素-6、肿瘤坏死细胞因子-α及CRP等炎性细胞因子大量释放,而大量炎性因子释放可诱发无法控制的炎性反应,最终引起MODS;另一方面,糖尿病患者过氧化物脂质及自由基含量较高,且花生四烯酸代谢存在异常,血小板在血栓素作用下聚集而发生微血栓,导致血流呈黏、缓状态,加重微循环障碍,引起凝血机制异常[15]。研究证实,凝血酶具有较强毒性,可通过破坏血-脑屏障、介导炎性反应等机制诱发脑组织水肿,增加血肿面积[16-17]。血肿直接对脑组织造成压迫,并引起占位效应,增加继发性脑水肿、脑疝形成、血液破入脑室所致脑脊液循环障碍等发生风险,严重者可诱发MODS[18]。

表1 脑出血昏迷患者继发MODS危险因素单因素分析
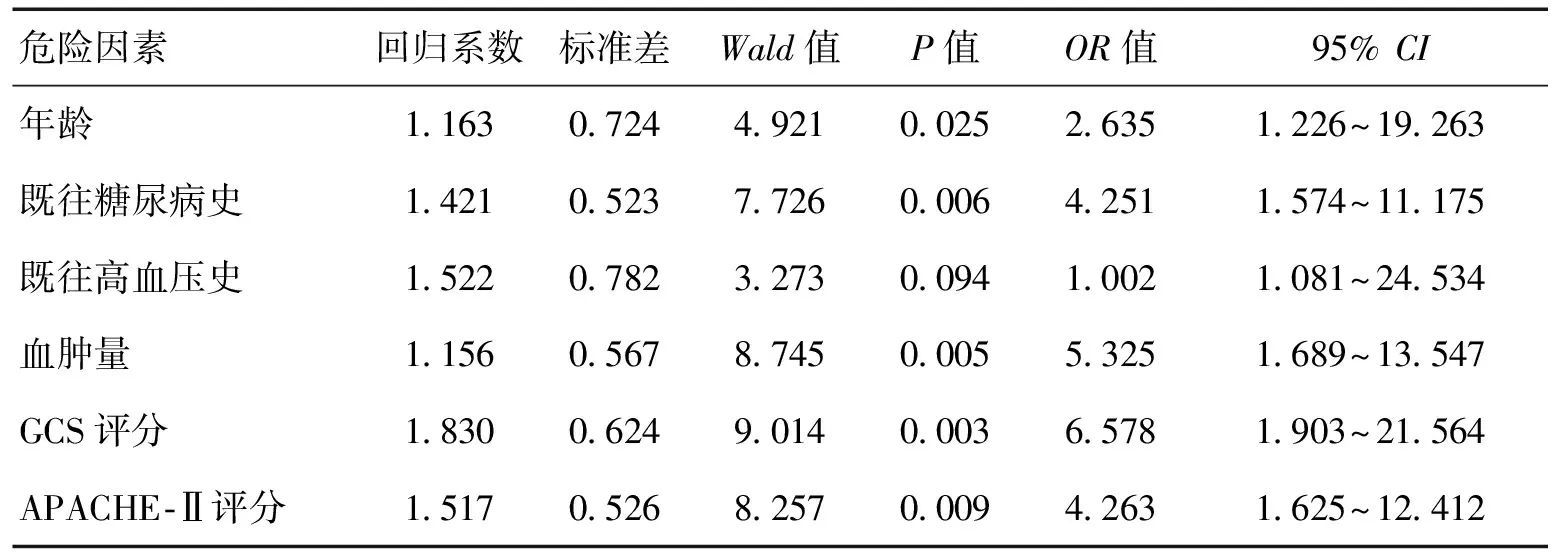
表2 脑出血昏迷患者继发MODS危险因素Logistic多因素回归分析

表3 2组预后情况比较 [n(%)]
GCS及APACHE-Ⅱ是评估脑出血患者昏迷程度及病情严重程度的常用评分量表[19-20]。研究发现,脑出血患者预后与昏迷程度密切相关,昏迷导致脑出血患者意识完全丧失,进一步加重病情危重程度[21]。随意识丧失,患者对外界刺激反应迟钝或完全丧失,无法对任何刺激作出主动反应,提示此时患者脑皮质功能已丧失,且昏迷程度越深,患者预后越差。昏迷导致患者卧床时间长,机体抵抗力差,极易发生感染,进而引发MODS[22]。APACHE-Ⅱ是评估危重患者病情严重程度的体系,由急性生理及慢性健康两部分组成,其分值越高提示患者病情越为危重,则继发MODS的风险越大,故APACHE-Ⅱ亦可作为评估脑出血昏迷患者继发MODS的重要指标[23-24]。随访3个月,观察组预后较对照组差(P<0.05),充分佐证了脑出血患者继发MODS后预后更差,故脑出血发生后,临床应准确评估MODS危险因素及发生风险,及时制定干预方案,降低MODS发生率,以改善脑出血患者预后。脑出血昏迷患者入院后,根据其年龄、有无糖尿病史、脑血肿量及GCS、APACHE-Ⅱ评估结果获取相关信息,判断患者是否存在继发MODS的较高风险,进而有利于对MODS进行早期预防。本研究存在一定局限性,需扩大样本量及延长随访时间进一步研究。

