柯萨奇B3病毒感染对HL-1心肌细胞及间充质干细胞的影响研究
彭俊,魏文娟,钱正明,黄建振,高世龙,张召才
扩张型心肌病(DCM)是一种以单侧或双侧心腔扩大、心肌收缩功能减退、伴或不伴充血性心力衰竭为特征的心肌病。病毒性心肌炎是形成DCM的重要病因[1],可引起心肌炎的病毒种类很多,其中以柯萨奇B组病毒(CVB)最为常见[2]。间充质干细胞(MSC)是一组成体干细胞,因其具有多向分化潜能、扩增迅速且低免疫原性[3]而被广泛应用于急性心肌梗死[4-5]及慢性心力衰竭[6-7]的实验研究中。心肌炎远期可进展成DCM,但是MSC治疗可否用于急性心肌炎患者目前尚不清楚。为此,本研究比较了病毒性心肌炎主要致病病毒——柯萨奇B3病毒(CVB3)感染对HL-1心肌细胞及MSC的影响,试图寻找一种新的心肌炎的治疗措施。
1 材料与方法
1.1 研究时间 本研究时间为2015年6月—2017年6月。
1.2 主要试剂及仪器 Claycomb培养基(SAFC Biosciences公司),DMEM培养基、RPMI 1640培养基(Invitrogen公司),胎牛血清(FBS)、MEM2×培养基(Gibco公司),肾上腺素、L-谷氨酸、4-羟乙基哌嗪乙磺酸(HEPES)、氯仿(Sigma公司),碱性成纤维细胞生长因子(Peptotech公司),SYBR green定量PCR预混液(Eurogentec公司),异丙醇(美国默克公司),1.3%纯化琼脂(Difco公司),大容量cDNA反转录试剂盒、7900HT快速实时PCR仪(美国应用生物系统公司),CellTiter 96®AQueous单溶液细胞增殖检测试剂盒(Promega公司),VersaMax读板机〔美谷分子仪器(上海)有限公司〕。
1.3 细胞培养 小鼠心肌细胞株HL-1心肌细胞保持了成年鼠心肌细胞的生物学特征,由德国U.Rauch教授赠予。Claycomb培养基含10% FBS、0.1 mmol/L肾上腺素、2 mmol/L L-谷氨酸以及1%抗生素液。所有的培养皿及培养板预先在0.1%明胶溶液中于37 ℃孵育0.5 h。人骨髓MSC(由德国M.Haag博士赠予)分离及鉴定方法见文献[4],DMEM培养基含10% FBS、2 mmol/L L-谷氨酸、1% HEPES、2 ng/ml碱性成纤维细胞生长因子、1%抗生素液。HeLa细胞(购自Invitrogen公司)的培养基为RPMI 1640培养基,其含10% FBS、1%抗生素液。
1.4 实时荧光定量PCR法检测CVB3基因拷贝数HL-1心肌细胞生长至80%汇合状态后以每孔3×105个/L接种于6孔板中,MSC生长至80%汇合状态后以每孔2×105个/L接种于6孔板中,培养24 h后换成无血清培养基再培养1 h;分别将其分为未感染组、感染后4 h组、感染后12 h组、感染后24 h组,其中感染后4 h组、感染后12 h组、感染后24 h组分别用CVB3感染4、12、24 h,未感染组仅用无血清培养基培养1 h。分别收集HL-1心肌细胞及MSC,采用Trizol法分离RNA:首先应用Trizol收集细胞,去除上清液后加入200 μl氯仿,室温孵育15 s,4 ℃下13 200 r/m离心15 min(离心半径11 cm),将上层透明的液体转移至500 μl的异丙醇中,室温孵育10 min,4 ℃下13 200 r/m离心15 min(离心半径11 cm),用70%乙醇冲洗沉淀物,4 ℃下7 500 r/m离心15 min(离心半径11 cm),最后将沉淀物溶于100 μl不含RNA酶的水中。应用大容量cDNA反转录试剂盒合成基因组DNA。总反应体积为25.0 μl,其中含上游引物及下游引物各1.0 μl、SYBR green定量PCR预混液12.5 μl、无菌去离子水 5.5 μl、基因组 DNA 或标准质粒 5.0 μl。PCR反应条件:50 ℃激活2 min,95 ℃激活10 min,进行40个循环的扩增,每个循环包括95 ℃ 15 s、60 ℃ 1 min,最后1个循环完成后进行95 ℃ 15 s及55 ℃ 15 s的孵育。应用核糖体蛋白L32作为内参照。引物设计:鼠核糖体蛋白L32的上游引物为5'-TGCCCACGGAGGACTGACA-3',下游引物为5'-AGGTGCTGGGAGCTGCTACA-3';人核糖体蛋白L32的上游引物为5'-AGGAGAGACACCGTCTGAACAAG-3',下游引物为5'-GAACCAGGATGGTCGCTTTC-3';CVB3的上游引物为5'-CCCTGAATGCGGCTAATCC-3',下游引物为5'-ATTGTCACCATAAGCAGCCA-3'。反应在7900HT快速实时PCR仪中进行,用96孔PCR板,每板上设核糖体蛋白L32及CVB3标准质粒组、样品组及阴性对照组,检测达到设定的荧光强度时所进行的PCR反应循环数(CT值)。根据质粒标准品的检测结果,得到拷贝数-CT值标准曲线,再根据每份标本的CT值与标准曲线的比较结果确定标本所含的CVB3基因拷贝数。实验独立重复3次。
1.5 MTS法检测细胞活性 HL-1心肌细胞生长至80%汇合状态后以每孔3×105个/L接种于6孔板中,MSC生长至80%汇合状态后以每孔2×105个/L接种于6孔板中,培养24 h后换成无血清培养基再培养1 h;分别将其分为未感染组、感染组,其中感染组用CVB3感染,未感染组仅用无血清培养基培养1 h。分别应用CellTiter 96®AQueous单溶液细胞增殖检测试剂盒检测细胞活性。将10 000个细胞(HL-1心肌细胞及MSC)分别接种到96孔板,每孔体积100 μl。培养24 h后,将20 μl CellTiter 96®AQueous单溶液细胞增殖检测试剂直接加入培养细胞,孵育2 h后,选择490 nm波长,在VersaMax读板机上测定各孔吸光度,即细胞活性。实验独立重复3次。
1.6 病毒空斑实验检测病毒滴度 HL-1心肌细胞生长至80%汇合状态后以每孔3×105个/L接种于6孔板中(HL-1心肌细胞组),MSC生长至80%汇合状态后以每孔2×105个/L接种于6孔板中(MSC组),培养24 h后换成无血清培养基再培养1 h,用CVB3感染。配备琼脂溶液(含0.04% FBS的MEM2×培养基及1.3%纯化琼脂)备用,将CVB3感染后的HL-1心肌细胞、MSC的培养上清液分别稀释至10-3、10-4、10-5、10-6个/L备用。将HeLa细胞以每孔6×105个/L接种到6孔板,培养24 h,PBS冲洗2次后分别加入1 ml不同浓度的CVB3感染后的HL-1心肌细胞、MSC的培养上清液,37 ℃培养30 min,每孔加入2 ml琼脂溶液,在超净台上放至琼脂凝固,转入培养箱中培养72 h,读取琼脂上病毒空斑数,即病毒滴度。实验独立重复3次。
表1 HL-1心肌细胞未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数比较(±s,n=6)Table 1 Comparisons of CVB3 genome copy number among the non-CVB3-infected HL-1 cardiomyocytes group,4-hour-CVB3-infected HL-1 cardiomyocytes group,12-hour-CVB3-infected HL-1 cardiomyocytes group,and 24-hour-CVB3-infected HL-1 cardiomyocytes group

表1 HL-1心肌细胞未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数比较(±s,n=6)Table 1 Comparisons of CVB3 genome copy number among the non-CVB3-infected HL-1 cardiomyocytes group,4-hour-CVB3-infected HL-1 cardiomyocytes group,12-hour-CVB3-infected HL-1 cardiomyocytes group,and 24-hour-CVB3-infected HL-1 cardiomyocytes group
注:CVB3=柯萨奇B3病毒
组别 CVB3基因拷贝数未感染组 0感染后4 h组 9 025±1 360感染后12 h组 25 875±1 359感染后24 h组 197 500±8 539 F值 1 563.90 P值 <0.01
1.7 统计学方法 采用SPSS 17.0统计学软件进行数据分析。计量资料以(±s)表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 CVB3基因拷贝数 HL-1心肌细胞未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数比较,差异有统计学意义(P<0.05,见表1)。MSC未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数比较,差异有统计学意义(P<0.05,见表2)。
表2 MSC未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数比较(±s,n=6)Table 2 Comparisons of the mean CVB3 genome copy number among non-CVB3-infected MSCs group,4-hour-CVB3-infected MSCs group,12-hour-CVB3-infected MSCs group,and 24-hour-CVB3-infected MSCs group

表2 MSC未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数比较(±s,n=6)Table 2 Comparisons of the mean CVB3 genome copy number among non-CVB3-infected MSCs group,4-hour-CVB3-infected MSCs group,12-hour-CVB3-infected MSCs group,and 24-hour-CVB3-infected MSCs group
组别 CVB3基因拷贝数未感染组 0感染后4 h组 1 037±114感染后12 h组 1 110±103感染后24 h组 190±31 F值 682.08 P值 <0.01
2.2 细胞活性 HL-1心肌细胞感染组感染后4、12、24 h细胞活性小于HL-1心肌细胞未感染组,差异有统计学意义(P<0.05)。HL-1心肌细胞未感染组不同时间点细胞活性比较,差异无统计学意义(P>0.05);HL-1心肌细胞感染组不同时间点细胞活性比较,差异有统计学意义(P<0.05,见表3)。
表3 HL-1心肌细胞未感染组、感染组不同时间点细胞活性比较( ±s,n=6)Table 3 Comparison of the mean cell viability between non-CVB3-infected HL-1 cardiomyocytes group and CVB3-infected HL-1 cardiomyocytes group at different time points

表3 HL-1心肌细胞未感染组、感染组不同时间点细胞活性比较( ±s,n=6)Table 3 Comparison of the mean cell viability between non-CVB3-infected HL-1 cardiomyocytes group and CVB3-infected HL-1 cardiomyocytes group at different time points
组别 感染后4 h 感染后12 h感染后24 h F值 P值未感染组 2.15±0.04 2.22±0.14 2.10±0.08 3.20 0.07感染组 1.73±0.08 1.40±0.05 1.25±0.06 250.39 <0.01 t值 10.94 16.18 27.86 P 值 <0.01 <0.01 <0.01
MSC未感染组与MSC感染组感染后4、12、24 h细胞活性比较,差异无统计学意义(P>0.05)。MSC未感染组、感染组不同时间点细胞活性比较,差异有统计学意义(P<0.05,见表4)。
表4 MSC未感染组、感染组不同时间点细胞活性比较(±s,n=6)Table 4 Comparison of the mean cell viability between non-CVB3-infected MSCs group and CVB3-infected MSCs group at different time points
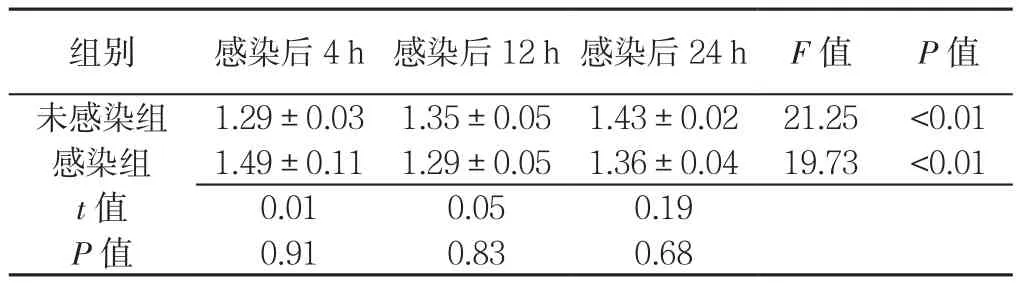
表4 MSC未感染组、感染组不同时间点细胞活性比较(±s,n=6)Table 4 Comparison of the mean cell viability between non-CVB3-infected MSCs group and CVB3-infected MSCs group at different time points
组别 感染后4 h 感染后12 h感染后24 h F值 P值未感染组 1.29±0.03 1.35±0.05 1.43±0.02 21.25 <0.01感染组 1.49±0.11 1.29±0.05 1.36±0.04 19.73 <0.01 t值 0.01 0.05 0.19 P值 0.91 0.83 0.68
2.3 病毒滴度 HL-1心肌细胞组病毒滴度大于MSC组,差异有统计学意义(P<0.05,见表5)。
3 讨论
MSC是一组成体干细胞,具有多向分化潜能,能自我复制且扩增迅速,同时具有低免疫原性等特点。随着MSC相关技术的日益成熟,其越来越多地被应用于急性心肌梗死[4]及慢性心力衰竭[5]的临床试验中。TELUKUNTLA等[6]于急性心肌梗死患者发病10 d内通过静脉注射MSC发现,患者心律失常发生率降低且左心室射血分数明显改善,同时疗效可持续至发病后6个月。HARE等[7]通过心外膜注射自体MSC或外源性MSC发现,急性心肌梗死患者的左心室重构及心肌瘢痕的形成均明显改善。HAMSHERE等[8]研究发现,外周静脉应用粒细胞集落刺激因子(G-CSF)联合冠状动脉内应用MSC可明显改善DCM患者的纽约心脏病协会(NYHA)分级及运动耐量,指出利用MSC进行细胞移植或可望成为DCM心功能不全新的治疗手段。而MARTIRE等[9]研究表明,MSC释放肿瘤坏死因子(TNF)受体抑制剂,其可以通过抑制核因子-κBp65途径的激活,改善DCM大鼠的组织重构和增加左心室射血分数。心肌炎患者远期可进展为DCM,而MSC可否应用于病毒性心肌炎患者目前尚不清楚。为此,本研究探讨病毒性心肌炎主要致病病毒——CVB3感染对HL-1心肌细胞及MSC的影响。
表5 HL-1心肌细胞组与MSC组病毒滴度比较(±s,n=6)Table 5 Comparison of the mean viral titer between CVB3-infected groups of HL-1 cardiomyocytes and MSCs

表5 HL-1心肌细胞组与MSC组病毒滴度比较(±s,n=6)Table 5 Comparison of the mean viral titer between CVB3-infected groups of HL-1 cardiomyocytes and MSCs
注:MSC=间充质干细胞
组别 病毒滴度(pfu./ml)HL-1心肌细胞组 161±6 000 MSC组 0 t值 123.048 P值 <0.01
CVB3是单股正链RNA病毒,具有mRNA活性和感染性。其生命周期是利用宿主细胞内的代谢工具来完成自身的拷贝及病毒组装,首先,病毒衣壳蛋白与宿主细胞表面特定受体之间发生特异性结合,然后,通过受体介导的胞饮作用进入细胞,紧接着,病毒在细胞内完成复制及病毒蛋白的合成,最终,通过细胞裂解而释放出来进入下一个生命周期[10]。已有研究表明,MSC能够降低CVB3感染小鼠的心肌细胞凋亡率及坏死率,抑制TNF的表达和单核细胞的激活,从而改善心肌收缩、舒张功能[11]。而且,与成纤维细胞相比,MSC可通过降低CVB3感染的野生型大鼠TNF-α、白介素1β和白介素6等,改善大鼠左心功能异常情况[12]。本研究结果显示,HL-1心肌细胞未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数有差异,MSC未感染组、感染后4 h组、感染后12 h组、感染后24 h组CVB3基因拷贝数有差异;HL-1心肌细胞感染组感染后4、12、24 h细胞活性小于HL-1心肌细胞未感染组,HL-1心肌细胞未感染组不同时间点细胞活性无差异,HL-1心肌细胞感染组不同时间点细胞活性有差异;MSC未感染组与MSC感染组感染后4、12、24 h细胞活性无差异,MSC未感染组、感染组不同时间点细胞活性有差异;HL-1心肌细胞组病毒滴度大于MSC组;说明CVB3能够在HL-1心肌细胞中复制,但不能在MSC中复制,这可能与MSC中缺乏柯萨奇腺病毒受体(CAR)的表达[13]、细胞外信号调节激酶1和2(ERK1/2)和蛋白激酶B(PKB)的激活[14]、泛素蛋白酶体系统(UPS)有关[15]。
本研究组设想,以后可通过CVB3不能在MSC中复制的特点,利用MSC自身的免疫调节作用及旁分泌效应[16],将HL-1心肌细胞与MSC共同培养,观察CVB3感染后的HL-1心肌细胞的病毒复制、细胞活性及细胞培养上清液中病毒滴度,试图寻找新的心肌炎的治疗措施。本研究不足之处在于仅完成了基础实验部分,如果同时结合动物实验可能更具有说服力。
综上所述,CVB3能够在HL-1心肌细胞中复制,感染CVB3后HL-1心肌细胞活性降低;但CVB3不能在MSC中复制,且感染CVB3后MSC细胞活性并未明显改变。提示可以根据MSC的这个特点将其进一步应用于急性心肌炎的治疗中。
作者贡献:彭俊负责本研究实施以及论文撰写,并对文章整体负责;魏文娟、钱正明、黄建振、高世龙参与资料的收集与整理;张召才负责本研究的构思与设计,论文的修改,并进行审校与质量控制。
本文无利益冲突。

