匹伐他汀对2型糖尿病模型大鼠肾脏损伤的保护机制
田 静,李 影,刘 芳
(保定市第一医院内分泌科,保定 071000)
在高血糖状态下,氧化应激是血管内皮功能障碍的原因之一。血糖控制达标可减慢糖尿病肾病(DN)的进展[1-2]。DN可能是一种炎性因子介导的炎症反应:炎性细胞释放炎症因子,炎症因子促进炎症细胞的黏附、聚集和激活,两者互为因果[3]。他汀类药物能改善患者内皮细胞功能,对炎症细胞的黏附、聚集有抑制作用。本课题通过建立STZ诱导的糖尿病大鼠模型,观察在高脂饲料喂养状态下炎症因子及氧化应激相关指标的动态变化,探讨匹伐他汀对上述指标的影响及可能的作用机制。
1 仪器与材料
1.1仪器 SCR20B型离心机(日本HITACHI公司);LEICARM 2016石蜡切片机(上海五相仪器仪表有限公司);光学显微镜(日本Olympus公司);Q55OCW图像信号采集与分析系统(德国LEICA 公司)。
1.2试药 匹伐他汀(北京双鹤药业股份有限公司,批号160422);链脲佐菌素(美国Sigma公司,批号090412);大鼠IL-6、VEGF免疫试剂盒(北京博奥森生物技术有限公司,批号分别为100042和100173);大鼠MDA、SOD、GSH-PX(南京建成生物工程研究所,批号分别为20140117,20140115和20140109)。
1.3实验动物 健康雄性Wistar大鼠84只,体质量为110±10 g,均由河北医科大学第四医院动物实验中心提供(动物合格证编号908040)。
2 实验方法
2.1DM大鼠造模与分组 应用随机数字表法将大鼠分为正常对照组16只、模型组68只。各组大鼠适应性喂养1周,模型组大鼠均给予40 mg·kg-1链脲佐菌素腹腔注射,72 h后尾静脉采血测定血糖。血糖高于16.7 mmol·L-1为糖尿病模型造模成功。将造模成功的64只大鼠随机分为糖尿病低脂组、糖尿病低脂干预组、糖尿病高脂组和糖尿病高脂干预组,各16只。2个低脂组大鼠先给予普通饲料喂养8周,然后糖尿病低脂干预组大鼠给予匹伐他汀2 mg·kg-1灌胃,每日1次,糖尿病低脂组给予等量的生理盐水灌胃,共3周;2个高脂组大鼠先给予高脂饲料喂养8周,然后糖尿病高脂干预组大鼠给予匹伐他汀2 mg·kg-1灌胃,每日1次,糖尿病高脂组给予等量的生理盐水灌胃,共3周。
2.2各项指标监测 每周监测各组大鼠体质量。实验性喂养前和喂养12周后,各组大鼠经尾静脉取血测定血脂、空腹血糖(FBG)、血游离脂肪酸(FFA)、血清肌酐(Scr)和尿素氮(BUN)。血浆葡萄糖和血脂指标等均采用相应酶法测定。
2.3尿蛋白检测 各组大鼠喂养12周后,收集大鼠24 h尿液,检测24 h尿蛋白含量。
2.4IL-6和VEGF的含量测定 各组大鼠喂养12周后,禁食10 h,给予体积分数为10%的水合氯醛腹腔麻醉,剖腹,肾静脉取血,采用酶联免疫吸附法(Elisa法)测定血中IL-6和VEGF的含量。
2.5肾组织匀浆丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-PX)的含量测定 应用空气栓塞法处死大鼠,测定大鼠单肾质量,计算肾肥大指数(肾肥大指数=单肾质量÷体质量)。取适量肾脏组织,用冰生理盐水清洗,清净后制成体积分数为10%的肾组织匀浆。测定肾组织匀浆中MDA、SOD和GSH-PX的含量。
2.6观察肾组织病理改变 部分肾组织依次经固定、脱水、包埋、切片等一系列步骤后,制成HE染色组织切片,置于光镜下观察肾脏病变情况。

3 结果
3.1各组大鼠的体质量、肾肥大指数 实验前,比较各组大鼠体质量,差异无统计学意义(P>0.05)。高脂饲料喂养组大鼠体质量明显高于其余各组大鼠,且糖尿病高脂组高于糖尿病高脂干预组,差异有统计学意义(P<0.05)。饲养12周后,糖尿病模型组大鼠肾脏肥大指数明显高于正常对照组,而匹伐他汀干预组大鼠的肾脏肥大指数较匹伐他汀未干预组明显降低(P<0.05)。提示匹伐他汀可明显减轻糖尿病大鼠肾脏肥大的程度。见表1。
表1各组大鼠体质量和肾肥大指数
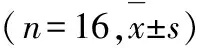
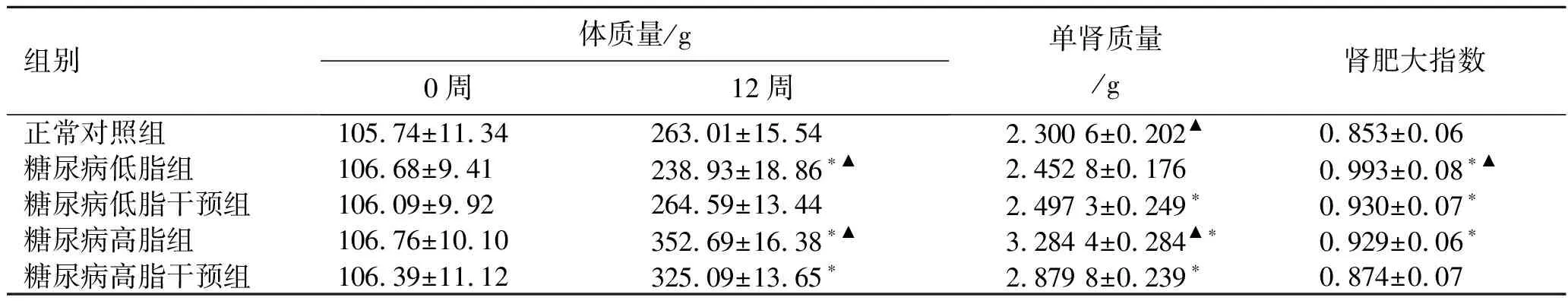
组别体质量/g0周 12周 单肾质量/g肾肥大指数正常对照组105.74±11.34263.01±15.54 2.300 6±0.202▲ 0.853±0.06糖尿病低脂组106.68±9.41238.93±18.86∗▲ 2.452 8±0.176 0.993±0.08∗▲糖尿病低脂干预组106.09±9.92264.59±13.44 2.497 3±0.249∗ 0.930±0.07∗糖尿病高脂组106.76±10.10352.69±16.38∗▲ 3.284 4±0.284▲∗ 0.929±0.06∗糖尿病高脂干预组106.39±11.12325.09±13.65∗ 2.879 8±0.239∗ 0.874±0.07
注:与正常对照组比较*P<0.05,差异具有统计学意义;与匹伐他汀干预组比较▲P<0.05,差异具有统计学意义。
3.2血脂、游离脂肪酸检测结果 高脂饲料喂养的大鼠血脂各项指标明显高于正常对照组和2个低脂组,给予匹伐他汀处理后,糖尿病高脂组大鼠血脂指标明显降低(P<0.05);说明匹伐他汀有明显的降脂作用。见表2。
3.3血糖结果 糖尿病模型组大鼠经过12周的高脂饲料喂养后,FBG进一步升高。表明匹伐他汀对血糖无明显影响(P<0.05)。见表2。
表212周后各组大鼠的TC、TG、LDLC、FBG和FFA
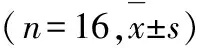
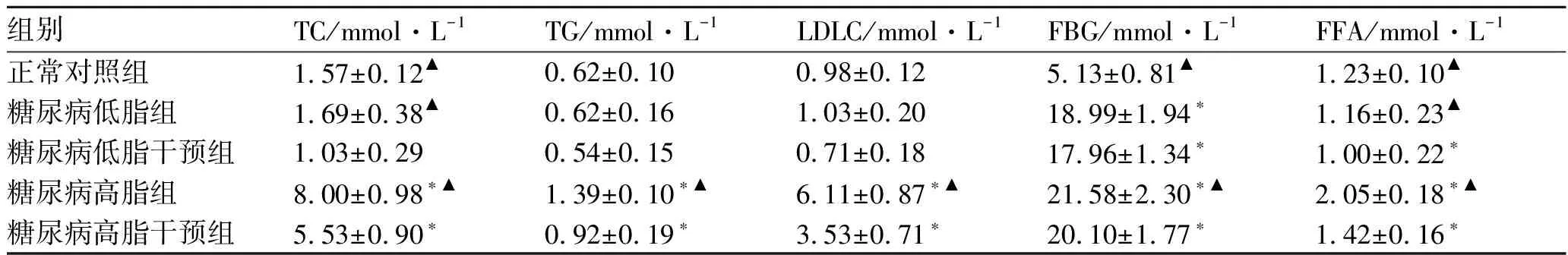
组别TC/mmol·L-1TG/mmol·L-1LDLC/mmol·L-1FBG/mmol·L-1FFA/mmol·L-1正常对照组1.57±0.12▲0.62±0.100.98±0.125.13±0.81▲1.23±0.10▲糖尿病低脂组1.69±0.38▲0.62±0.161.03±0.2018.99±1.94∗1.16±0.23▲糖尿病低脂干预组1.03±0.290.54±0.150.71±0.1817.96±1.34∗1.00±0.22∗糖尿病高脂组8.00±0.98∗▲1.39±0.10∗▲6.11±0.87∗▲21.58±2.30∗▲2.05±0.18∗▲糖尿病高脂干预组5.53±0.90∗0.92±0.19∗3.53±0.71∗20.10±1.77∗1.42±0.16∗
注:与正常对照组比较*P<0.05,差异具有统计学意义;与匹伐他汀干预组比较▲P<0.05,差异具有统计学意义。
3.4各组大鼠血肌酐、尿素氮和24 h尿蛋白含量测定结果 长期高血糖状态下糖尿病高脂组大鼠24 h尿蛋白含量明显高于正常对照组(P<0.05),血肌酐和尿素氮含量也明显偏高,进一步加重了糖尿病大鼠的肾脏损伤;经匹伐他汀处理后24 h尿蛋白、血肌酐和尿素氮均有所降低,在一定程度上减轻了糖尿病大鼠的肾脏损伤(P<0.05)。见表3。
3.5各组大鼠血IL-6和VEGF水平 与正常对照组比较,糖尿病模型组血IL-6和VEGF含量明显偏高(P<0.05),高脂环境下IL-6和VEGF进一步增高(P<0.05)。糖尿病大鼠肾脏中炎症因子增多,高脂环境进一步加重了局部的炎症反应,本研究结果提示匹伐他汀可能具有一定的抗炎作用。见表4。
3.6各组大鼠肾组织匀浆MDA、SOD和GSH-PX含量测定 比较不同饲养条件下糖尿病模型组大鼠的肾脏MDA、SOD和GSH-PX含量,研究提示,长期高糖、高脂环境下糖尿病模型组大鼠肾脏氧化应激反应明显增强(P<0.05)。匹伐他汀可部分降低氧化应激的程度,通过抑制局部氧化应激反应起到保护肾脏的作用。见表4。
表3各组大鼠血肌酐、尿素、24h尿蛋白测定结果
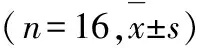

组别血肌酐/μmol·L-1尿素氮/mmol·L-124 h尿蛋白/g·L-1正常对照组56.45±8.57 6.01±0.8313.95±1.53▲糖尿病低脂组58.39±8.35 5.94±0.8441.80±7.40▲∗糖尿病低脂干预组54.55±8.58 5.86±0.7732.39±5.34∗糖尿病高脂组99.09±11.61▲∗12.24±1.28▲∗90.88±10.58▲∗糖尿病高脂干预组77.20±9.72∗ 9.96±1.14∗60.92±8.31∗
注:与正常对照组比较*P<0.05,差异有统计学意义;与匹伐他汀干预组比较▲P<0.05,差异有统计学意义。
表4大鼠血IL-6、VEGF水平及肾组织匀浆MDA、SOD和GSH-PX含量
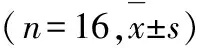

组别IL-6/ng·L-1VEGF/ng·L-1MDA/nmol·g-1SOD/U·mg-1GSH-PX(活力单位)正常对照组 66.75±8.36▲19.33±2.52▲13.23±1.54▲208.08±25.45▲316.98±23.04▲糖尿病低脂组 93.17±12.52▲∗29.14±2.89▲∗19.24±1.50▲∗160.64±15.2▲∗254.61±18.38▲∗糖尿病低脂干预组 81.15±10.92∗24.69±2.59∗16.61±1.35∗182.86±14.91∗296.91±21.25∗糖尿病高脂组163.86±12.7▲∗46.09±3.88▲∗24.17±2.34▲∗128.35±14.6▲∗207.83±18.32▲∗糖尿病高脂干预组116.67±15.78∗37.97±3.04∗19.78±1.77∗146.86±15.48∗232.42±19.61∗
注:与正常对照组比较*P<0.05,差异具有统计学意义;与匹伐他汀干预组比较▲P<0.05,差异具有统计学意义。
3.7各组大鼠肾脏组织形态学比较 与正常对照组大鼠比较,糖尿病低脂组大鼠肾小球可见轻度炎细胞浸润及纤维化;高脂组肾脏病变进一步加重,除了肾小球,肾间质亦可见明显炎症细胞浸润、纤维化。匹伐他汀干预后上述病变程度均较干预前减轻。从病理形态上进一步说明匹伐他汀可减轻糖尿病大鼠肾脏的免疫炎症反应,从而在一定程度上延缓糖尿病肾病的进展。见图1。
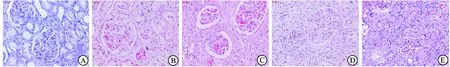
图1大鼠肾组织形态学比较
A.正常对照组(×100); B.糖尿病低脂干预组(×400);C.糖尿病低脂组(无匹伐他汀处理,×100);D.糖尿病高脂干预组(×400);E.糖尿病高脂组(无匹伐他汀处理,×400)。
Fig.1 Comparison of morphology of kidney in rats
A.blank control group (×100);B.pitavastatin group fed by low dose fat (×400);C.group fed by low dose fat (fed by normal fat and untreated by pitavastatin,×100);D.pitavastatin group fed by high dose fat (×400);E.group fed by high dose fat (fed by high dose fat and untreated by pitavastatin,×400).
4 讨论
由炎症细胞、细胞因子参与的一系列炎症反应已成为DN发生、发展的重要原因[4-5]。IL-6与糖尿病肾病的发生、发展关系密切。IL-6使DN患者系膜细胞局部氧自由基的生成增多、加重脂质过氧化、损伤细胞内膜;IL-6和TNF-α均可促进免疫复合物的形成,并沉积于肾脏血管内皮形成血栓[6-8]。血管内皮生长因子(VEGF)是体内一种强效促血管生成因子,可使血管内皮的通透性增加。有学者发现,VEGF表达的上调可加重糖尿病肾脏病变[9]。许多炎症因子相互作用导致免疫失衡,肾脏病变进一步加重[10-12]。多项临床研究证实了上述观点[13-14]。
文献表明,他汀类药物有抗炎、减轻肾小球硬化和保护肾功能等作用[15-18]。DN早期存在肾小球肥大,可伴有肾小管间质纤维化,晚期可出现肾小球硬化和肾功能衰竭。核因子-κB(NF-κB)可调节多种炎症因子的转录[19]。他汀类药物能抑制巨噬细胞的浸润和某些炎性因子如TGF-B1和IL-6等的表达,NF-κB的活性受抑,减轻肾脏局部的炎症反应。
STZ是最常用的致糖尿病药物,此类药小剂量腹腔注射,可部分损伤胰岛β细胞,使胰岛素分泌减少[20-21];高脂高糖喂养可诱导实验动物出现胰岛素抵抗[22],2种方法结合更易获得2型糖尿病动物模型。研究表明,STZ对肝、肾有一定的毒性[23]。研究提示,STZ诱导的糖尿病大鼠血循环中IL-6和VEGF水平较普通饲料喂养的模型大鼠明显升高。经匹伐他汀处理后,除了糖尿病大鼠血循环中炎症因子的水平下降外,肾组织匀浆中的MDA水平也有所降低,GSH-PX和SOD活性增强。高血糖状态下体内自由基增多易造成氧化损伤,脂质过氧化物可损伤肾脏基底膜和内皮细胞。文献报道,丹参素通过清除氧自由基、抑制脂质过氧化从而延缓DN的进展[24]。实验结果表明,匹伐他汀具有一定的抗炎、抗氧化作用。糖尿病引发的肾小球硬化是DN的主要病理特点[25]。本实验中观察肾脏的病理形态变化,可见普通饲料喂养的糖尿病大鼠肾脏出现肾小球水肿及炎症细胞浸润,而处于高脂环境下的大鼠可见肾血管硬化以及肾间质的纤维化。匹伐他汀(2 mg·kg-1·d-1)干预3周可在一定程度上减轻肾脏局部炎症病变及纤维化程度。
研究结果提示,匹伐他汀除了降脂作用外,对糖尿病大鼠的肾脏有一定的保护作用,国内学者研究也得出类似的结论[26-28]。考虑其作用机制可能是通过调节一系列的细胞信号转导通路从而抑制IL-6、TNF-α和VEGF等炎性因子的表达。同时匹伐他汀可抑制肾脏局部的氧化反应,通过抗炎、抗纤维化达到改善肾功能和缓解肾脏病变进一步发展的目的。此外,匹伐他汀未对血糖造成影响,可联合用于糖尿病肾病的临床治疗。

