青菜头中黑芥子苷的检测方法及含量差异研究初报
王安良 唐璜 吴杰 郑洋 郑小玲
摘 要 以涪陵榨菜原料青菜头为研究对象,取其叶、瘤状茎及瘤状茎的皮部和芯部,用高效液相色谱法测定青菜头的黑芥子苷(2-丙烯基芥子苷)含量。用外标法计算,测得青菜头各部位的黑芥子苷含量为:叶2.78 g·kg-1 DW;瘤茎4.84 g·kg-1 DW;瘤茎表皮7.39 g·kg-1 DW;瘤茎里芯4.05 g·kg-1 DW。研究结果表明,青菜头各部位的黑芥子苷含量:瘤茎表皮>瘤茎>瘤茎里芯>叶。
关键词 青菜头;黑芥子苷;高效液相色谱法
中图分类号:S637 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2019.34.006
享誉海外的涪陵榨菜是重庆的一张特色名片,传统涪陵榨菜采用风脱水工艺[1],属于中国非物质文化遗产[2]。涪陵榨菜是以茎瘤芥的瘤芥(青菜头)为原料经整理、脱水、3次腌制而成的盐腌菜,是一种半干态的具有轻微乳酸发酵的腌制品[3-4]。茎瘤芥属十字花科[5],含有丰富的芥子苷[6],芥子苷是一类具有抗癌防癌功能的物质[7]。
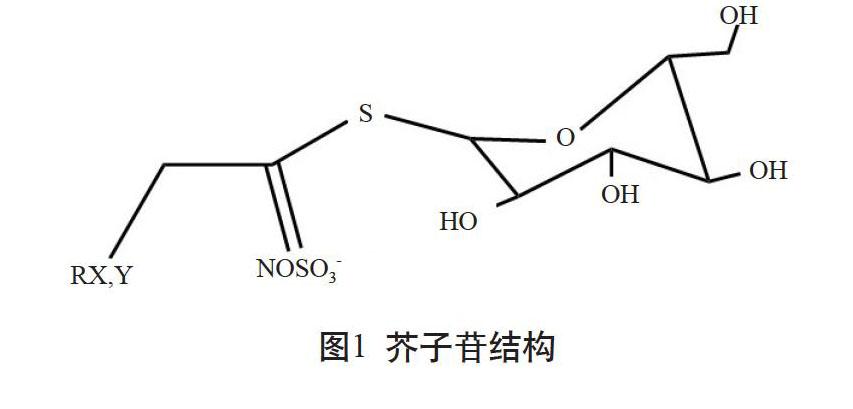
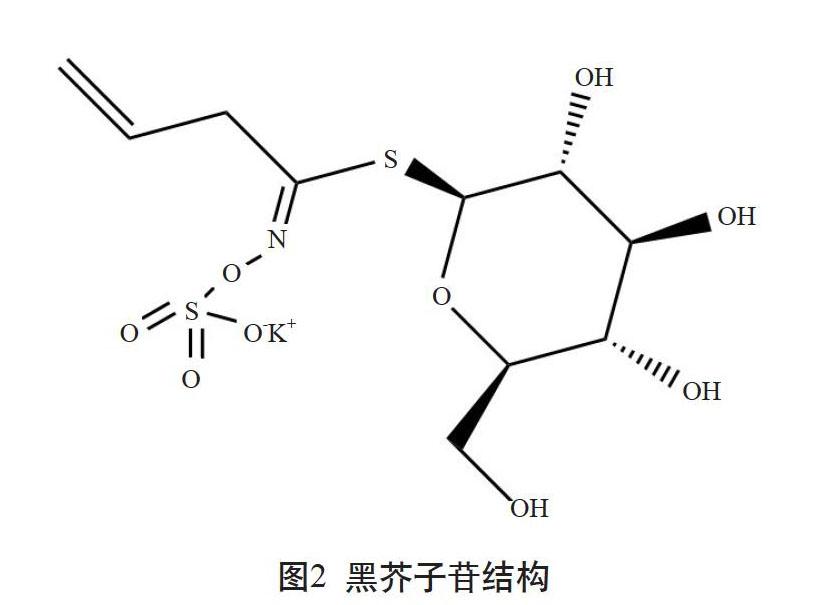
芥子苷又称硫代葡萄糖苷(简称硫苷)[8],在十字花科蔬菜中属于重要的次生代谢产物[9],目前十字花科中发现芥子苷有20多种[10],其结构如图1所示[11]。芥子苷通常由硫化肟基团、β-D-硫葡萄糖基和来源于氨基酸的侧链构成。芥子苷有3个类群,分别是吲哚族芥子苷、脂肪族芥子苷和芳香族芥子苷[12-13]。近年来,由于在抗癌、防癌方面的特殊功效,芥子苷研究成为流行病学、食品科学、农业等多个领域的研究热点[14]。国际癌症基金会指出,每天食用10 g左右富含芥子苷的蔬菜即可有效地预防癌症的发生。除了具有抗癌功效外,芥子油苷水解产物对于植物抵抗细菌、真菌、病毒和蚜虫等都有重要作用。我国常见的十字花科蔬菜种类包括白菜类、甘蓝类、芥菜类和萝卜类四大类。存在于芥菜类蔬菜中的芥子油苷有9种。黑芥子苷,又称黑芥子硫苷酸钾,也就是2-丙烯基芥子苷,为主要的芥子油苷种类,属于脂肪族芥子苷,它的R侧链上连接的是一个2-丙烯基,其结构如图2所示[15]。黑芥子苷是中药芥子的有效成分之一,有抗炎[16]、 通利内脏、温和开胃、发汗散寒、化痰利气、增进食欲、促进消化等功效[17]。
青菜头为涪陵榨菜原料,属于涪陵的特色产品,是十分重要的地方特殊经济作物,对拉动当地经济、带领农户脱贫增收有着重要的作用。当前国内外对于芥子油苷的研究,主要集中于萝卜、甘蓝、花椰菜、芥菜、玛咖等农产品,而针对青菜头中芥子油苷还鲜有研究。本文以青菜头为研究对象,采用高效液相色谱法测定青菜头的黑芥子苷含量,并比较黑芥子苷含量在各器官间的差异,以期填补针对涪陵榨菜相关产品中芥子油苷的检测方法空白,促进涪陵榨菜特色产业持续健康发展。
1 材料与方法
1.1 材料与仪器
甲醇,色谱纯,TEDLA公司;氯化钾,分析纯,上海化學试剂公司;乙酸铅,分析纯,上海化学试剂公司;超纯水,由MERCK MilliPORE制得;黑芥子苷标品,CAS号3952-98-5,纯度≥98%,上海源叶生物有限公司;青菜头,采自重庆市涪陵区致韩镇菜地。
安捷伦1290高效液相色谱仪(配二极管阵列检测器)、色谱柱:Eclipse Plus C18柱(4.6 mm×250 mm,5μm),Agilent Technologies;H23474组织破碎机,北京恒奥德仪器仪表有限公司;ALpha 1-2 LD plus真空冷冻干燥机,CHRIST;Direct-Q3超纯水一体机,MERCK MilliPORE;SCQ-8201A超声波清洗机,上海声彦超声波仪器有限公司;Z323k冷冻离心机,HERMLE;N-EVAPTM112氮吹仪,南京铭奥仪器设备有限公司;DEG-200氮气发生器,淄博宏润工贸有限公司;XW-80A涡旋震荡器,上海青浦沪西仪器厂;LE324S电子分析天平,SARTORIUS。
1.2 实验方法
1.2.1 样品制备
叶部取鲜样切碎,混合均匀后缩分至150 g。瘤茎部分分2种取样:瘤状茎整个切成薄片,然后混合均匀,四分法缩分至150 g;瘤状茎表皮取鲜样,混合均匀后缩分至150 g,瘤状茎中心肉质部分取鲜样,混合均匀后缩分至150 g。制备后的样品冷冻保存在-20 ℃冰箱里,然后进行冷冻干燥,粉碎,用真空袋装好,抽真空,在-20 ℃冰箱里保存。
1.2.2 样品前处理
取样品冻干粉0.10 g于15 mL离心管中,加入1.5 mL 70%甲醇溶液,在70 ℃水浴锅中超声提取10 min,冷却至室温后,加入0.5 mL澄清10 g/100 mL乙酸铅溶液,除去部分蛋白质。涡旋1 min,混匀,在4 000 r·min-1离心机中离心5 min。保存上清液,沉淀再用70%甲醇按上述方法提取2次,合并3次提取液。将提取液在40 ℃水浴下用氮吹仪浓缩至0.1 mL。再用超纯水定容至2 mL,涡旋1 min后,用0.22 nm水系滤膜过滤,供UPLC检测。每个样品再做2次平行。
1.2.3 色谱检测条件
色谱柱:Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm)。流动相:氯化钾溶液(0.005 mol·L-1)与甲醇的体积比为91∶9。柱温:30 ℃。检测器:二极管阵列检测器。波长:230 nm。流速:1.0 mL·min-1。进样量:20 μL。
1.2.4 标准曲线的绘制
准确称取0.007 0 g黑芥子苷标准品,置于10 mL容量瓶中,用水溶解并定容至刻度,即为700 μg·mL-1黑芥子苷标准储备液。准确称取0.001 0 g黑芥子苷标准品,置于10 mL容量瓶中,用水溶解并定容至刻度,即为100 μg·mL-1黑芥子苷标准储备液。所配制的标准储备液置于冰箱保存备用。
黑芥子苷标准储备液用水分别稀释成浓度为25 μg·mL-1、50 μg·mL-1、100 μg·mL-1、350 μg·mL-1、700 μg·mL-1系列标液,高效液相色谱仪测定,以保留时间定性,峰面积定量,绘制标准工作曲线。
1.2.5 样品测定
按“1.2.3 色谱检测条件”,待基线平稳后再进样,以目标物谱峰的保留时间定性,外标法定量计算样品中黑芥子苷含量。计算公式如下:
X=(C×V)/(M×1000) (1)
式(1)中的X为样品中黑芥子苷含量,单位为g·kg-1;C为待测样中黑芥子苷浓度,单位为μg·mL-1;V为样液最后定容总体积,单位为mL;M为样品质量,单位为g。
2 结果与分析
2.1 检测方法的建立
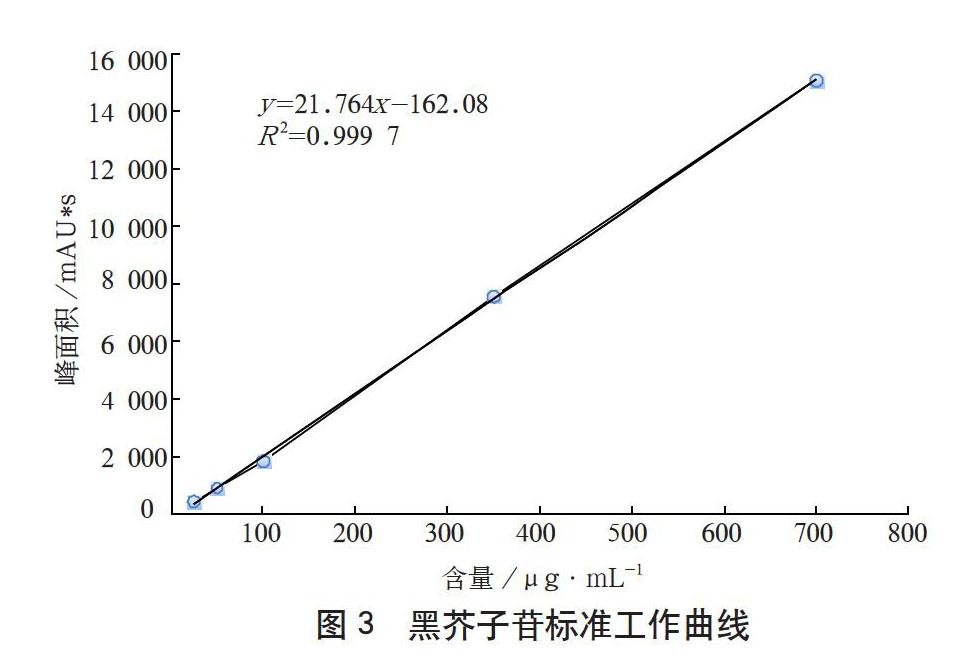
在选定的色谱条件下,分别对一系列浓度的黑芥子苷标液进行测定,以黑芥子苷标样的峰面积为纵坐标(Y),进样浓度(μg·mL-1)为横坐标(X)做标准曲线,如图3所示。
得到的线性回归方程为y=21.764X-162.08,结果表明,在25~700 μg·mL-1范围内线性关系良好,相关系数为0.999 7。检出限以3倍噪声计为0.01 g·kg-1。方法的准确度和精密度可通过添加回收率实验来考察。按上述实验方法,对黑芥子苷加标样品进行了含量测定并计算回收率和相对标准偏差。结果发现,本方法平均回收率在95%~104.2%,相对标准偏差在1.6%~3.4%。实验结果表明,本方法的准确度和精密度较好。采用此方法检测青菜头中黑芥子苷的含量,准确可靠,能够满足测定要求。
2.2 实际样品的测定及器官间差异
本文采用所建立的检测方法分别测定8个青菜头的叶、瘤茎、瘤茎表皮、瘤茎里芯等部位的黑芥子苷含量。
从表1和图4可以看出,青菜头瘤茎表皮的黑芥子苷含量最高,有7.39 g·kg-1DW;其次是瘤茎,有4.84 g·kg-1 DW;然后是瘤茎里芯,有4.05 g·kg-1 DW;最少的是叶,仅有2.78 g·kg-1 DW。
由表1再看这4个部位的含量范围与极差,叶的测定值极差最大,达到了5.56 g·kg-1;其次是茎,相差4.39 g·kg-1,说明叶和茎的测定结果变动较大。对比4个部位的方差和标准差,叶的方差达到4.60 g2/kg2之多,标准差为2.15 g·kg-1,其次是茎的方差2.25 g2/kg2、标准差1.50 g·kg-1,表皮的方差1.75 g2/kg2、标准差1.32 g·kg-1,里芯的方差和标准差最低为0.88 g2/kg2和0.94 g·kg-1,说明本實验中叶的测定数据离散程度较大,茎、皮、芯的测定数据的离散程度较小,数据较集中。叶黑芥子苷含量的变异系数是77.12%,茎黑芥子苷含量的变异系数是30.99%,瘤茎表皮黑芥子苷含量的变异系数是17.89%,瘤茎里芯黑芥子苷含量的变异系数是23.19%,可见叶黑芥子苷含量的相对变异程度大,瘤茎表皮黑芥子苷含量的相对变异程度小。最后从标准误差分析这4个部位的差异,叶(0.76)>茎(0.53)>皮(0.47)>芯(0.33),表明本实验所测样品的瘤茎里芯黑芥子苷含量与总体瘤茎里芯的黑芥子苷含量值较接近,对总体的瘤茎里芯有代表性,以本实验瘤茎里芯的样本来推断总的瘤茎里芯的黑芥子苷含量可靠度很大;本实验的茎和瘤叶茎表皮的黑芥子苷含量也能较好地代表总体茎和瘤茎表皮的含量;而本实验中叶的黑芥子苷含量只能一定程度地代表总体茎瘤芥叶的含量。从这4个部位的相对标准偏差来看,本实验测得的青菜头的皮、芯和瘤茎的黑芥子苷含量的精密度较高,而叶的测定结果的精密度则较低。
3 小结
本文研究了青菜头中黑芥子苷含量的检测方法,并进一步试验分析了黑芥子苷含量在青菜头不同器官间的差异。实验结果表明,黑芥子苷在25~700 μg·mL-1质量浓度范围内与峰面积呈良好的线性关系(r=0.999 7),检出限为0.01 g·kg-1,黑芥子苷的添加回收率为95.0%~104.2%,相对标准偏差为1.6%~3.4%。说明本文所建方法准确度和精密度符合青菜头中黑芥子苷含量的测定要求,且方法前处理快捷简便,适合处理大批量样品。并进一步分析了黑芥子苷含量在青菜头不同器官间的差异。发现青菜头各部位的黑芥子苷含量:瘤茎表皮>瘤茎>瘤茎里芯>叶。其中,叶的测定数据离散程度较大,茎、皮、芯的测定数据的离散程度较小,数据较集中。
参考文献:
[1] 方明强,贺云川,周斌全,等.晒制风脱水榨菜工艺研究[J].食品与发酵科技,2016,52(2):14-21.
[2] 薛元鹏,陈俊杰,叶进,等.青菜头物理力学特性研究[J].西南大学学报(自然科学版),2017,39(2):147-152.
[3] 李敏,贺云川.方便榨菜挥发性成分分析[J].食品科学,2011,32(8):272-274.
[4] 刘明春.榨菜加工过程中挥发性风味物质的形成及变化研究[D].重庆:重庆大学,2009.
[5] 陈竹君,张明方,汪炳良,等.榨菜胞质雄性不育及其农艺性状的研究[J].园艺学报,1995,22(1):40-46.
[6] Rosa EAS, Heaney RK, Fenwick GR, et al. Glucosinolates in Crop Plants[M]. Horticultural Reviews, Volume 19. John Wiley & Sons, Inc. 1997: 99-215.
[7] 汪俏梅,曹家树.芥子油苷研究进展及其在蔬菜育种上的应用前景[J].园艺学报,2001(S1): 669-675.
[8] Reichelt M, Brown PD, Schneider B, et al. Benzoic acid glucosinolate esters and other glucosinolates from Arabidopsis thaliana[J]. Phytochemistry, 2002, 59(6): 663-671.
[9] 张丽,何洪巨,陈静华,等.不同萝卜品种中硫代葡萄糖苷组分及含量分析[J].中国蔬菜,2010(18):43-46.
[10] 腊贵晓,方萍,马剑,等.高效液相色谱-外标法定量芥蓝中芥子油苷[J].食品科技,2009,34(8):267-271.
[11] Grubb CD, Abel S. Glucosinolate metabolism and its control[J]. Trends in Plant Science, 2006, 11(2): 89-100.
[12] Fahey JW, Zalcmann AT, Talalay P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants[J]. Phytochemistry, 2001, 32(10): 5-51.
[13] Halkier BA, Gershenzon J. Biology and biochemistry of glucosinolates[J]. Annual Review of Plant Biology, 2006, 57(1): 303-333.
[14] 程坤,楊丽梅,方智远,等.十字花科植物中主要硫代葡萄糖苷合成与调节基因的研究进展[J].中国蔬菜,2010(12):1-6.
[15] Tian Q, Rosselot RA, Schwartz SJ. Quantitative determination of intact glucosinolates in broccoli, broccoli sprouts, Brussels sprouts, and cauliflower by high-performance liquid chromatography-electrospray ionization-tandem mass spectrometry[J]. Analytical Biochemistry, 2005, 343(1): 93-99.
[16] 腊贵晓,孔海民,方萍,等.芥蓝芥子油苷提取条件优化研究[J].中国农业科技导报,2014,16(3):150-155.
[17] Lin CM, Wei CI. Antibacterial mechanism of allyl isothiocyanate[J]. Journal of Food Protection, 2000, 63(6): 727-734.
(责任编辑:敬廷桃)

