pOsHistone3启动子在烟草中的表达特性分析
胡明瑜 白文钦 潘晓雪 吴红 雷开荣
摘 要 启动子在基因表达调控中发挥重要作用,分析启动子表达特性对于基因功能研究和启动子的开发利用有重要意义。本研究克隆了水稻组蛋白基因OsHistone3的启动子pOsHistone3,在PlantCARE中分析显示包含脱落酸、茉莉酸甲酯等生长调节剂信号应答元件和胚乳、茎尖、分生组织等部位特异表达元件。进一步构建启动子分析载体并对烟草作遗传转化,GUS染色分析显示,pOsHistone3在转基因烟草幼嫩组织如茎尖、嫩叶中GUS活性较高,而在成熟组织中仅在维管组织周围检测到GUS活性,说明pOsHistone3具有组织表达特异性。这些结果初步表明OsHistone3基因作为表观遗传调控的一个重要基因,可能在转录水平参与了植物生长调节剂信号和植株发育调控的过程。
关键词 水稻;烟草;组蛋白;OsHistone3;植物生长调节剂;表达特性
中图分类号:S572;Q78 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2019.34.003
表观遗传调控在植物生长发育和适应环境的过程中发挥重要作用[1]。组蛋白修饰如组蛋白乙酰化、甲基化和泛素化等是表观遗传调控的方式之一。已有研究表明,组蛋白Histone3具有多种修饰酶和修饰位点,如甲基化酶ATX1、SDG8、SDG25和H3K4、H3K9、H3K27等,凭借对Histone3的不同修饰参与调控植物生长发育和环境应答反应[2]。在拟南芥中,ATX1激活WRKY70基因表达拮抗水杨酸和茉莉酸甲酯信号,PR1、THI2.1等水杨酸或茉莉酸甲酯信号应答基因的核小体也是ATX1蛋白的作用靶点[3]。SDG8能通过调控茉莉酸甲酯和乙烯信号相关基因,来防御芸薹生链格孢菌(Alternaria brassicicola)和灰葡萄孢菌石竹变种(Botrytis cinerea)等病原菌侵染[4]。
虽然Histone3是植物进行表观遗传调控的重要靶蛋白,在植物生长发育调控和适应环境等方面具有重要作用,但对Histone3基因自身的表达特性还研究较少。为此,我们克隆了水稻OsHistone3基因(LOC_Os11g05730)的启动子pOsHistone3,分析显示其含有多个植物生长调节剂应答元件和组织特异表达元件。在转基因烟草中的分析表明,pOsHistone3在幼嫩组织中高表达,而在成熟组织中仅在维管组织周围表达,说明水稻OsHistone3基因可能参与了植物幼嫩组织到成熟组织发育过程的调控。这些结果为进一步探索Histone3基因在调控植物生长发育和生长调节剂信号反应中的功能提供了参考。
1 材料与方法
1.1 实验材料
水稻“秀水03”(Oryza sativa L. “Xiushui 03”)和烟草(Nicotiana tabacum L.),是逆境农业研究重庆市重点实验室保存的试验材料。
1.2 实验方法
1.2.1 水稻和烟草基因组DNA提取
参照Luo等[5]的方法,取水稻或烟草嫩叶,用CTAB法提取基因组DNA。
1.2.2 启动子的克隆
根据LOC_Os11g05730的上游调控序列设计引物(上游引物:5- ATTGAGGAATGTGATTTAATC-3,下游引物:5- CGCGGAGGAGGGAGGAGGAGG-3),以“秀水03”基因组DNA为模板,扩增LOC_Os11g05730的启动子片段。PCR反应体系为:1×PCR Buffer、2.5 mmol·L-1 MgCl2、0.15 mmol·L-1 dNTPs、0.25 μmol·L-1引物、1U DNA聚合酶和约50 ng模板DNA。PCR反应程序为:94 ℃预变性5 min,1个循环;94 ℃变性30 s,56 ℃退火35 s,72 ℃延伸1 min,共32个循环;72 ℃延伸5 min,4 ℃保存。扩增产物于1%琼脂糖凝胶中电泳,切取特异性强的DNA条带,回收后,作TA克隆测序。
1.2.3 植物表达载体构建
测序鉴定的pOsHistone3启动子片段,用Hind III和Xba I双酶切,连入用相同酶切的pBI121载体,重组质粒即为启动子分析植物表达载体。
1.2.4 烟草遗传转化
采用葉盘转化法对烟草进行遗传转化。无菌苗叶片切成约0.5 cm×0.5 cm大小,用农杆菌菌液侵染10 min,外植体移入共培养基,24 ℃暗培养2~3 d;共培养后,外植体接入筛选培养基诱导分化,每2~3周继代1次;出现不定芽后,切下,转入生根培养基中生根。抗卡那霉素的阳性植株,提取DNA,用克隆pOsHistone3启动子的引物进行PCR鉴定。
1.2.5 烟草GUS染色分析
萌发约10 d的转基因烟草幼苗,浸入GUS染液,37 ℃孵育4 h,用75%乙醇脱色。四叶期幼苗和10~15片完全叶的烟草植株,用解剖刀徒手切取植物组织器官,浸入GUS染液,37 ℃孵育4 h,用75%乙醇脱色。
2 结果与分析
2.1 水稻OsHistone3基因启动子的克隆和调控元件分析
在国家水稻数据中心(http://www.ricedata.cn/index.htm)查找OsHistone3基因(LOC_Os11g05730)的上游调控序列,设计特异性引物,从“秀水03”基因组中扩增得到约1 000 bp的DNA片段。测序结果表明,克隆的DNA片段长度为963 bp,与数据库中登录的序列完全相同,命名为pOsHistone3。
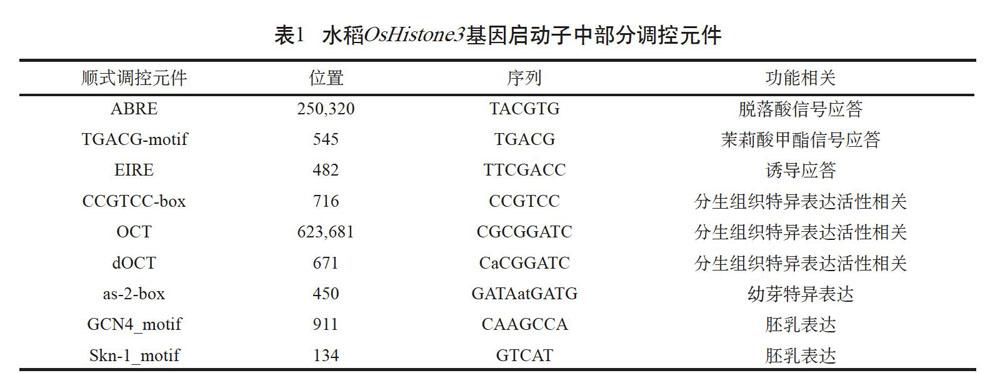
为了解pOsHistone3中的调控元件,在PlantCARE(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/)对顺式调控元件作了分析(见表1)。结果表明,pOsHistone3中不仅有脱落酸、茉莉酸甲酯等植物生长调节剂的信号调控元件,还有胚乳、茎尖、分生组织等部位特异表达元件;同时,还有大量环境信号应答元件,包括光反应、低温、干旱、缺氧反应和诱导子应答元件等。这些结果表明水稻OsHistone3同源基因的表达可能受到多种因素的调控。
2.2 pOsHistone3::GUS烟草的遗传转化
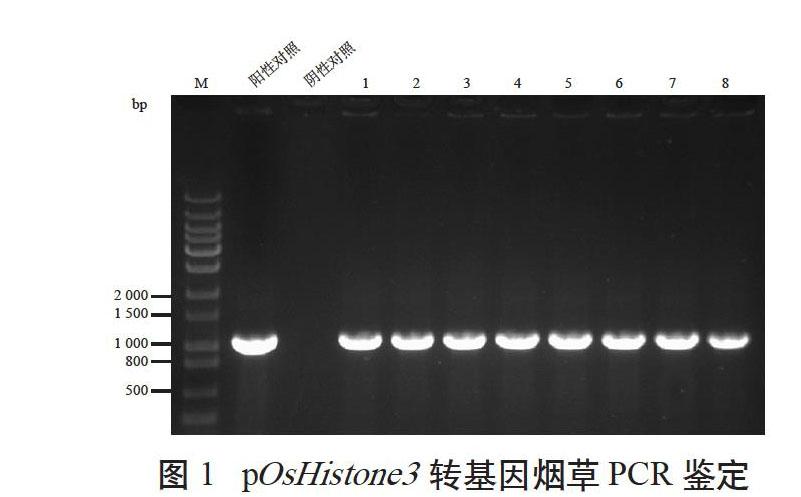
构建pOsHistone3控制GUS基因表达的植物表达载体,并导入农杆菌LBA4404。采用叶盘转化法对烟草作遗传转化,通过GUS组织化学染色,分析pOsHistone3在烟草中的表达特性。通过遗传转化,获得12株烟草再生植株,经鉴定获得8株转基因阳性植株(见图1)。
2.3 pOsHistone3在烟草中的表达特性分析
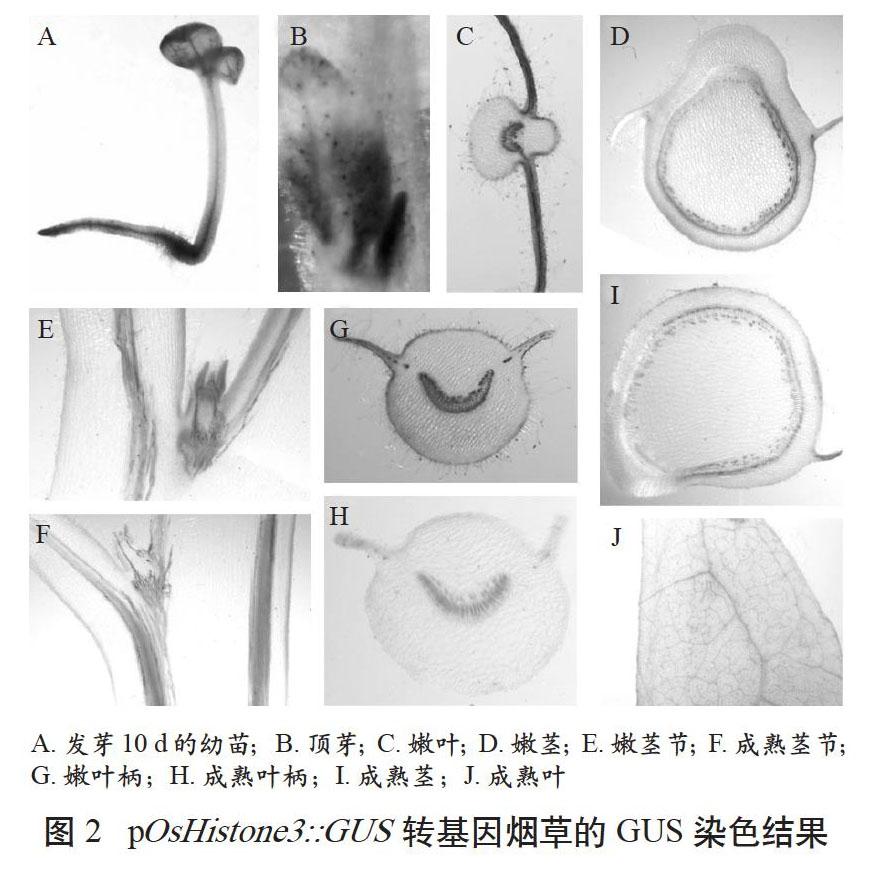
GUS染色结果表明,pOsHistone3在子叶和幼根中高表达(见图2A),在下胚轴中表达相对较低。在四叶期幼苗中,GUS在顶芽高表达(见图2B)。当植株生长出10~15片完全叶时,分别取幼嫩和成熟的茎叶作GUS染色,发现幼嫩叶、叶柄和茎中GUS活性相对较高(见图2CDG),在成熟茎的维管组织周围能检测到GUS活性(见图2I),而在成熟叶片和叶柄中不能检测到GUS活性(见图2HJ)。分别取成熟和幼嫩部位的腋芽作GUS染色,发现幼嫩部位的腋芽GUS活性较高(见图2E),而成熟部位的腋芽仅在维管组织周围检测到GUS活性(见图2F)。这些结果表明,pOsHistone3在烟草中具有组织表达特异性,在幼嫩组织中表达水平相对较高,在成熟组织中表达量较低甚至不表达。
3 小结
组蛋白Histone3是表观遗传调控的一个重要靶蛋白,通过对不同位点的修饰,来激发或抑制特定基因或功能元件的活性。如在水稻中,JMJ703是H3K4位点特异性去甲基酶,能特异地降低H3K4的甲基化水平,调控转座子的活性[6]。Histone3除了通过在蛋白质不同位点修饰的方式来参与表观遗传调控外,也有可能在基因表达水平参与植物生长发育调控,但这方面报道相对较少。
在前期研究中,发现水稻有多个OsHistone3同源基因,这些基因编码的蛋白质虽然高度保守,但在可修饰区段存在氨基酸位点差异(数据未发表),这些位点差异是否会影响OsHistone3蛋白的表观遗传调控尚未可知。本研究克隆了其中一个水稻OsHistone3同源基因的启动子,试图通过对该启动子调控元件和表达特性的分析,了解水稻不同的OsHistone3基因是否在表达水平参与植物生长发育的调控。
研究结果显示,克隆的pOsHistone3启动子包含植物生长调节剂信号调控元件和大量的环境信号响应元件,说明OsHistone3基因可能在转录水平受到多种信号途径的调控。进一步在烟草中分析pOsHistone3启动子的表达特性,发现该启动子主要在幼嫩组织中表达,在成熟组织中表达量很低甚至不表达。这些结果初步说明,组蛋白OsHistone3可能不仅在蛋白质修饰水平上参与表观遗传调控,而且在转录水平上对植物的生长发育可能也有重要的调控作用,这对于进一步揭示组蛋白Histone3的生物学功能有一定的参考价值。
参考文献:
[1] Juan S R, Aala A A, Naganand R, et al. Plant immunity: from signaling to epigenetic control of defense [J]. Trends in Plant Science, Published online: July 02, 2018.
[2] Zhou C, Zhao Y, Zhou S L, et al. Progresses and perspectives of crop epigenome research (in Chinese) [J]. Chinese Bulletin of Life Sciences (生命科学) , 2016, 28(10):1138-1145.
[3] Alvarez-Venegas R and Avramova Z. Methylation patterns of histone H3 Lys 4, Lys 9 and Lys 27 in transcriptionally active and inactive Arabidopsis genes and in atx1 mutants [J]. Nucleic Acids Research, 2005, 33(16): 5199-5207.
[4] Alexandre B, Emily J M, Abdelmalek A, et al. Arabidopsis histone methyltransferase SET DOMAIN GROUP8 mediates induction of the jasmonate/ethylene pathway genes in plant defense response to necrotrophic fungi [J]. Plant physiology, 2010, 154(3): 1403-1414.
[5] Luo M, Xiao Y H, Hou L, et al. Cloning and expression analysis of a LIM1 domain protein gene from cotton (Gossypium hirsuturm L.) (in Chinese) [J]. Acta Genetica Sinica (遺传学报), 2003, 30(2):175-182.
[6] Xiekui Cui, Ping Jin, Xia Cui, et al. Control of transposon activity by a histone H3K4 demethylase in rice [J]. Proceedings of the National Academy of Sciences, 2013, 110(5): 1953-1958.
(责任编辑:丁志祥)

