Na2EDTA滴定法测定复杂高铋物料中铅
(昆明西科工贸有限公司,昆明 650102)
前言
铅是柔软和延展性强的弱金属,有毒,也是重金属。铅具有比重大、熔点低、抗蚀性好、易于加工等特性,可用于建筑、铅酸蓄电池、弹头、炮弹、焊接物料、钓鱼用具、渔业用具、铅能吸收放射线,又可用于原子工业和防辐射设施、奖杯和部份合金,例如电子焊接用的铅锡合金,所以铅广泛应用于各工业部门。
对测定高含量铅的传统方法较多,有重量法及滴定法,重量法能得到准确的结果,但分析流程繁琐,应用很少。滴定法有EDTA滴定法[1]、铬酸铅滴定法及钡铬酸铅滴定法。现在广泛应用的是EDTA滴定法。有两种方式沉淀铅与其它元素分离,用硫酸冒烟,铅与硫酸根生产硫酸铅沉淀,与其它元素分离[2],用EDTA进行络合滴定[3-4],另外铅在稀硫酸介质中以硫酸钾为沉淀剂,使铅生成硫酸铅钾复盐沉淀与其它元素分离,用EDTA进行络合滴定[5-6],铅精矿化学分析方法及铅阳极泥化学分析方法也是用EDTA络合滴定法测定铅[7-8],但在分析工作中,对于大量铋的存在需进行掩蔽才能准确分析铅含量。
铜烟尘回收铅,在铅冶炼过程中产生的中间产品(铅铋合金)和中间渣料,其物料性质复杂,铅含量10%~90%,铋含量1%~60%,锑含量0.5%~15%,锡含量0.5%~20%,砷含量1%~20%,铜含量1%~40%,锌0.5%~5%,还含有金、铟、银、镉、铁等其它元素。铋、砷、锑、锡4种元素含量高且共存时会影响铅的测定。特别是铋含量高时,无论形成硫酸铅或硫酸铅钾沉淀过滤分离,铋都会与铅共同沉淀,从而使铅的测定结果偏高[2,9]。铋含量较高时可借助pH酸度计调节溶液pH值进行铋和铅的分别测定,但样品成分复杂时,在滴定铅时滴定终点变色不明显,常常无法判定滴定终点,这样不但耗时费工,也不能准确测定铅。有文献报道过用巯基乙酸掩蔽铋[9-10],但是巯基乙酸使用量大时,滴定终点不易判断,另外毒性大,有强烈的刺激性气味,对环境和操作人员都会造成危害。在稀硫酸介质中用酒石酸消除锑、锡效果良好,但不能消除铋的干扰,EDTA对锑络合效果较差,但能消除大量铋的干扰。
本文提出用EDTA-酒石酸联合掩蔽铋、砷、锑、锡,在稀硫酸介质中以硫酸钾为沉淀剂,使铅生成硫酸铅钾复盐沉淀而与铋、砷、锑、锡、铁、铜、锌、铝、钴、镍等干扰离子分离,沉淀以乙酸-乙酸钠浸取,二甲酚橙为指示剂,Na2EDTA滴定法测定铅。并研究了用EDTA-酒石酸联合掩蔽铋、砷、锑、锡的最佳条件。在其它实验条件确定下,加入0.5 g酒石酸和10~15 mL EDTA(50g/L)可以联合掩蔽:(0~100 mg铋,砷、锑、锡各20 mg,铅的加标回收率99.7%~101%,精密度、准确度都满足分析测定要求。
1 实验部分
1.1 主要试剂
铅标准溶液(5 mg/mL):称取5.000 0 g金属铅(ωPb≥99.99%)于300 mL烧杯中,加50 mL硝酸(1+1),待剧烈反应停止后,加热溶解,冷却后移入1 000 mL容量瓶中,以水定容,摇匀。
Na2EDTA标准溶液(约0.01 mol/L):称取18.6 g乙二胺四乙酸二钠(Na2EDTA)加水微热溶解,冷却,移入5 L试剂瓶中,用水稀释至5 L,混匀,放置3 d后标定。
铋标准溶液(5 mg/mL),锡标准溶液(5 mg/mL),锑标准溶液(5 mg/mL),砷标准溶液(5 mg/mL),二甲酚橙指示剂(5 g/L,不宜久放),EDTA溶液(50 g/L),硝酸(1+2),硫酸(1+1),硫酸-硫酸钾洗液[2.5 g硫酸钾溶于100 mL H2SO4(2%)溶液中],乙酸-乙酸钠缓冲溶液(pH值为5.5~6.0),巯基乙酸溶液(1+99)。
硫酸钾、抗坏血酸、酒石酸等所用试剂均为分析纯;试验用水均为二级水。
1.2 Na2EDTA标准滴定溶液的标定
移取10.00 mL铅标准溶液于250 mL烧杯中,加入30 mL乙酸-乙酸钠缓冲溶液,按实验方法进行。平行标定4份,其极差值不大于0.010 mg/mL,取其平均值。否则重新标定。随同标定做空白实验。
1.3 实验方法
分别移取10.00 mL铅标准溶液、10 mL铋标准溶液、4 mL锡标准溶液、4 mL锑标准溶液、4 mL砷标准溶液于300 mL烧杯中,加入10 mL EDTA(50 g/L),0.5 g酒石酸,微热,取下,加入5 g硫酸钾,加水至150 mL,搅拌下加入7 mL硫酸(1+1),在低温电炉上加热煮沸5 min,低温保温5 min,取下冷却,加入少许抗坏血酸,静置2 h(或流水冷却1 h)。用慢速定量滤纸过滤,用硫酸-硫酸钾洗液洗涤烧杯7次,沉淀10次,用水洗烧杯1次,沉淀2次,弃去滤液。将滤纸连同沉淀一起移入原烧杯中,加入30 mL乙酸-乙酸钠缓冲溶液,用水吹洗杯壁,盖上表面皿,加热煮沸5 min,取下稍冷,加水至150 mL[对铁含量高及复杂样品可加少许抗坏血酸及0.5 mL柠檬酸(200 g/L)],2滴二甲酚橙指示剂,用Na2EDTA标准溶液滴定至溶液由紫红变为刚亮黄为终点。终点有突跃的样品可不必加柠檬酸。
1.4 样品处理
1.4.1合金样
准确称取2.0 g(精确至0.000 1 g)合金样品于300 mL烧杯中,加1 g酒石酸及50 mL硝酸(1+2),盖上表面皿,于低温电炉上加热溶解样品,待样品溶解完全后,取下冷却。移入500 mL容量瓶,用水稀释至刻度,混匀。移取20.0 mL分液于300 mL烧杯中,加入10 mL EDTA(5%)及0.5 g酒石酸,微热,加入5 g硫酸钾,加水至150 mL,以下同实验方法。
1.4.2渣样
准确称取0.10~0.20 g(精确至0.000 1 g)渣样于300 mL烧杯中,以少量水润湿,加入10 mL盐酸、3~5滴氢氟酸(视硅含量滴加),盖上表面皿,于低温电炉上加热溶解5 min,加入5 mL硝酸,继续加热溶解至体积约1 mL,用水吹洗杯壁及表面皿,加入10 mL EDTA(5%)及0.5 g酒石酸,微热溶解盐类,取下,加入5 g硫酸钾,加水至150 mL,以下同实验方法。
2 结果与讨论
2.1 分析方法对比
2.1.1硫酸铅沉淀
准确称取2.0 g(精确至0.000 1 g)合金样品于300 mL烧杯中,加50 mL硝酸(1+2),盖上表面皿,于低温电炉上加热溶解样品,待样品溶解完全后,取下冷却。移入500 mL容量瓶中,用水稀释至刻度,混匀。移取3份20.0 mL分液于300 mL烧杯中,加入20 mL硫酸,加热至冒浓白烟,取下稍冷,加5 mL氢溴酸,加热至冒浓白烟,取下稍冷,加5 mL氢溴酸,继续加热至体积约5 mL,取下冷却,加0.5 g酒石酸,用水吹洗表面皿及杯壁,体积约100 mL,加热煮沸5 min,取下冷却,静置2 h。用慢速定量滤纸过滤,用硫酸洗液洗涤烧杯7次,沉淀10次,弃去滤液。将滤纸连同沉淀一起移入原烧杯中,加入30 mL乙酸-乙酸钠缓冲溶液,用水吹洗杯壁,盖上表面皿,加热煮沸5 min,取下稍冷,加水至150 mL[对铁含量高及复杂样品可加少许抗坏血酸及0.5 mL柠檬酸(200 g/L)],2滴二甲酚橙指示剂,搅匀,边搅拌边加入3mL巯基乙酸溶液,用Na2EDTA标准溶液滴定至溶液由紫红变为刚亮黄为终点。
2.1.2铅铋连续滴定
准确称取2.0 g(精确至0.000 1 g)合金样品于300 mL烧杯中,加1 g酒石酸,加50 mL硝酸(1+2),盖上表面皿,于低温电炉上加热溶解样品,待样品溶解完全后,取下冷却。移入500 mL容量瓶,用水稀释至刻度,混匀。移取3份20.0 mL分液于300 mL烧杯中,加入10 mL硫脲饱和溶液,50 mL水,少量抗坏血酸,摇匀,加入1滴二甲酚橙指示剂,用乙酸-乙酸钠缓冲溶液在精密pH计上调节pH值1.7~1.9,用Na2EDTA标准溶液滴定至溶液由紫红变为刚亮黄为终点。继续用乙酸-乙酸钠缓冲溶液在精密pH计上调节pH值5.5~6.0,补加入1滴二甲酚橙指示剂,用Na2EDTA标准溶液滴定至溶液由紫红变为刚亮黄为终点。
2.1.3Na2EDTA滴定法
分别准确称取3份合金样按样品处理步骤进行操作,其测定结果与硫酸铅沉淀法和铅铋连续滴定法测定结果进行对比,结果见表1。
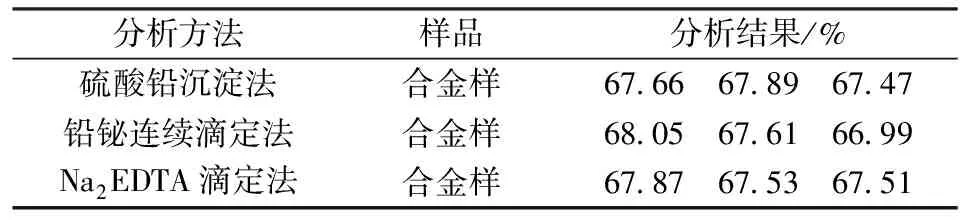
表1 三种分析方法测定结果对比
由表1可以看出:复杂高铋物料用铅铋连续滴定法,终点难判断,测定结果重现性即精密度较差;传统硫酸铅沉淀法和Na2EDTA滴定法测定铅的结果重现性好,但因硫酸铅沉淀法对环境和操作人员都会造成危害,故实验选择Na2EDTA滴定法测定复杂高铋物料中铅。
2.2 沉淀条件的确定
2.2.1硫酸用量
为确保硫酸铅钾沉淀完全,对硫酸用量进行考察。其它条件不变的情况下,按照实验方法,分别加入3、5、7、9 mL硫酸(1+1)进行实验,结果见表2。
由表2 可以看出:硫酸(1+1)的用量3~9 mL,铅的回收率在99.7%~99.8%,硫酸用量在实验用量范围内对铅的测定影响不大,实验选择加入7 mL硫酸(1+1)。

表2 硫酸用量对铅测定的影响
2.2.2硫酸钾用量
为确保硫酸铅钾沉淀完全,对硫酸钾用量进行考察。其它条件不变的情况下,按照实验方法,分别加入3、5、7 g硫酸钾进行实验,结果见表3。
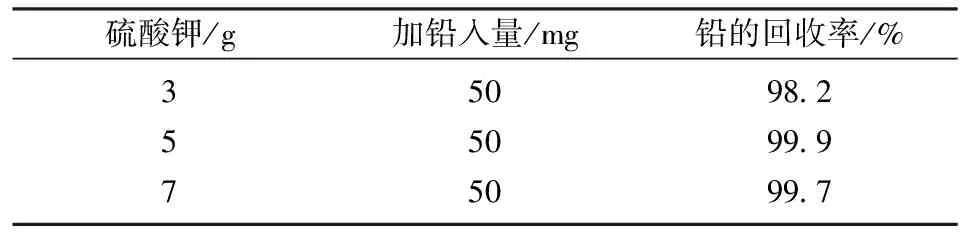
表3 硫酸钾用量对铅测定的影响
由表3 可以看出:硫酸钾的用量5、7 g时,铅的回收率在99.7%~99.9%,而硫酸钾的用量在3 g时,铅的回收率只有98.2%,在实验条件下硫酸钾的用量在5~7 g时铅的回收率令人满意,控制待沉淀分离的溶液中铅含量为50 mg左右时,选择硫酸钾用量为5 g。用硫酸冒烟可减少硫酸钾的用量,但硫酸烟污染环境,故实验不采用硫酸冒烟后沉淀铅。
2.2.3沉淀煮沸时间
为确保硫酸铅钾沉淀完全,在加入硫酸后对煮沸时间进行了考察。其它条件不变的情况下,按实验步骤进行操作,并设置煮沸时间分别为1、3、5、8、10、15 min进行实验[10]。结果表明,铅的回收率分别为98.3%、98.6%、99.7%、99.9%、99.8%、101%,这说明煮沸时间在5~15 min范围内对铅测定的影响不大,沉淀煮沸时间小于5 min,铅的回收率偏低,实验选择沉淀煮沸时间为5 min。
2.2.4沉淀陈化时间
其它条件不变的情况下,按照实验步骤对陈化时间进行了考察,沉淀陈化时间在1.5~3.0 h范围内对铅的测定影响不大,实验选择陈化时间为2 h,流水冷却只需1 h[10-11]。在沉淀煮沸5 min后,低温保温5 min使硫酸铅钾复盐沉淀的晶粒慢慢长大,易过滤洗涤。沉淀时加入少许抗坏血酸消除铁的干扰。
2.3 共存元素的干扰及消除
2.3.1EDTA用量
铋易水解且会干扰铅的测定[3,9],故实验采用沉淀铅时用EDTA来掩蔽铋以消除对铅的干扰。其它条件不变的情况下,分别加入铋标准溶液0~100 mg,加入不同量的EDTA(50 g/L)溶液,按实验步骤进行操作,实验结果见表4。
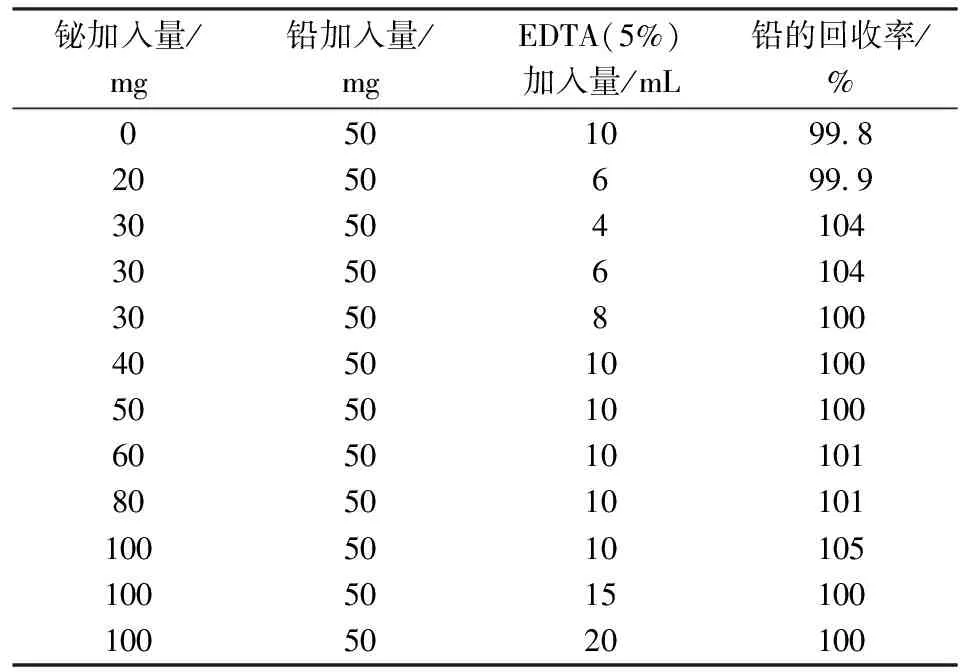
表4 铋对铅测定的干扰和消除实验
由表4可以看出:当溶液中未加入铋时,加入10 mL EDTA并不影响铅的回收率;当加入10 mL EDTA(50 g/L)时能够完全消除铋的干扰限量为80 mg,铅的回收率在99.8%~104%,当铋含量达100 mg时,加入15 mL EDTA(50 g/L),也能使铅的沉淀结果准确,根据样品中铋的含量选择加入10~15 mL EDTA (50 g/L)均可,实验选择加入10 mL EDTA(50 g/L)。
2.3.2酒石酸用量
含锡、锑量高时,易水解夹杂于沉淀中影响测定,加0.5 g酒石酸可消除50 mg锑及锡的干扰,但不能消除大量铋的影响,锡、砷、锑、铋4种元素共存时对铅测定的影响更为复杂,加入EDTA-酒石酸联合掩蔽铋、砷、锑、锡。其它条件不变的情况下,按照实验方法,分别加入酒石酸0.3、0.5、0.8 g进行实验,结果见表5。
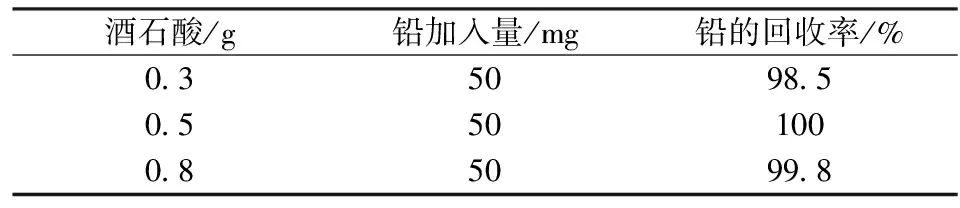
表5 酒石酸用量对铅测定的影响
由表5可以看出:酒石酸的用量0.5、0.8 g时,铅的回收率在99.8%~100%,而酒石酸的用量0.3 g时,铅的回收率只有98.5%,说明酒石酸的用量大于0.5 g时对铅的测定影响不大,考虑到在保证准确度的情况下试剂用量越少越好,实验选择酒石酸用量0.5 g。
2.4 精密度与准确度实验
准确称取11份合金样(铋含量15.91%、锡含量3.68、锑含量4.86%、砷含量6.49%),按样品处理流程进行分析;准确称取11份铅精矿(标准样品BY0111-1铅含量58.06%)0.15 g(精确至0.000 1 g)于300 mL烧杯中,加入50 mg铋,20 mg砷、20 mg锡、20 mg锑,按样品处理流程进行处理,分析结果见表6。结果准确、可靠。
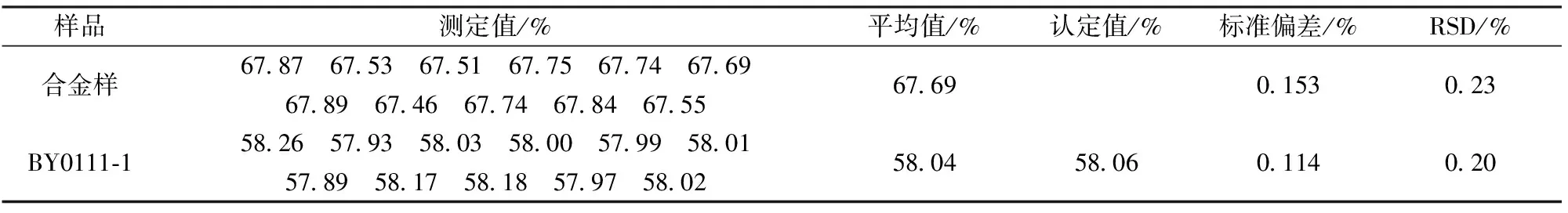
表6 合金样和铅精矿标准样品的测定结果
3 结语
探讨了用EDTA-酒石酸联合掩蔽铋、锑、锡及在稀硫酸介质中(硫酸浓度为0.42 mol/L)以硫酸钾为沉淀剂,使铅生成硫酸铅钾复盐沉淀的最佳条件。另外,在做BY0111-1铅精矿管理样中加入铋、砷、锑、锡验证本文实验方法时,铅的重现性及精密度很好,RSD为0.20%;但在硫酸发烟时用盐酸及氢溴酸除锑、锡、砷时,铅的重现性及精密度较差。方法现已应用在铅冶炼过程中产生的中间产品(铅铋合金)和中间渣料中铅的测定,工艺流程中金属平衡良好。铅测定范围为ωPb>5%,不适用于钡高于1%的样品中铅的测定。

